文章信息
- PD1/PD-L1激活促进癌症发生、发展和转移的研究进展
- Novel Findings on Activation of PD1/PD-L1 that Contributes to Cancer Development and Metastasis
- 肿瘤防治研究, 2017, 44(6): 423-427
- Cancer Research on Prevention and Treatment, 2017, 44(6): 423-427
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2017.17.0087
- 收稿日期: 2017-02-03
- 修回日期: 2017-04-16
2. 518055 深圳,南方科技大学医学院;
3. 15232 宾夕法尼亚州匹兹堡,美国匹兹堡大学医学院泌尿系
2. School of Medicine, Southern University of Science and Technology, Shenzhen 518055, China;
3. Department of Urology, University of Pittsburgh School of Medicine, Pittsburgh, Pennsylvania 15232, USA
ZHANG Jian, E-mail:jianzhang008@hotmail.com
1992年,Ishida等[1]通过消减杂交技术在程序性凋亡的T细胞杂交瘤中检测到PD1(programmed cell death protein-1)基因的表达。然而早期研究人员对PD1功能及作用机制尚未阐明。1999年,Dong等[2-3]首次克隆并鉴定了人类B7共刺激分子(B7 homolog 1, B7-H1)的T细胞调节功能,B7-H1与其受体PD1的结合在体外抑制T细胞的增殖和某些细胞因子的分泌,报道B7-H1参与肿瘤免疫逃逸并在多种人类肿瘤组织中特异性表达。2000年,Freeman等[4]进一步证实B7-H1与PD1相互作用,后来将其命名为PD-L1(programmed death-ligand 1)。PD1/PD-L1属于免疫球蛋白超家族B7-CD28协同刺激分子的关键成员,参与自身免疫、肿瘤免疫的调节过程。目前,靶向PD1/PD-L1单克隆抗体类药物的研发是肿瘤治疗领域的研究热点。
1 PD1/PD-L1表达与功能PD1为Ⅰ型跨膜糖蛋白,分子量50~55 kD,属于免疫球蛋白超家族B7-CD28中的一员,是重要的免疫抑制受体,主要表达于活化的T细胞、B细胞、自然杀伤细胞、单核细胞以及间充质干细胞[5]。PD1是维持自身耐受性的重要因子,在生理条件下PD1通过T细胞(抗原)受体TCR(T cell receptor)识别抗原,调节外周组织中T细胞的功能,调控机体对外来或自身抗原的免疫应答反应,防止免疫相关疾病的发生。
PD-L1和PD-L2是PD1的配体,是免疫反应中重要的负性调控因子。PD-L1(B7-H1),也称为CD274,由CD274基因编码,是分子量为40kD的细胞表面糖蛋白,属于B7家族。研究发现,PD-L1蛋白主要表达于抗原提呈细胞(antigen presenting cell, APC)、活化的T细胞、B细胞、巨噬细胞、胎盘滋养层细胞、心脏内皮细胞和胸腺皮质上皮细胞[6]。T细胞表面受体PD1与其配体PD-L1结合后,招募蛋白酪氨酸磷酸酶1(src homology region 2 domain-containing phosphatase-1, SHP-1)和SHP-2,生成一个阻滞信号抑制下游效应PI3K/Akt通路的磷酸化以及mTOR和ERK2的活化,促进CD4+Foxp3-T细胞向CD4+Foxp3+ Tregs分化[7]。
PD-L2与PD-L1氨基酸序列约40%相同,细胞外区有IgC和IgV型结构域,它们结构相似。但两者表达分布不一样,PD-L2比PD-L1的分布局限。PD-L2主要在APC中表达,比如树突状细胞和活化的巨噬细胞[8]。PD-L2参与Th1/Th2平衡和巨噬细胞的激活,分泌某些淋巴因子,提供T细胞活化的刺激信号[9]。PD1与PD-L2的结合能显著抑制TCR介导的CD4+T细胞增殖和细胞因子的产生。
2 PD1/PD-L1与肿瘤 2.1 PD1/PD-L1在肿瘤细胞中的表达及作用PD-L1在肿瘤组织比正常组织表达明显升高,并且在多数肿瘤细胞表面表达,包括非小细胞肺癌、黑色素瘤、胃癌、结肠癌、乳腺癌、胰腺癌、肾癌等[10]。Koh等[11]发现PD1与经典型霍奇金淋巴瘤患者的不良预后有关,降低PD1的表达水平可提高患者的总体生存率。RS(Reed-Sternberg)细胞是霍奇金淋巴瘤的特征性细胞,其表面高表达PD-L1。当RS细胞上过表达的PD-L1与相应的受体PD1结合,能够抑制T细胞的增殖活化,促进RS细胞的生长,产生转移灶。
循环肿瘤细胞(CTC)是免疫检查点封锁疗法的一个重要预测性指标。研究发现,CTC通过调控PD-L1的表达水平介导肿瘤细胞发生远处转移,且CTC循环集落的转移和肿瘤形成能力是单个CTC的23~50倍[12]。Mazal等[13]发现在16例有CTC的转移性乳腺癌患者中有11例(68.6%)高表达PD-L1。提示可通过靶向干预PD-L1来调控CTC,减少乳腺癌的转移和复发。
播散肿瘤细胞(DTC)通过原发肿瘤位点进入血液、骨髓和淋巴结,转移到机体的其他组织或器官形成新的转移灶,成为肿瘤复发的根源。目前,DTC与PD1/PD-L1之间的关系尚未证实,但有相关文献报道,肿瘤微环境能够促进播散肿瘤细胞(DTC)的形成,且PD-L1在肿瘤微环境中高表达,所以PD1/PD-L1与DTC的相关性是一个值得进一步探讨的问题[14]。
2.2 PD1/PD-L1在肿瘤微环境中的表达及作用陈列平1992年首次将B7共刺激分子(B7-H1)引入到肿瘤领域。Dong等[3]通过建立小鼠肿瘤模型P815阻断PD1/PD-L1通路,显著减少活化的肿瘤反应性T细胞的凋亡,并抑制高度免疫原性的B7-H1(+)肿瘤生长。这是国际上首次证明PD1/PD-L1途径作为肿瘤免疫逃逸的可能机制。在肿瘤微环境中,肿瘤相关巨噬细胞(TAM)能促进肿瘤的浸润和转移,是肿瘤免疫效应的重要参与者。一方面,TAM分泌的血管内皮生长因子VEGF、IL-1β、TNF、IL-10可吸引Tregs并促进肿瘤细胞表面表达PD-L1,抑制效应T细胞的功能,介导肿瘤细胞向远处浸润转移。在非小细胞肺癌中,Chen等[15]通过免疫组织化学染色,发现在136例患者中有65.3%的患者PD-L1表达阳性,且TAM和PD-L1都与淋巴结转移呈负相关。
PD1和Treg细胞均参与肿瘤的远处转移复发,高水平的PD1能够加强Treg细胞的抑制功能。一些淋巴细胞趋化因子如CCL2、CXCR2、CXCL5,能够提高PD-L1的表达水平,诱导EMT的发生,并促进癌症的浸润转移[16]。阻断CXCR2的表达能提高PD1抗体对免疫治疗的敏感度,增加CD3+T细胞在肿瘤组织中的浸润和CD4+、CD8+ T细胞的活性,抑制肿瘤浸润和转移[17]。
3 PD1/PD-L1抗体在肿瘤免疫治疗中的临床研究目前,PD1/PD-L1的抑制药物在不同的肿瘤治疗中均取得了很好的研究基础,其中部分药物已取得美国食品药物管理局(FDA)加速审批的资格,并逐渐应用于临床肿瘤免疫治疗,见表 1。
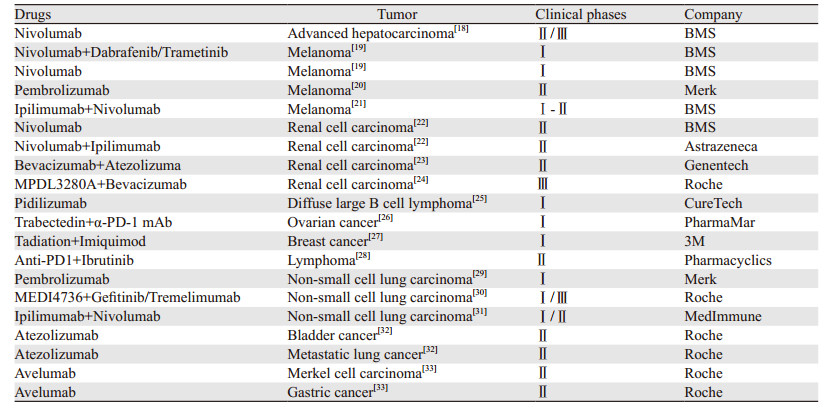 |
Nivolumab,属于抗PD1的单克隆抗体,能恢复T细胞抗肿瘤免疫应答的活性。2017年百时美施贵宝(BMS)公司公布了Nivolumab针对214名晚期肝癌患者单药使用的最新数据,43名患者的肿瘤缩小至少30%,客观有效率提升至20%;64名患者的肿瘤稳定,疾病控制率高达64%;9月生存率74%;3~4级不良反应比例为20%[18]。最新一项Ⅲ期临床研究结果首次证明Nivolumab可以显著延长晚期胃癌患者的生存期。
Pembrolizumab是在美国上市的第一个人源化的PD1单克隆抗体,作为治疗黑色素瘤的二线药物。Goldberg等[20]通过招募52例PD-L1表达阳性的黑色素瘤脑转移患者和非小细胞肺癌脑转移患者进行PembrolizumabⅡ期临床试验研究,结果显示黑色素瘤脑转移患者客观缓解率为22%,非小细胞肺癌脑转移患者客观缓解率为33%。2017年1月,欧盟委员会(EC)公布305例PD-L1强阳性非小肺癌患者的最新结果[29],其中Pembrolizumab治疗组的有效率是44.6%,中位无进展生存期为10.3月;而化疗组的有效率为27.8%,中位无进展生存期为6月。
Atezolizumab是FDA批准的第一个用于膀胱癌和转移性非小细胞肺癌免疫治疗的抗PD-L1免疫治疗药物。在一项顺铂治疗失败的晚期或转移性尿路上皮癌的Ⅱ期临床试验中,结果显示Atezolizumab治疗使15%的患者肿瘤体积缩小。而在PD-L1高表达的患者中,Atezolizumab治疗使26%的患者肿瘤体积缩小[32]。这说明患者肿瘤PD-L1表达水平越高,所实现的缓解程度也越大。同时,Tezolizumab可作为晚期尿路上皮癌顺铂的替代治疗。最近罗氏公司公布一项Ⅲ期临床试验研究结果,应用Atezolizumab治疗转移性肺癌患者比应用化疗药物多西他赛治疗后的中位生存期长4.2月,但该试验结果与患者的PD-L1表达水平差异无关[34]。这说明PD-L1不能作为预后疗效判断的特异分子标记,且不是影响免疫治疗药物Atezolizumab对转移性肿瘤治疗效果的唯一因素,可能与肿瘤类型、肿瘤浸润细胞(TIL)的存在以及其他抑制性通路的影响有关。
Avelumab是针对转移性Merkel细胞癌(MCC)和胃癌免疫治疗的PD-L1靶向抗体药物。最新研究发现,在应用Avelumab治疗的88名MCC患者中客观反应率为31.8%,其中8名患者完全缓解,20名患者部分缓解,中位生存期为10.4月。但其中6%的患者出现与Avelumab相关的不良反应,包括小肠结肠炎、转氨酶升高、软骨钙质沉着病、滑膜炎、间质性肾炎等[33]。这说明Avelumab对于MCC免疫治疗的有效性,但不良反应事件和安全性还有待进一步验证。
许多研究表明PD1/PD-L1抗体表现出显著的抗肿瘤活性。但最新研究发现某些肿瘤患者接受PD1/PD-L1单克隆抗体治疗后肿瘤的生长速度加快,呈现疾病高度进展模式(highly progressive disease, HPD)。Champiat等[35]通过分析218位应用PD1/PD-L1单克隆抗体进行Ⅰ期临床试验的肿瘤患者的疗效,发现在131例可评估肿瘤生长率(TGR)的肿瘤患者中有12例(9%)出现HPD,其中19%的HPD患者为65岁以上,只有4%的HPD患者为64岁以下。应用PD1抗体或PD-L1抗体出现HPD的结果没有明显差异,且在不同类型肿瘤治疗中也没有明显差异。有关HPD产生及相关的分子机制尚需进一步研究证实。但该项发现的最大意义在于临床上对老年人应用PD1或PD-L1阻断剂会更加谨慎,且对接下来的研究具有指导意义。
3.2 PD1/PD-L1抗体与其他治疗方法联合治疗肿瘤细胞通过其他途径发生转移,产生新的转移病灶,使免疫应答反应不能有效地发挥杀伤肿瘤作用,从而导致肿瘤细胞对单一治疗不敏感或者产生耐药现象。联合治疗将开辟新的治疗途径,替代传统的放化疗和单一治疗。
Allard等[36]通过建立小鼠转移瘤模型观察肿瘤发生、发展动态,利用PD1抗体和CD73抗体联合治疗,结果显示C57BL/6小鼠转移瘤生长受到抑制,且小鼠的寿命延长。Larkin等[21]应用Nivolumab联合Ipilimumab治疗945例转移性黑色素瘤患者也得到了很好的效果,其中316例患者同期接受Nivolumab单独治疗,结果显示无进展生存期为6.9月。而315例患者接受Ipilimumab的治疗,其无进展生存期为2.9月。另外314例患者接受Nivolumab和Ipilimumab联合治疗,其疗效最好,无进展生存期达11.5月。
目前,PD1/PD-L1抑制剂联合化疗药物治疗肺癌备受人们关注。Rizvi等[37]通过招募56名非小细胞肺癌患者,进行PD1抑制剂Nivolumab与不同化疗药物联合治疗,分别是Nivolumab+吉西他滨+卡铂、Nivolumab+培美曲塞+卡铂、Nivolumab+紫杉醇+卡铂。结果显示,每一组患者肿瘤缩小至少30%,其比例分别是33%、47%、47%,一年的生存率分别为50%、87%、60%。这说明PD1联合化疗药物对于非小细胞肺癌患者具有很好的疗效,但是其中不同组间的差异可能与不同化疗药物产生的不良反应有关。
最近《新英格兰医学杂志》公布了MERK的Opdivo(PD1抗体)和Yervoy(CTLA-4抗体)联合治疗转移性黑色素瘤的数据,该项研究数据显示在PD-L1表达阳性的患者中,其无进展生存期(PFS)为14月,PD-L1阴性的患者PFS为11.2月,这表明联合治疗的效果与PD-L1的表达存在相关性。从肿瘤缩小的程度来看,Opdivo单用缩小34%,Yervoy单用缩小6%,联合应用缩小51%,表明联合治疗优于单独用药[21]。
上述研究表明,恶性肿瘤的单一治疗虽有效,但联合治疗可能带来更好的疗效。联合应用的药物不同,显示出的客观有效率也不一样,患者治疗后的生存率也不同。总的来说,联合免疫抑制检查点的治疗相对于传统手术和放化疗,患者表现出的不良反应小、疗效更显著,可能为肿瘤免疫治疗提供一条有效途径。
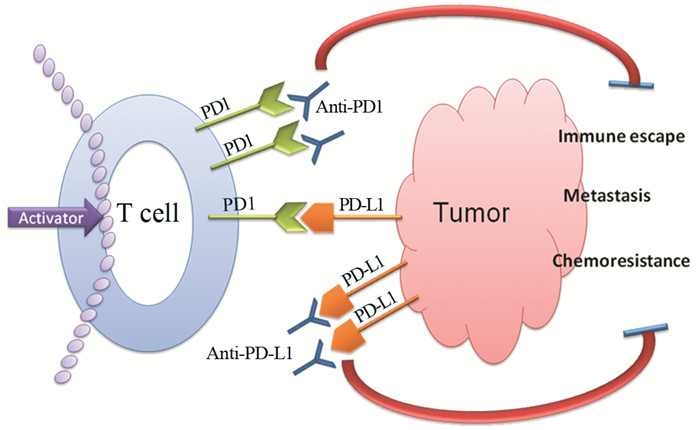
4 结论及展望免疫负性调控分子PD1/PD-L1在癌症转移中的作用越来越引起人们的重视。PD-L1表达于不同肿瘤细胞的表面,其高表达会增强癌细胞抵抗机体免疫系统的攻击能力,是肿瘤发生、发展和转移的重要因素。此外,肿瘤浸润淋巴细胞、CTC、TAM等通过调节PD-L1的表达促进肿瘤的浸润、转移和复发。通过应用PD1抑制剂或PD-L1抑制剂阻断PD1与PD-L1结合,刺激免疫系统,恢复T细胞活性,增强抗肿瘤免疫效应,见图 1。目前,PD1/PD-L1抑制剂已应用于肺癌、黑色素瘤、肾细胞癌等肿瘤治疗中,其他肿瘤如胰腺癌、三阴性乳腺癌、结直肠癌正处于临床试验阶段。PD1或PD-L1抑制剂效果优于传统放化疗,且联合治疗优于单独用药。可以期待,免疫治疗在不久的将来会像化疗一样成为肿瘤患者的常规治疗手段之一。
|
| The interaction of programmed cell death protein-1 (PD1) and programmed cell death protein-1 ligand 1 (PD-L1) inhibits the activation of T cells which leads to the escape of tumor cells from the host immune system. PD1/PD-L1, as the target of anti-tumor therapy, provides a new option for clinical treatment 图 1 PD1或PD-L1抑制剂对肿瘤的作用机制 Figure 1 Application mechanism of PD1 inhibitors or PD-L1 inhibitors on tumor |
| [1] | Ishida Y, Agata Y, Shibahara K, et al. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death[J].EMBO J, 1992, 11(11): 3887–95. |
| [2] | Dong H, Zhu G, Tamada K, et al. B7-H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin-10 secretion[J].Nat Med, 1999, 5(12): 1365–9. DOI:10.1038/70932 |
| [3] | Dong H, Strome SE, Salomao DR, et al. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion[J].Nat Med, 2002, 8(8): 793–800. |
| [4] | Freeman GJ, Long AJ, Iwai Y, et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation[J].J Exp Med, 2000, 192(7): 1027–34. DOI:10.1084/jem.192.7.1027 |
| [5] | Böger C, Behrens HM, Mathiak M, et al. PD-L1 is an independent prognostic predictor in gastric cancer of Western patients[J].Oncotarget, 2016, 7(17): 24269–83. |
| [6] | Iraolagoitia XL, Spallanzani RG, Torres NI, et al. NK cells restrain spontaneous antitumor CD8+ T cell priming through PD-1/PD-L1 interactions with dendritic cells[J].J Immunol, 2016, 197(3): 953–61. DOI:10.4049/jimmunol.1502291 |
| [7] | Liu H, Bakthavatsalam R, Meng Z, et al. PD-L1 signal on liver dendritic cells is critical for Foxp3(+)CD4(+)CD25(+) Treg and liver tolerance induction in mice[J].Transplant Proc, 2013, 45(5): 1853–5. DOI:10.1016/j.transproceed.2013.03.015 |
| [8] | Latchman Y, Wood CR, Chernova T, et al. PD-L2 is a second ligand for PD-1 and inhibits T cell activation[J].Nat Immunol, 2001, 2(3): 261–8. DOI:10.1038/85330 |
| [9] | Stempin CC, Motran CC, Aoki MP, et al. PD-L2 negatively regulates Th1-mediated immunopathology during Fasciola hepatica infection[J].Oncotarget, 2016, 7(47): 77721–31. |
| [10] | Wolchok JD, Chan TA. Cancer: Antitumour immunity gets a boost[J].Nature, 2014, 515(7528): 496–8. DOI:10.1038/515496a |
| [11] | Koh YW, Jeon YK, Yoon DH, et al. Programmed death 1 expression in the peritumoral microenvironment is associated with a poorer prognosis in classical Hodgkin lymphoma[J].Tumour Biol, 2016, 37(6): 7507–14. DOI:10.1007/s13277-015-4622-5 |
| [12] | Wang X, Sun Q, Liu Q, et al. CTC immune escape mediated by PD-L1[J].Med Hypotheses, 2016, 93: 138–9. DOI:10.1016/j.mehy.2016.05.022 |
| [13] | Mazel M, Jacot W, Pantel K, et al. Frequent expression of PD-L1 on circulating breast cancer cells[J].Mol Oncol, 2015, 9(9): 1773–82. DOI:10.1016/j.molonc.2015.05.009 |
| [14] | Aktas B, Bankfalvi A, Heubner M, et al. Evaluation and correlation of risk recurrence in early breast cancer assessed by Oncotype DX(R), clinicopathological markers and tumor cell dissemination in the blood and bone marrow[J].Mol Clin Oncol, 2013, 1(6): 1049–54. |
| [15] | Chen YY, Wang LB, Zhu HL, et al. Relationship between programmed death-ligand 1 and clinicopathological characteristics in non-small cell lung cancer patients[J].Chin Med Sci J, 2013, 28(3): 147–51. DOI:10.1016/S1001-9294(13)60040-1 |
| [16] | Zhou SL, Zhou ZJ, Hu ZQ, et al. CXCR2/CXCL5 axis contributes to epithelial-mesenchymal transition of HCC cells through activating PI3K/Akt/GSK-3beta/Snail signaling[J].Cancer Lett, 2015, 358(2): 124–35. DOI:10.1016/j.canlet.2014.11.044 |
| [17] | Steele CW, Karim SA, Leach JD, et al. CXCR2 Inhibition Profoundly Suppresses Metastases and Augments Immunotherapy in Pancreatic Ductal Adenocarcinoma[J].Cancer Cell, 2016, 29(6): 832–45. DOI:10.1016/j.ccell.2016.04.014 |
| [18] | Trojan J, Sarrazin C. Complete response of hepatocellular carcinoma in a patient with end-stage liver disease treated with nivolumab: whishful thinking or possible?[J].Am J Gastroenterol, 2016, 111(8): 1208–9. |
| [19] | Mehta A, Gupta A, Hannallah F, et al. Myocarditis as an immune-related adverse event with ipilimumab/nivolumab combination therapy for metastatic melanoma[J].Melanoma Res, 2016, 26(3): 319–20. DOI:10.1097/CMR.0000000000000251 |
| [20] | Goldberg SB, Gettinger SN, Mahajan A, et al. Pembrolizumab for patients with melanoma or non-small-cell lung cancer and untreated brain metastases: early analysis of a non-randomised, open-label, phase 2 trial[J].Lancet Oncol, 2016, 17(7): 976–83. DOI:10.1016/S1470-2045(16)30053-5 |
| [21] | Larkin J, Chiarion-Sileni V, Gonzalez R, et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma[J].N Engl J Med, 2015, 373(1): 23–34. DOI:10.1056/NEJMoa1504030 |
| [22] | Atkins MB, Philips GK. Emerging monoclonal antibodies for the treatment of renal cell carcinoma (RCC)[J].Expert Opin Emerg Drugs, 2016, 21(3): 243–54. DOI:10.1080/14728214.2016.1226798 |
| [23] | Wallin JJ, Bendell JC, Funke R, et al. Atezolizumab in combination with bevacizumab enhances antigen-specific T-cell migration in metastatic renal cell carcinoma[J].Nat Commun, 2016, 7: 12624. DOI:10.1038/ncomms12624 |
| [24] | Herbst RS, Soria JC, Kowanetz M, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients[J].Nature, 2014, 515(7528): 563–7. DOI:10.1038/nature14011 |
| [25] | Armand P, Nagler A, Weller EA, et al. Disabling immune tolerance by programmed death-1 blockade with pidilizumab after autologous hematopoietic stem-cell transplantation for diffuse large B-cell lymphoma: results of an international phaseⅡtrial[J].J Clin Oncol, 2013, 31(33): 4199–206. DOI:10.1200/JCO.2012.48.3685 |
| [26] | Guo Z, Wang H, Meng F, et al. Combined trabectedin and anti-PD1 antibody produces a synergistic antitumor effect in a murine model of ovarian cancer[J].J Transl Med, 2015, 13: 247. DOI:10.1186/s12967-015-0613-y |
| [27] | Seyedin SN, Schoenhals JE, Lee DA, et al. Strategies for combining immunotherapy with radiation for anticancer therapy[J].Immunotherapy, 2015, 7(9): 967–80. DOI:10.2217/imt.15.65 |
| [28] | Sagiv-Barfi I, Kohrt HE, Czerwinski DK, et al. Therapeutic antitumor immunity by checkpoint blockade is enhanced by ibrutinib, an inhibitor of both BTK and ITK[J].Proc Natl Acad Sci U S A, 2015, 112(9): E966–72. DOI:10.1073/pnas.1500712112 |
| [29] | Hui R, Garon EB, Goldman JW, et al. Pembrolizumab as first-line therapy for patients with PD-L1-positive advanced non-small cell lung cancer: a phase 1 trial[J].Ann Oncol, 2017, 28(4): 874–81. DOI:10.1093/annonc/mdx008 |
| [30] | Mok T, Schmid P, Aren O, et al. 192TiP: NEPTUNE: A global, phase 3 study of durvalumab (MEDI4736) plus tremelimumab combination therapy versus standard of care (SoC) platinum-based chemotherapy in the first-line treatment of patients (pts) with advanced or metastatic NSCLC[J].J Thorac Oncol, 2016, 11(4 Suppl): S140–1. |
| [31] | Antonia SJ, Lopez-Martin JA, Bendell J, et al. Nivolumab alone and nivolumab plus ipilimumab in recurrent small-cell lung cancer (CheckMate 032): a multicentre, open-label, phase 1/2 trial[J].Lancet Oncol, 2016, 17(7): 883–95. DOI:10.1016/S1470-2045(16)30098-5 |
| [32] | Atezolizumab (Tecentriq) for bladder cancer and NSCLC[J].Med Lett Drugs Ther, 2017, 59(1515): e40-1. |
| [33] | Kaufman HL, Russell J, Hamid O, et al. Avelumab in patients with chemotherapy-refractory metastatic Merkel cell carcinoma: a multicentre, single-group, open-label, phase 2 trial[J].Lancet Oncol, 2016, 17(10): 1374–85. DOI:10.1016/S1470-2045(16)30364-3 |
| [34] | Rittmeyer A, Barlesi F, Waterkamp D, et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial[J].Lancet, 2017, 389(10066): 255–65. DOI:10.1016/S0140-6736(16)32517-X |
| [35] | Champiat S, Dercle L, Ammari S, et al. Hyperprogressive disease (HPD) is a new pattern of progression in cancer patients treated by anti-PD-1/PD-L1[J].Clin Cancer Res, 2017, 23(8): 1920–8. DOI:10.1158/1078-0432.CCR-16-1741 |
| [36] | Allard B, Pommey S, Smyth MJ, et al. Targeting CD73 enhances the antitumor activity of anti-PD-1 and anti-CTLA-4 mAbs[J].Clin Cancer Res, 2013, 19(20): 5626–35. DOI:10.1158/1078-0432.CCR-13-0545 |
| [37] | Rizvi NA, Hellmann MD, Brahmer JR, et al. Nivolumab in combination with platinum-based doublet chemotherapy for first-line treatment of advanced non-small-cell lung cancer[J].J Clin Oncol, 2016, 34(25): 2969–79. DOI:10.1200/JCO.2016.66.9861 |
 2017, Vol. 44
2017, Vol. 44


