2. 黑龙江仁合堂药业有限责任公司, 黑龙江 牡丹江 157011
2. Heilongjiang Renhetang Medicine Co., Ltd., Mudanjiang 157011, China
我国中医中药治疗疾病具有悠久的历史,临床疗效确切,副作用小、毒性低、安全可靠,备受大众认可。有研究显示,中药及复方制剂有直接对抗内毒素的作用,能提高机体防护能力及降低内毒素的活性[1-2]。其中,金银花、连翘提取物能导致内毒素结构破坏[3-4],对内毒素所致的发热小鼠、大鼠均有明显的解热作用[5-6]。金银花中的主要成分绿原酸对内毒素作用下的肠黏膜微血管内皮细胞功能有保护作用[7],连翘酯苷A对内毒素血症急性肺损伤也有保护作用[8]。锦花清热胶囊是由锦灯笼、金银花、连翘等六味中药组方的中药复方制剂,有清热泻火、凉血、解毒、疏散风热等功效,临床用于痰热、风热感冒等病症[9]。前期实验已证实该制剂毒性极低[10],含有绿原酸、连翘酯苷、木樨草苷、酸浆苦味素、阿魏酸、桔梗皂苷等多种药效成分,具有较强的清热、解毒及抗氧化作用。笔者根据其功效及主治,对其进行抗内毒素药效研究,为临床合理用药提供实验依据。
1 材料与方法 1.1 实验仪器与试剂T-6紫外分光光度计购自北京普析通用仪器有限责任公司;电子肛温计购自欧姆龙 (中国) 有限公司;兔固定箱购自北京合力科创科技发展有限公司;显色基质鲎试剂盒、内毒素和吸取试剂盒购自厦门市鲎试剂实验厂有限公司;脂多糖购自西格玛奥德里奇 (上海) 贸易有限公司;阿司匹林肠溶片购自大同市利群药业有限责任公司;锦花清热胶囊购自黑龙江省仁合堂药业有限责任公司 (批号20140801)。
1.2 新西兰兔解热实验 1.2.1 实验动物及造模方法新西兰兔,雄性,体质量为 (2.5±0.4) kg,由哈尔滨医科大学动物中心提供,于动物实验中心适应性饲养3 d后开始实验。选取基础体温为38.2~39.2 ℃的新西兰兔30只,单笼饲养,自由饮水,每天同一时段将新西兰兔固定于兔箱5 h以适应环境,连续3 d,实验前12 h禁食不禁水,实验当日测肛温三次,取均值作为基础体温。测量体温时,将新西兰兔固定于兔箱内,略微抬高兔臀部,将末端涂有少量凡士林的肛温计插入兔肛门约6 cm处测量肛温。通过在兔耳缘静脉注射脂多糖0.02 μg/kg (1 mL/kg) 的方法造模。
1.2.2 动物分组及给药方法锦花清热胶囊使用时倾出内容物,加蒸馏水制成质量浓度为0.153 g/mL的混悬液,4 ℃保存备用,使用时用蒸馏水适当稀释。将新西兰兔分为五组,即:模型对照组 (等渗氯化钠溶液),阳性对照组 (阿司匹林0.2 g/kg),锦花清热胶囊大、中、小剂量组 (分别含生药6.0、3.0、1.5 g/kg),每组6只。各组动物造模1 h后灌胃给药,给药容积为1 mL/kg,并于30、60、120、180、240、300 min时测量兔肛温,计算体温变化 (ΔT)。ΔT=给药后体温-基础体温,其中基础体温为动物造模前正常体温。
1.3 显色基质法检测锦花清热胶囊降解小鼠内毒素作用 1.3.1 实验动物及造模方法昆明小鼠,雌雄不拘,体质量为 (20.0±2.0) g,由哈尔滨医科大学动物中心提供,于动物实验中心适应性饲养3 d后开始实验。通过在小鼠尾静脉注射脂多糖0.35 mg/kg的方法造模。
1.3.2 动物分组及给药方法取昆明小鼠50只,分为五组,每组10只,即:模型对照组 (等渗氯化钠溶液),阳性对照组 (阿司匹林0.2 g/kg),锦花清热胶囊大、中、小剂量组 (分别含生药6.0、3.0、1.5 g/kg)。各组动物尾静脉注射脂多糖 (0.35 μg/kg) 后1 h灌胃给药。各组分两次取血,5只在给药后30 min取血,5只在给药后60 min取血。
1.3.3 标准曲线可靠性试验与样品测定(1) 内毒素标准溶液配制:取细菌内毒素工作品一支 (10 EU/支),按内毒素工作品使用说明书,加细菌内毒素检查用水稀释为10 EU/mL的内毒素溶液,然后进一步稀释为0.10、0.25、0.50和1.00 EU/mL的溶液。
(2) 血液处理:吸取试剂盒配套血液抗凝剂1 mL于无热原试管中,用无热原注射器抽取静脉血1 mL注入无热原试管中并与抗凝剂混匀,置于冰水中,加盖,迅速低温离心2 min (603×g),吸取上清液0.2 mL,加入0.8 mL配套样本处理液,混匀,封闭管口,70 ℃水浴加热10 min后,冰水浴冷却待用。
(3) 样品测定:取无热原试管,分别加入0.10 mL细菌内毒素检查用水 (阴性对照)、内毒素标准溶液 (供建立标准曲线用) 和待测样品,每组溶液平行管3支。再加入0.10 mL鲎试剂溶液,混匀,37 ℃温育10 min。温育结束加入0.10 mL显色基质溶液,混匀,37 ℃温育6 min。温育结束后,加入0.50 mL偶氮化试剂1溶液,混匀,加入0.50 mL偶氮化试剂2溶液,混匀,加入0.50 mL偶氮化试剂3溶液,静置5 min,于545 nm波长处读取吸光度值。
1.4 干扰试验检测样品阳性干扰率阳性对照组:加入高浓度组样品溶液0.05 mL、内毒素1.00 EU/mL (设为λm) 溶液0.05 mL;待测样品组:加入高浓度组样品溶液0.05 mL、细菌内毒素检查用水0.05 mL,每组溶液平行管3支,按1.3.3中的方法操作,测出阳性对照组溶液内毒素浓度值 (设为Cs),待测样品组溶液内毒素浓度值 (设为Ct)。计算该实验条件下回收率R,R=(Cs-Ct)/ λm×100%。当R为50%~200%时,认为在此试验条件下待测样品溶液不存在干扰作用。
1.5 统计学方法采用PASW 18.0软件进行统计学分析。各组数据经方差齐性检验呈正态分布,以均数±标准差 (x±s) 表示,组内不同时间点比较采用重复测量方差分析,组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 造模后各组动物的体征变化新西兰兔造模后各组动物体征变化明显,体温持续上升,90 min左右出现耸毛、呼吸加快、舌边尖红等表现,同时可见兔眼、耳朵发红,用手接触兔子的身体会有烫手的感觉,饮水次数增加,且个别家兔出现呼吸急促、鼻煽、躁动等症状,提示造模成功。
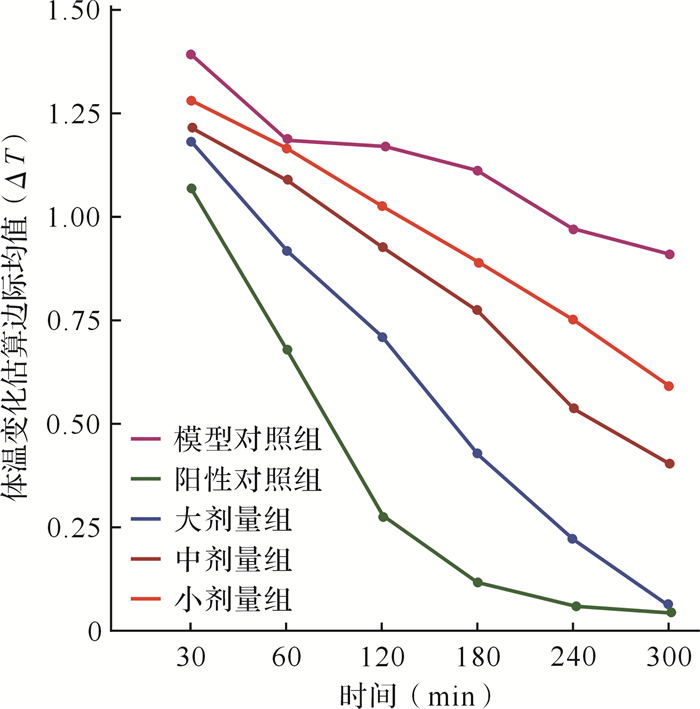
2.2 给药后各组动物的体温变化新西兰兔解热实验结果显示,阳性对照组的体温在给药后30 min与模型对照组比较差异有统计学意义 (P < 0.05),提示阿司匹林开始发挥解热作用,且随时间延长,解热效果更明显 (P < 0.01),在给药后240 min和300 min时动物恢复至基础体温。与模型对照组比较,锦花清热胶囊大、中剂量组给药后60 min时体温变化差异有统计学意义 (P < 0.05),且随时间延长,体温变化更趋向基础体温,到300 min时接近基础体温;锦花清热胶囊小剂量组在给药后120 min之前体温虽有所下降,但不显著,在给药后180 min时体温变化差异有统计学意义 (P < 0.05),见表 1。给药后不同时间间差异有统计学意义 (F=1372.362, P < 0.01), 时间与锦花清热胶囊剂量之间存在交互效应 (F=46.697, P < 0.01), 锦花清热胶囊剂量间差异有统计学意义 (F=121.115, P < 0.01)。从趋势图 (图 1) 上看,阳性对照组降温效果最明显,其次为锦花清热胶囊大、中、小剂量组,各组动物体温随时间变化的趋势大致相同,随时间的延长降温趋势愈加明显。
| (x±s,℃) | ||||||||
| 组别 | n | 基础体温 | ΔT | |||||
| 30 min | 60 min | 120 min | 180 min | 240 min | 300 min | |||
| 模型对照组 | 6 | 38.28±0.15 | 1.40±0.13 | 1.19±0.10 | 1.17±0.07 | 1.12±0.09 | 0.97±0.07 | 0.91±0.08 |
| 阳性对照组 | 6 | 38.38±0.12 | 1.07±0.14* | 0.68±0.09* | 0.28±0.04* | 0.12±0.02* | 0.06±0.01* | 0.05±0.01* |
| 大剂量组 | 6 | 38.47±0.26 | 1.19±0.11 | 0.92±0.09*# | 0.71±0.08*# | 0.43±0.05*# | 0.22±0.03*# | 0.06±0.01* |
| 中剂量组 | 6 | 38.33±0.27 | 1.22±0.10 | 1.09±0.11*# | 0.93±0.09*# | 0.78±0.06*# | 0.54±0.04*# | 0.41±0.02*# |
| 小剂量组 | 6 | 38.54±0.23 | 1.29±0.12 | 1.17±0.08# | 1.03±0.10# | 0.89±0.07*# | 0.75±0.05*# | 0.59±0.04*# |
| 与模型对照组比较,*P < 0.05;与阳性对照组比较,#P < 0.05. | ||||||||
|
| 图 1 治疗后各组新西兰兔体温变化趋势图 Fig. 1 Chart showing the body temperature declining tendency |
根据吸光度值 (y) 与内毒素标准品浓度 (x) 得到回归方程:y=0.7499x+0.0669,r=0.9932(>0.980),两变量的相关性较好,且样品组的吸光度值大于阴性对照组,故内毒素标准品浓度在0.1~1.0 EU/mL范围内试验结果有效。
2.4 给药后各组干扰试验结果显色基质法实验结果显示,按初始浓度λm=0.50 EU/mL计算,各组样品R分别为133%、116%、128%,均在50%~200%范围内,提示在此实验条件下各组样品溶液不存在干扰作用。
2.5 各组内毒素测定结果各组分别在给药后30、60 min测得吸光度值见表 2,通过回归方程计算内毒素浓度,设药物对内毒素的降解率为D,Co表示模型对照组的内毒素浓度,Ct表示锦花清热胶囊各剂量组的内毒素浓度,则D=(Co-Ct)/Co×100%。结果显示,各组降解率给药后30、60 min时组间差异均有统计学意义 (F=287.723、655.066,P < 0.05)。提示锦花清热胶囊在小鼠体内能减少内毒素的作用,且存在量效关系。
| (x±s) | ||||||||
| 组别 | n | 30 min | 60 min | |||||
| 吸光度值 | 内毒素浓度 (EU/mL) | 内毒素降解率 (%) | 吸光度值 | 内毒素浓度 (EU/mL) | 内毒素降解率 (%) | |||
| 模型对照组 | 5 | 0.718±0.010 | 0.869±0.013 | 0 | 0.661±0.013 | 0.793±0.017 | 0 | |
| 阳性对照组 | 5 | 0.294±0.006 | 0.302±0.008 | 65.16±1.46 | 0.190±0.013 | 0.164±0.017 | 79.34±1.86 | |
| 大剂量组 | 5 | 0.349±0.020 | 0.376±0.026 | 56.73±3.12 | 0.169±0.007 | 0.137±0.009 | 82.76±1.00 | |
| 中剂量组 | 5 | 0.411±0.015 | 0.458±0.020 | 47.23±1.77 | 0.276±0.012 | 0.279±0.016 | 64.75±1.77 | |
| 小剂量组 | 5 | 0.581±0.012 | 0.685±0.016 | 21.08±2.30 | 0.434±0.015 | 0.490±0.019 | 38.21±1.57 | |
咽干、咽痛、音哑、痰热、咳嗽是常见病和多发病,久症不愈会转为慢性病或高危病症,危及患者的健康和生命。化学药物治疗虽疗效显著,但常伴有较强的不良反应,而中药虽显效慢,但疗效确切,副作用小。我国传统中医理论认为,外邪、热毒是致病的重要原因。锦花清热胶囊根据中医治法治则,具有清热解毒、疏散风热、生津利咽、消肿散结作用,并且毒副作用小,可以提高患者用药的安全性。我们对锦花清热胶囊的解热和抗内毒素作用进行了实验研究。
本研究采用脂多糖来制作动物发热模型。脂多糖是脂质与多糖的复合物,为细菌内毒素的主要成分,注入动物体内后作用于巨噬细胞等,释放的细胞因子作用于下丘脑的体温调节中枢核苷酸系统,使体内前列腺素E合成增加,从而导致发热,是公认的致热源之一。由于各种动物机体对内毒素的反应差异很大,引起动物发热的剂量也差异极大,因此本文对新西兰兔与昆明小鼠选用不同的内毒素剂量。
锦花清热胶囊对脂多糖所致新西兰兔发热实验结果显示,锦花清热胶囊小、中、大剂量组具有不同程度的解热作用,小剂量组效果偏弱,中、大剂量组效果增强,且大剂量组在给药后300 min时作用效果已经较为理想,降温效果接近阳性对照组,说明锦花清热胶囊具有明显的解热作用,并且量效关系明确。锦花清热胶囊解热作用的机制可能是通过所含的金银花成分下调IL-1β诱导前列腺素E受体3表达[11],从而影响下丘脑对体温中枢的作用而实现的;连翘可下调下丘脑中环腺苷酸 (cAMP) 含量[12],亦可降低动物体温。
在小鼠显色基质法实验中,给药后30 min时,阳性对照组的内毒素降解率最高,其次是锦花清热胶囊大、中、小剂量组;给药后60 min时,锦花清热胶囊大剂量组的内毒素降解率最高,其次是阳性对照组,锦花清热胶囊中、小剂量组。由此可见,锦花清热胶囊对小鼠体内内毒素的降解有明显作用。
随着大众对中医药治疗的认同,中医药的市场需求会越来越大,开发高效、低毒的中药既能满足市场需求,为大众提供安全药品、推动中药现代化,又能服务社会大众,带来良好的社会效益。锦花清热胶囊具有抗内毒素作用,能有效降低发热新西兰兔体温,以及降低小鼠体内内毒素活性,疗效确切显著,可用于治疗由外邪、热毒引起的咽干、咽痛、音哑以及由于痰热、外邪内毒感冒所致的咳嗽等疾病,是一种良好的中药复方制剂。
志谢 本研究实验工作得到梁启超老师和田雷瑜、谭登航、郭舒臣、郭超、李铁军同学大力帮助,特此感谢!| [1] | 黄松科, 陈德兴. 中药及复方治疗内毒素血症作用机制研究进展[J]. 吉林中医药, 2012, 32(6): 646–648. HUANG Songke, CHEN Dexing. Research progress on the mechanism of herbs and compound for the treatment of endotoxemia[J]. Jilin Journal of Traditional Chinese Medicine, 2012, 32(6): 646–648. (in Chinese) |
| [2] | 张宗良. 中医药抗内毒素损伤功效研究[J]. 亚太传统医药, 2013, 9(7): 82–83. ZHANG Zongliang. Study on the protective effects of herbs on endotoxin injury[J]. Asia-Pacific Traditional Medicine, 2013, 9(7): 82–83. (in Chinese) |
| [3] | 宋小俊. 五大商药之连翘[J]. 北方药学, 2013, 10(7): 2–4. SONG Xiaojun. The top five commodity herbs of forsythia[J]. Journal of North Pharmacy, 2013, 10(7): 2–4. (in Chinese) |
| [4] | 张海娟, 朱德全, 周松, 等. 内毒素定量检测及中药在脓毒症防治中的应用进展[J]. 临沂大学学报, 2012, 34(6): 50–53. ZHANG Haijuan, ZHU Dequan, ZHOU Song, et al. The progress on the quantitative analysis of endotoxin and the use of Chinese traditional medicine in prevention and treatment of sepsis[J]. Journal of Linyi University, 2012, 34(6): 50–53. (in Chinese) |
| [5] | 刘丹丹, 王培智, 苗明三. 金银花药效特点分析[J]. 中医学报, 2013, 28(10): 1514–1516. LIU Dandan, WANG Peizhi, MIAO Mingsan. Analysis on efficacy characteristics of honeysuckle[J]. China Journal of Chinese Medicine, 2013, 28(10): 1514–1516. (in Chinese) |
| [6] | 徐晖. 金银花药理作用研究进展[J]. 湖南中医杂志, 2013, 29(9): 148–150. XU Hui. The progress on pharmacological action of honeysuckle[J]. Hunan Journal of Traditional Chinese Medicine, 2013, 29(9): 148–150. (in Chinese) |
| [7] | 赵金娟, 戴雪梅, 曲永胜, 等. 绿原酸药效学研究进展[J]. 中国野生植物资源, 2013, 32(64): 1–5. ZHAO Jinjuan, DAI Xuemei, QU Yongsheng, et al. Progress in the pharmacodynamics of Chlorogenic acid[J]. Chinese Wild Plant Resources, 2013, 32(64): 1–5. (in Chinese) |
| [8] | 周林. 连翘酯苷A抗内毒素作用及作用机制的实验研究[D]. 南昌: 南昌大学, 2013. ZHOU Lin. Experimental study on the effect of anti-endotoxin of forsythoside a and its mechanism[D]. Nanchang:Nanchang University, 2013. (in Chinese) |
| [9] | 国家药典委员会. 中华人民共和国药典2010年版一部[S]. 北京: 中国医药科技出版社, 2010: 337-338. Chinese Pharmacopoeia Commission. Pharmacopoeia of China (2010) Volume 1[S]. Beijing:China Medical Science Press, 2010:337-338.(in Chinese) |
| [10] | 侯甲福, 郑著家, 刘世娟, 等. 锦花清热胶囊对动物急性及长期毒性研究[J]. 毒理学杂志, 2016, 30(2): 112–113. HOU Jiafu, ZHENG Zhujia, LIU Shijuan, et al. Study on acute and chronic toxicities of Jinhuaqingre capsules in experimental animals[J]. Journal of Toxicology, 2016, 30(2): 112–113. (in Chinese) |
| [11] | 谢新华, 蒋绍祖, 邹晓琴, 等. 金银花对发热新西兰兔解热作用机制的研究[J]. 时珍国医国药, 2009, 20(3): 691–692. XIE Xinhua, JIANG Shaozu, ZOU Xiaoqin, et al. Study on antipyretic effect and mechanism of Honeysuckle in pyretic rabbits[J]. Lishizhen Medicine and Materia Medica Research, 2009, 20(3): 691–692. (in Chinese) |
| [12] | 邹珊珊, 玄振玉. 连翘酯苷不同给药途径对副流感病毒致家兔发热模型的影响[J]. 中药药理与临床, 2015, 31(1): 57–59. ZOU Shanshan, XUAN Zhenyu. Studies of different administration routes of forsythiaside on rabbit fever models induced by parainfluenza virus[J]. Pharmacology and Clinics of Chinese Materia Medica, 2015, 31(1): 57–59. (in Chinese) |




