病毒入侵机体后, 即被模式识别受体(pattern-recognition receptors, PRR)识别, 快速诱导固有免疫应答, 产生大量的Ⅰ型干扰素, 发挥强有力的抗病毒效应[1-2]。作为干扰素调节因子(interferon regulator factors, IRF)活化所必需的磷酸激酶, TNF受体相关因子(TNF receptor-associated factor, TRAF)家族成员相关的NF-κB活化因子(TANK)结合激酶1(TANK-binding kinase 1, TBK1)在Ⅰ型干扰素的产生过程中发挥了重要的作用。病毒核酸或其中间代谢产物与PRR一旦结合即可募集相应的接头蛋白, 如线粒体抗病毒信号蛋白(mitochondrial antiviral signaling protein, MAVS)、干扰素基因刺激分子(stimulator of interferon genes, STING)、β干扰素TIR结构域衔接蛋白(TIR-domain-containing adapter-inducing interferon-β, TRIF)等, 形成三条主要的信号通路:RIG-I-MAVS、cGAS-STING和TLR3/4-TRIF。接头蛋白MAVS、STING和TRIF均能活化下游的蛋白激酶TBK1, 进一步促进干扰素调节因子3(interferon regulatory factor 3, IRF3)磷酸化以及Ⅰ型干扰素合成[3]。TBK1属于IκB激酶(IκB kinases, IKK)家族成员, 与IKKε结构非常相似, 功能上具有重叠和互补, 因此在下文一起论述。TBK1和IKKε包含四个结构域:N端激酶结构域(kinase domain, KD)、泛素样结构域(ubiquitin-like domain, ULD)、α螺旋形脚手架二聚化结构域(scaffold dimerization domain, SDD)和C末端结构域(C-terminal domain, CTD)[4]。此外, CTD含有两个Coiled-coil (CC)结构域, 其中CC2区负责结合接头蛋白TANK、NF-κB活化激酶相关蛋白1(activating kinase-associated protein 1, NAP1)及与NAP1类似的TBK1接头蛋白(similar to NAP1 TBK1 adaptor, SINTBAD) [5]。TBK1的表达非常广泛, 在大多数组织器官和细胞类型中均有表达, 与IKKα、IKKβ相似。而IKKε的表达则局限于一些特定器官(胰腺、胸腺、脾脏)和特定细胞(T细胞、外周血淋巴细胞)[6]。本文将对TBK1在抗病毒固有免疫应答中的作用及调控机制进行综述。
1 TBK1的功能和相关病理模型TBK1和IKKε的功能比较广泛, 除了介导抗病毒固有免疫应答外, 还与适应性免疫应答以及一些临床疾病, 如肿瘤、炎症性疾病和代谢性疾病密切相关。较典型的病毒感染模型是水疱性口炎病毒(vesicular stomatitis virus, VSV)。该病毒是一种双链RNA病毒, 可以感染人或牛、马、猪等动物, 症状与口蹄疫、猪水疱病类似。在感染宿主的过程中, VSV主要通过结合Toll样受体3(Toll-like receptor 3, TLR3)和维甲酸诱导基因I (retinoic acid inducible gene-I, RIG-I)受体来活化TBK1, 进而促进IRF3活化和Ⅰ型干扰素及炎性细胞因子的产生, 发挥抗病毒作用。
TBK1还对适应性免疫应答具有负调控效应。在T细胞内特异性敲除TBK1激酶可促进初始T细胞过度活化, 从而导致实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)。其具体机制是TBK1促进蛋白激酶B (protein kinase B, PKB, 也称为AKT)的泛素化以及降解, 通过负调控AKT-哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin complex 1, mTORC1)信号通路来影响T细胞活化和迁移过程。同时有研究报道TBK1亦可负调控体液免疫应答。TBK1主要通过促进NF-κB诱导激酶(NF-κB-inducing kinase, NIK)的磷酸化和降解, 进而削弱非经典NF-κB信号通路的活化, 最终抑制B细胞内IgA的免疫球蛋白类别转化过程。因此, 在B细胞内特异性敲除TBK1能导致IgA无限制地合成, 从而诱发肾病综合征。
最新研究表明, TBK1在细胞生长、增殖和转化过程中亦发挥重要作用, 被认为具有致癌性。KRAS是一种原癌基因, 其突变引起的癌症至今尚无有效的治疗方法。与野生型KRAS细胞相比, TBK1在突变型KRAS细胞中的表达是不可或缺的。在突变型KRAS细胞中, TBK1可以活化NF-κB相关的抗凋亡信号, 包括对细胞存活至关重要的转录因子c-Rel和抗凋亡蛋白BCL-XL。干扰TBK1表达则可诱导依赖原癌基因KRAS的人癌细胞系的凋亡, 但是对于KRAS非突变肿瘤细胞的致瘤性没有影响[7]。IKKε亦在一些人体肿瘤组织中过度表达, 如乳腺癌、卵巢癌和胰腺癌, 主要通过激活NF-κB来促进细胞转化[4]。另外, IKKε/TBK1对AKT活性具有重要的调节作用, TBK1通过磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase, PI3K)依赖的方式既促进AKT活化环T308位磷酸化, 又促进其疏水基序S473位磷酸化, 这种双磷酸化作用使大量AKT活化[8], 而AKT的活化对肿瘤的发生和侵袭活性至关重要。
此外, TBK1和IKKε参与一些炎症性疾病和代谢紊乱相关疾病的发病过程, 是临床疾病治疗的新靶点[9]。炎症是很多慢性疾病的主要诱因, 包括阿尔茨海默病、类风湿性关节炎、哮喘、动脉粥样硬化、克罗恩病、结肠炎和帕金森病等。研究发现, TBK1在这些炎症性疾病模型中均呈高表达; 而且在肝炎和肠炎模型中, TBK1的活化形式比对照小鼠明显升高[10]。TBK1在类风湿性滑膜炎的发病进程中也发挥重要作用:TLR3活化可激活TBK1和IKKε激酶, 进而促使IRF磷酸化并入核, 诱导β干扰素和γ干扰素诱导蛋白-10(干扰素-γ-inducible protein 10, IP-10)的产生[11], 而且TBK1-IRF7-IP-10可形成正反馈环路。这一过程产生的IP-10是类风湿性滑膜炎主要的炎性介质, 与类风湿性滑膜炎的病理过程密切相关。
2 TBK1在抗病毒免疫应答中的作用 2.1 TBK1激活关键转录因子, 促进Ⅰ型干扰素生成在抗病毒固有免疫应答中, TBK1和IKKε能同时激活转录因子IRF3、IRF7和NF-κB, 进而促进Ⅰ型干扰素和一些细胞因子的合成。然而, 在TBK1和IKKε基因同时敲除的小鼠胚胎成纤维细胞(mouse embryonic fibroblast, MEF)中, 促炎细胞因子(TNF-α或IL-1)诱导的NF-κB活化没有改变, 而且NF-κB的靶基因转录水平仅轻度降低, 这些结果表明TBK1和IKKε虽然足以激活NF-κB, 但并非NF-κB活化的必需激酶[12]。
Ⅰ型干扰素合成过程中, TBK1和IKKε可直接磷酸化IRF3和IRF7 C末端的多个Ser/Thr位点, 诱导IRF3和IRF7形成同二聚体或异二聚体, 继而发生核转位启动Ⅰ型干扰素合成[13]。研究发现, 单独IKKε缺陷对TLR3/4触发的IRF3活化没有影响, 而TBK1缺陷可导致IRF3活化明显下降[14]。如果同时敲除MEF中的TBK1和IKKε, 则可完全取消IRF3的活化[14]。此外, 在TBK1缺陷的MEF中, 过表达IKKε能还原IRF3活化水平[9]。这些结果表明, 这两种激酶是合成Ⅰ型干扰素的关键信号分子, 而且功能互补。目前认为, IKKε主要活化IRF7, 其在病毒感染初期并不发挥作用。一旦干扰素β产生的量足以诱导IKKε的产生, IKKε即能与TBK1发挥协同抗病毒作用, 所以IKKε主要介导后期信号的放大作用[15]。
实际上, IKKε在干扰素刺激基因(interferon-stimulated gene, ISG)的转录活化过程中发挥更为关键的作用。体内敲除IKKε基因可显著抑制ISGs的活化, 但对干扰素的合成无明显影响[16]。在干扰素与细胞表面相应干扰素受体结合后, IKKε能促使信号转导及转录激活因子1(signal transducer and activator of transcription 1, STAT1)的丝氨酸位点发生磷酸化, 进而调控干扰素诱导的转录因子复合物装配, 促进抗病毒蛋白合成[4]。
以上证据显示, TBK1的功能是激活关键转录因子IRF3, 进而诱导Ⅰ型干扰素的合成; IKKε则在Ⅰ型干扰素合成的后期发挥放大作用。此外, IKKε还可以刺激Ⅰ型干扰素的下游信号分子并促进抗病毒蛋白合成。
2.2 TBK1是三条主要抗病毒途径的汇集点病毒核酸或其中间代谢产物与PRR一旦结合即可募集相应的接头蛋白, 形成三条主要的信号通路:RIG-I-MAVS、cGAS-STING和TLR3/4-TRIF。接头蛋白MAVS、STING和TRIF均能活化下游的蛋白激酶TBK1, 进一步促进IRF3磷酸化以及Ⅰ型干扰素合成[3]。因此, TBK1是不同抗病毒信号通路的汇集点, 处于信号网络的中心位置, 被认为是抗病毒信号的限速步骤(图 1)。
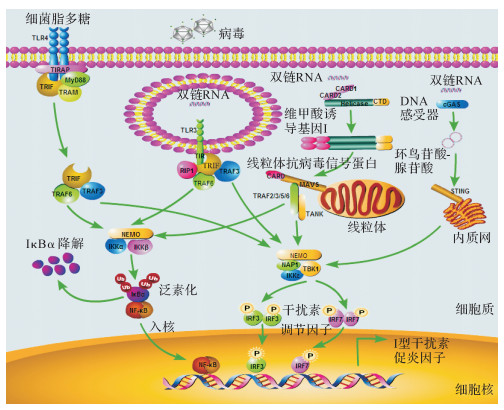
|
| 图 1 病毒诱导的信号转导通路以及TBK1在Ⅰ型干扰素和促炎因子的产生过程中发挥关键作用示意图 Fig. 1 Schematic model of the signal transduction pathway induced by virus and the pivotal role of TBK1 in the expression of type-I interferon and proinflammatory cytokines |
TLR3位于内体膜上, 主要识别dsRNA; TLR4位于细胞膜, 识别细菌脂多糖。由于TLR3/4接受外界刺激后能募集共同的接头蛋白TRIF, 因此我们将两者放在一起叙述。TRIF的N端为TRAF3/6的结合区域, TRAF3通过促进自身和周围蛋白的K63位泛素化来激活TBK1;TRAF6则通过促进自身以及NF-κB必须调节蛋白(NF-κB essential modulator, NEMO)的泛素化来激活NF-κB通路[17]。然而, TLR3在抗病毒早期不发挥作用, 且主要表达于免疫细胞, 极大地限制了TLR抵抗外来感染的普遍性[12]。
2.2.2 病毒RNA通过RIG-I-MAVS信号激活TBK1RIG-I样受体(RIG-I like receptor, RLR)几乎在所有细胞中都有表达, 主要识别细胞质中的dsRNA。RLR包括RIG-I、黑色素瘤分化相关基因5(melanoma differentiation-associated protein 5, MDA5)和LGP2(laboratory of genetics and physiology 2)三个成员, 其中LGP2因不具有半胱天冬酶募集结构域(caspase-recruitment domain, CARD), 在Ⅰ型干扰素的合成中起着负调控作用[1]。RIG-I和MDA5识别病毒刺激信号后, 即发生ATP依赖的构象改变, 形成二聚体并暴露CARD结构, 通过CARD-CARD相互作用与下游共同的接头蛋白MAVS结合[16]。而位于线粒体外膜的MAVS形成朊病毒样的多聚体, 即为活化形式[3]。与TRIF相似, MAVS含有TRAF2/3/5/6的结合区域, 一方面可招募TRAF3来促进TBK1活化, 另一方面招募TRAF2/5/6进而激活IKKα/β和NF-κB[16]。
2.2.3 病毒DNA通过cGAS-STING信号激活TBK1环鸟苷酸-腺苷酸合成酶(cyclic GMP-AMP synthase, cGAS)、干扰素诱导蛋白黑色素瘤缺乏因子2(absent in melanoma 2, AIM2)、干扰素γ诱导蛋白16(gamma-interferon-inducible protein, IFI16)以及DNA依赖的干扰素调节因子激活物(DNA-dependent activator of interferon-regulatory factors, DAI)都可以作为DNA感受器, 通过接头蛋白STING活化TBK1和IRF3[18]。cGAS是一种cGMP合成酶, 与细胞质dsDNA结合后发生活性位点的构象改变, 进而以ATP和鸟苷三磷酸(GTP)为底物, 催化cGAMP的合成, cGAMP则能结合内质网蛋白STING并使其活化[19]。与MAVS及TRIF不同, STING不依赖于TRAF, 可以直接招募并激活TBK1[3]。
2.3 TBK1通过活化IRF3促进Ⅰ型干扰素的产生在TBK1活化下游转录因子IRF3的过程中, 接头蛋白MAVS、STING以及TRIF发挥重要的脚手架作用:它们直接结合IRF3蛋白, 使活化的TBK1和IRF3相互接近, 为IRF3磷酸化提供结构基础。MAVS的多聚化和磷酸化是结合IRF3的先决条件, 因此需要以下两个结构域:MAVS的CARD区(94~153 aa)负责介导多聚体形成; 而C末端结构域(510~540 aa)的4T/S位点(S442/S444/T445/S446)和3S位点(S426/S430/S433)为重要的磷酸化位点[3]。TBK1和IKKε均能活化这些4T/S和3S位点, 其中4T/S中的S442位点磷酸化是IRF3结合以及活化的关键。IRF3则通过其C末端(190~427aa)结合磷酸化的MAVS, 该区域形成带正电荷的接触面。此外, STING的Ser366和TRIF的S210/S212/T214均能为TBK1/IKKε磷酸化, 进而结合IRF3[3]。
TBK1/IKKε磷酸化IRF3的5个重要Ser/Thr位点(Ser396、Ser398、Ser402、Thr404、Ser405), 其中Ser396的磷酸化最为关键, 点突变实验证实仅Ser396的磷酸化即可诱导β干扰素表达[10]。磷酸化的IRF3脱离接头蛋白, 通过其带正电荷的C末端区形成同二聚体, 转入细胞核与干扰素刺激应答元件(interferon stimulation-response elements, ISRE)以及干扰素β启动子正向调控元件(positive regulatory domain Ⅲ-Ⅰ, PRDⅠ-Ⅲ)结合, 从而诱导Ⅰ型干扰素的表达[20]。
在抗病毒固有免疫应答中, TBK1与其上游的接头蛋白、TRAF、IRF3/7等组成功能性复合物, 彼此之间相互活化, 构成复杂的信号网络。总体来讲, 接头蛋白介导的IRF3活化大致分为以下步骤:①接头蛋白的活化:RIG-I、cGAS和TLR3/4分别与相应的配体结合, 进而活化下游的接头蛋白MAVS、STING和TRIF (如MAVS的多聚化)。②TBK1的活化:活化的MAVS聚合体或TRIF蛋白进一步招募TRAF家族E3泛素连接酶(TRAF2/3/5/6), 它们通过合成多聚泛素链来激活TBK1/IKKε, 而活化的STING则是直接招募并激活TBK1。③接头蛋白的磷酸化:活化的TBK1/IKKε反过来使接头蛋白MAVS、STING和TRIF共有结构域pLxIS发生磷酸化。④IRF3的募集:IRF3通过其带正电荷的表面与磷酸化的MAVS、STING或TRIF结合。⑤IRF3的磷酸化:一旦TBK1与IRF3在结构上相互接近, TBK1即可高效地诱导IRF3磷酸化。磷酸化的IRF3与接头蛋白脱离, 形成同二聚体, 然后转入细胞核发挥促转录功能[3]。
3 TBK1的活化及其调控机制TBK1/IKKε作为一种磷酸激酶, 其激酶结构域活化环(T-loop)上的Ser172最为重要, 仅该位点发生磷酸化TBK1就具有激酶活性[4]。Lys30和Lys401的Lys63-链接(K63-)多聚泛素化修饰对TBK1的活性也极为关键[21]。此外, 最新发现小泛素相关修饰物(small ubiquitin-related modifier, SUMO)在TBK1活性调节中亦发挥重要作用。
3.1 TBK1的活化 3.1.1 TBK1二聚化和磷酸化无论是活化还是非活化状态的TBK1蛋白均以二聚体形式存在。两个TBK1单体的KD、ULD和SDD三个结构域相互作用, 形成致密而稳定的二聚体, 而CTD并非TBK1形成二聚体的必要结构[21]。令人惊奇的是, TBK1二聚体采取背对背的结合模式, 使两个激酶结构域位于二聚体的对立面, 不能相互激活, 从而保证了在静息状态时不会发生顺式自身磷酸化[4]。
TBK1是通过反式自身磷酸化的方式自我活化的, 经历了两个反应阶段:起始的滞缓反应相和后期的快速磷酸化时相。Zhao等[20]发现了TBK1激酶活化环交换的构象:一个TBK1原聚体的Ser172在空间上非常接近相邻原聚体的催化部位Asp135, 形成短暂的具有自身磷酸化潜能的中间体。生物化学分析也证实单独的TBK1激酶结构域足以诱导TBK1活化, 支持其自身磷酸化[13]。目前比较认可的活化模型是, 细胞接受刺激后, TBK1被招募到信号复合体, 局部浓度大大提高, 在TANK、NAP1以及SINTBAD等接头蛋白的帮助下, TBK1二聚体形成更高级有序的寡聚体。其中相邻的TBK1二聚体各有一个KD能够彼此靠近, 使活化环上的Ser172被磷酸化。动力学分析表明, 相邻二聚体形成活化中间体是一个动态的过程, 因此起始磷酸化过程非常缓慢。不过一旦Ser172发生磷酸化, 该活化环即发生变构, 快速催化其余的TBK1发生磷酸化, 形成大量活化的激酶二聚体[4, 20]。
TBK1自身的接头蛋白TANK、NAP1、SINTBAD和optineurin等在TBK1的活化过程中发挥重要作用, 主要介导TBK1发生高级有序的寡聚化。这些接头蛋白的结构及功能与NF-κB通路的脚手架蛋白NEMO非常相似[17]。晶体结构分析发现, TANK、NAP1和SINTBAD等也以二聚体的形式存在, 形成平行细长的CC结构, 通过它们的共同基序TBD (TBK1/IKKε binding domain), 直接结合于TBK1 C末端的CC2区上, 起着稳定TBK1二聚体的作用[20]。更为重要的是, 这些接头蛋白的UBAN结构域能进一步结合K63或linear多聚泛素链, 通过自身的聚合促使TBK1二聚体发生高级有序的寡聚化, 为反式自身磷酸化提供结构基础[4]。这些接头蛋白彼此间能竞争结合TBK1/IKKε, 认为它们分别与TBK1/IKKε形成不同的复合物, 有着不同的细胞定位, 执行不同的功能[13]。但在Ⅰ型干扰素合成的信号通路中, 这些接头蛋白均有不同程度的参与[5]。
3.1.2 TBK1的泛素化TBK1自身的泛素化对其活化也非常关键。目前认为完整的TBK1二聚体需事先发生Lys30 (KD)和Lys401(SDD)的K63偶联的多聚泛素链修饰, 才能触发反式自身磷酸化。研究发现, 单个位点突变(K30R或K401R)并不影响干扰素β的合成, 但两个位点同时突变的TBK1则完全不能诱导IFNB1和RANTES基因转录, 证实K63泛素化是Ⅰ型干扰素合成过程中必不可少的步骤[21]。进一步明确TBK1二聚化、K63泛素化和磷酸化之间的关系:阻断二聚体的突变(E355A/R357D、R547D以及D33A)可同时抑制K63泛素化和磷酸化; 激酶失活突变的TBK1蛋白能发生同等程度的泛素化修饰; 反之, 两个泛素化位点同时突变K30R/K401R, TBK1却不能发生磷酸化[4, 22]。由此可知, TBK1激酶活化是个多步骤的过程:先是同源二聚化, 然后Lys30和Lys401两个位点中至少一个发生K63泛素化, 最后才是Ser172位的磷酸化。然而, 这三者层层促进的具体机制目前尚不明确。
3.1.3 TBK1的SUMO化最新研究发现SUMO化修饰对TBK1功能的调节也很重要。Saul等[22]通过质谱分析法明确TBK1的K694位是SUMO分子的结合位点, 而该位点刚好位于负责与NAP1等接头蛋白结合的C末端CC2。只有活化形式的TBK1中才能观察到SUMO化修饰, K694位点突变则可以抑制病毒或LPS诱导的干扰素β合成, 表明SUMO化修饰主要促进TBK1与NAP1的结合, 协助TBK1的寡聚化, 进而促进TBK1的抗病毒效应[22]。
3.2 TBK1活化的调控机制TBK1作为抗病毒固有免疫应答的核心激酶, 过度活化会导致炎症或组织损伤, 因此其活性被严格地调控。体内存在着多种TBK1活性的调节方式, 如磷酸化、泛素化以及干扰TBK1功能性复合物的形成等[9]。
TBK1 Ser172位磷酸化是其获得激酶活性的关键步骤。TBK1二聚体募集至信号复合体, 局部高浓度使其发生寡聚化, 从而触发反式自身磷酸化。此外, 糖原合成酶激酶3β(glycogen synthase kinase 3 beta, GSK3β)可以与TBK1结合, 协助TBK1 Ser172位点发生自身磷酸化[23]。另一方面, 一些磷酸酶通过去磷酸化效应来负向调控TBK1活性。如Src同源区域-2-肌醇磷酸酶1(Src homology 2 domain containing inositol phosphatase-1, SHIP-1)能以TBK1为靶点, 抑制TLR3诱导的β干扰素生成[20]。人镁离子/锰离子依赖性蛋白磷酸酶B (protein phosphatase Mg2+/Mn2+dependent 1B, PPM1B)在病毒感染后与TBK1结合, 使TBK1 Ser172位去磷酸化, 从而终止TBK1介导的IRF3活化[20]。此外糖皮质激素也能抑制TBK1 Ser172位的磷酸化[24]。
泛素化和去泛素化也是调控TBK1活性的重要修饰方式。E3泛素连接酶Nrdp1[25]和MIB (mind bomb) [26]都可以协助TBK1发生K63位多聚泛素化修饰, 促进其活化。反之, 多种去泛素化酶亦能去除TBK1蛋白的K63位泛素化修饰, 发挥负向调控作用。例如去泛素化酶圆柱瘤蛋白(deubiquitinating enzyme cylindromatosis, CYLD)、泛素蛋白特异性蛋白酶2b (ubiquitin-specific protease 2b, USP2b)、A20调节复合物、环指蛋白11(RING finger protein 11, RNF11)协同TAX1结合蛋白1(Tax1-binding protein 1)均能导致TBK1去泛素化, 进而抑制其抗病毒活性[25-27]。TBK1的K63位泛素化通常发生在病毒感染早期, 而在感染晚期TBK1则会发生K48位泛素化, 导致TBK1通过蛋白酶体途径进行降解。核苷酸结合寡聚化结构域样受体(nucleotide-binding oligomerization domain-like receptor, NLR)炎性复合体家族的成员之一NLRP4和TRAF相互作用蛋白(TNF receptor-associated factor-interacting protein, TRIP)均能促进TBK1的降解[28]。
功能性TBK1复合物的形成也是TBK1活化的关键, 主要包括TBK1、IKKε、TRAF3、IRF3和接头蛋白TRIF、MAVS、STING等。MIP-T3蛋白能特异性结合TRAF3, 阻碍TRAF3-TBK1功能性复合物形成[29]。SIKE (supressor of IKKε)是TBK1/IKKε生理条件下的抑制物, 能干扰TBK1/IKKε与TRIF、IRF3、RIG-I等蛋白之间的相互作用[30]。NLR炎性复合体家族的另一个成员NLRC3则能阻断STING-TBK1的相互作用[31]。此外, 一些特殊的病毒成分亦能干扰功能性复合物的形成, 包括埃博拉病毒VP35、冠状病毒M蛋白等[32]。
4 结语TBK1是抗病毒固有免疫应答中促进Ⅰ型干扰素合成的关键激酶。明确TBK1激活的信号转导通路和调控机制, 可以为病毒感染、肿瘤以及一些代谢性疾病的临床预防和治疗提供新的靶点。然而, 目前对TBK1的了解并不全面, 还存在许多尚未解决的问题:如在特定的生理或病理状态下, TBK1不是活化所有的底物, 那TBK1是如何有选择性地活化特定底物的?在TBK1发生寡聚化过程中, TANK等接头蛋白是被直接泛素化修饰还是结合多聚泛素化链而进一步聚合的?这些问题均有待进一步研究。
| [1] | AKIRA S, UEMATSU S, TAKEUCHI O, et al. Pathogen recognition and innate immunity[J]. Cell, 2006, 124 (4) :783–801. doi:10.1016/j.cell.2006.02.015 |
| [2] | PICHLMAIR A, REIS E, SOUSA C. Innate recognition of viruses[J]. Immunity, 2007, 27 (3) :370–383. doi:10.1016/j.immuni.2007.08.012 |
| [3] | LIU S, CAI X, WU J, et al. Phosphorylation of innate immune adaptor proteins MAVS, STING, and TRIF induces IRF3 activation[J]. Science, 2015, 347 (6227) :aaa2630. doi:10.1126/science.aaa2630 |
| [4] | LARABI A, DEVOS J M, NG S L, et al. Crystal structure and mechanism of activation of TANK-binding kinase 1[J]. Cell Rep, 2013, 3 (3) :734–746. doi:10.1016/j.celrep.2013.01.034 |
| [5] | RYZHAKOV G, RANDOW F. SINTBAD, a novel component of innate antiviral immunity, shares a TBK1-binding domain with NAP1 and TANK[J]. EMBO J, 2007, 26 (13) :3180–3190. doi:10.1038/sj.emboj.7601743 |
| [6] | VERHELST K, VERSTREPEN L, CARPENTIER I, et al. IkappaB kinase epsilon (IKKepsilon):a therapeutic target in inflammation and cancer[J]. Biochem Pharmacol, 2013, 85 (7) :873–880. doi:10.1016/j.bcp.2013.01.007 |
| [7] | BARBIE D A, TAMAYO P, BOEHM J S, et al. Systematic RNA interference reveals that oncogenic KRAS-driven cancers require TBK1[J]. Nature, 2009, 462 (7269) :108–112. doi:10.1038/nature08460 |
| [8] | XIE X, ZHANG D, ZHAO B, et al. IkappaB kinase epsilon and TANK-binding kinase 1 activate AKT by direct phosphorylation[J]. Proc Natl Acad Sci U S A, 2011, 108 (16) :6474–6479. doi:10.1073/pnas.1016132108 |
| [9] | ZHAO W. Negative regulation of TBK1-mediated antiviral immunity[J]. FEBS Lett, 2013, 587 (6) :542–548. doi:10.1016/j.febslet.2013.01.052 |
| [10] | YU T, YI Y S, YANG Y, et al. The pivotal role of TBK1 in inflammatory responses mediated by macrophages[J]. Mediators Inflamm, 2012, 2012 :979105. |
| [11] | HAMMAKER D, BOYLE D L, FIRESTEIN G S. Synoviocyte innate immune responses:TANK-binding kinase-1 as a potential therapeutic target in rheumatoid arthritis[J]. Rheumatology (Oxford), 2012, 51 (4) :610–618. doi:10.1093/rheumatology/ker154 |
| [12] | NAN Y, NAN G, ZHANG Y J. Interferon induction by RNA viruses and antagonism by viral pathogens[J]. Viruses, 2014, 6 (12) :4999–5027. doi:10.3390/v6124999 |
| [13] | GONCALVES A, BURCKSTUMMER T, DIXIT E, et al.Functional dissection of the TBK1 molecular network[J/OL].PLoS One, 2011, 6(9):e23971. |
| [14] | HEMMI H, TAKEUCHI O, SATO S, et al. The roles of two IkappaB kinase-related kinases in lipopolysaccharide and double stranded RNA signaling and viral infection[J]. J Exp Med, 2004, 199 (12) :1641–1650. doi:10.1084/jem.20040520 |
| [15] | FITZGERALD K A, MCWHIRTER S M, FAIA K L, et al. IKKepsilon and TBK1 are essential components of the IRF3 signaling pathway[J]. Nat Immunol, 2003, 4 (5) :491–496. doi:10.1038/ni921 |
| [16] | CHIANG J J, DAVIS M E, GACK M U. Regulation of RIG-I-like receptor signaling by host and viral proteins[J]. Cytokine Growth Factor Rev, 2014, 25 (5) :491–505. doi:10.1016/j.cytogfr.2014.06.005 |
| [17] | WANG L, LI S, DORF M E.NEMO binds ubiquitinated TANK-binding kinase 1(TBK1) to regulate innate immune responses to RNA viruses[J/OL].PLoS One, 2012, 7(9):e43756. |
| [18] | GAO D, LI T, LI X D, et al. Activation of cyclic GMP-AMP synthase by self-DNA causes autoimmune diseases[J]. Proc Natl Acad Sci U S A, 2015, 112 (42) :E5699–5705. doi:10.1073/pnas.1516465112 |
| [19] | SUN L, WU J, DU F, et al. Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type I interferon pathway[J]. Science, 2013, 339 (6121) :786–791. doi:10.1126/science.1232458 |
| [20] | ZHAO Y, LIANG L, FAN Y, et al. PPM1B negatively regulates antiviral response via dephosphorylating TBK1[J]. Cell Signal, 2012, 24 (11) :2197–2204. doi:10.1016/j.cellsig.2012.06.017 |
| [21] | TU D, ZHU Z, ZHOU A Y, et al. Structure and ubiquitination-dependent activation of TANK-binding kinase 1[J]. Cell Rep, 2013, 3 (3) :747–758. doi:10.1016/j.celrep.2013.01.033 |
| [22] | SAUL V V, NIEDENTHAL R, PICH A, et al. SUMO modification of TBK1 at the adaptor-binding C-terminal coiled-coil domain contributes to its antiviral activity[J]. Biochim Biophys Acta, 2015, 1853 (1) :136–143. doi:10.1016/j.bbamcr.2014.10.008 |
| [23] | QIN Y, LIU Q, TIAN S, et al. TRIM9 short isoform preferentially promotes DNA and RNA virus-induced production of type I interferon by recruiting GSK3beta to TBK1[J]. Cell Res, 2016, 26 (5) :613–628. doi:10.1038/cr.2016.27 |
| [24] | MCCOY C E, CARPENTER S, PÅLSSON-MCDERMOTT E M, et al. Glucocorticoids inhibit IRF3 phosphorylation in response to Toll-like receptor-3 and-4 by targeting TBK1 activation[J]. J Biol Chem, 2008, 283 (21) :14277–14285. doi:10.1074/jbc.M709731200 |
| [25] | WANG C, CHEN T, ZHANG J, et al. The E3 ubiquitin ligase Nrdp1 'preferentially' promotes TLR-mediated production of type I interferon[J]. Nat Immunol, 2009, 10 (7) :744–752. doi:10.1038/ni.1742 |
| [26] | MIZUSHIMA N, YOSHIMORI T, OHSUMI Y. The role of Atg proteins in autophagosome formation[J]. Annu Rev Cell Dev Biol, 2011, 27 :107–132. doi:10.1146/annurev-cellbio-092910-154005 |
| [27] | ZHANG L, ZHAO X, ZHANG M, et al. Ubiquitin-specific protease 2b negatively regulates IFN-beta production and antiviral activity by targeting TANK-binding kinase 1[J]. J Immunol, 2014, 193 (5) :2230–2237. doi:10.4049/jimmunol.1302634 |
| [28] | CUI J, LI Y, ZHU L, et al. NLRP4 negatively regulates type I interferon signaling by targeting the kinase TBK1 for degradation via the ubiquitin ligase DTX4[J]. Nat Immunol, 2012, 13 (4) :387–395. doi:10.1038/ni.2239 |
| [29] | NG M H, HO T H, KOK K H, et al. MIP-T3 is a negative regulator of innate type I IFN response[J]. J Immunol, 2011, 187 (12) :6473–6482. doi:10.4049/jimmunol.1100719 |
| [30] | HUANG J, LIU T, XU L G, et al. SIKE is an IKK epsilon/TBK1-associated suppressor of TLR3-and virus-triggered IRF-3 activation pathways[J]. EMBO J, 2005, 24 (23) :4018–4028. doi:10.1038/sj.emboj.7600863 |
| [31] | ZHANG L, MO J, SWANSON K V, et al. NLRC3, a member of the NLR family of proteins, is a negative regulator of innate immune signaling induced by the DNA sensor STING[J]. Immunity, 2014, 40 (3) :329–341. doi:10.1016/j.immuni.2014.01.010 |
| [32] | YU T, YANG Y, DE Q Y, et al. TBK1 inhibitors:a review of patent literature (2011-2014)[J]. Expert Opin Ther Pat, 2015, 25 (12) :1385–1396. doi:10.1517/13543776.2015.1081168 |




