2. 宁波市临床病理诊断中心, 浙江 宁波 315031
2. Clinical Pathology Diagnosis Center, Ningbo 315031, China
特发性肥厚性硬脑膜炎(idiopathic hypertrophic cranial pachymeningitis, IHCP)是一种罕见的病因不明的以弥漫性或局灶性硬脑膜增厚为特征表现的慢性炎性疾病, 其临床表现多样且无特异性, 易被误诊和漏诊。有关该病的临床特征、影像学表现和诊治方案等国内外相关报道不少, 但以慢性硬脑膜下血肿为发病表现的罕见。这种隐匿于常见疾病的罕见疾病, 极易被临床医师忽视。笔者报道去年收治的一例患者, 以期引起同道注意。
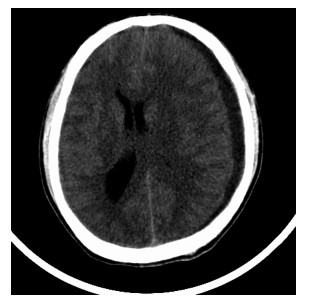
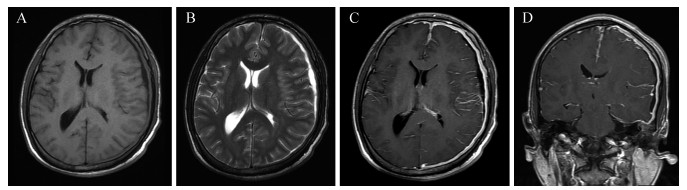
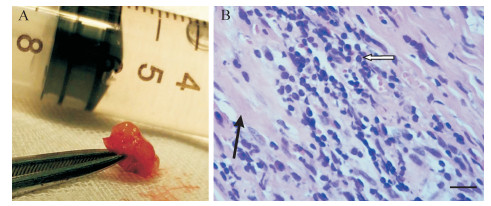
1 病历摘要患者, 男性, 26岁。因“阵发性头痛6 d, 加重伴恶心呕吐1 d”于2015年1月20日入院。患者入院前6 d无明显诱因出现阵发性头痛, 夜间明显, 伴右侧肢体轻度乏力。曾在卫生院就诊接受对症治疗, 无好转。入院前1 d头痛加重并出现恶心呕吐, 来宁波市医疗中心李惠利医院急诊。无发热, 无头部外伤史。既往无特殊病史。体检:神志清楚, 双眼球外展稍受限, 颈软, 右侧肢体肌力Ⅳ级, 巴宾斯基征阴性。头颅CT检查:左侧额颞顶枕部慢性硬脑膜下血肿, 中线结构明显右移(图 1)。初步诊断:左侧额颞顶枕慢性硬脑膜下血肿。于当日夜间急诊行左颞顶钻孔引流术, 术中发现硬脑膜下为黄褐色陈旧血性液体, 压力高, 骨孔下硬脑膜增厚。术中考虑为增厚的慢性硬脑膜下血肿外膜, 未送病理学检查。术后患者头痛症状缓解。查头颅CT血管造影未见明显颅内血管性病变。实验室检查:外周血白细胞12.6×109/L, 中性粒细胞分类0.907;超敏C反应蛋白78.9 mg/L; 抗梅毒螺旋体抗体、HIV抗体、HBV等均阴性。患者于术后第6天起再次出现头痛, 检查外展神经麻痹症状明显。颅脑MRI增强扫描结果:左侧额颞顶枕部硬脑膜、大脑镰、左侧小脑幕广泛增厚伴强化, 全脑软脑膜强化, 见图 2。腰椎蛛网膜下腔穿刺检查结果:压力400 mmH2O (1 mmH2O=0.0098 kPa); 脑脊液外观淡黄清晰, 潘氏试验++, 细胞数、葡萄糖含量正常; 脑脊液IgG 197 mg/L, 白蛋白492 mg/L。脑脊液涂片未找到隐球菌及抗酸杆菌, 微生物培养未见异常。肿瘤标志物、结核分枝杆菌T细胞检测、结核菌素试验(PPD试验)均阴性。红细胞沉降率52 mm/1 h; 血清IgA 6.97 g/L、IgG 17.3 g/L, 抗链球菌溶血素O:316.0 IU/mL。因患者临床表现及实验室检查与慢性硬脑膜下血肿不符, 遂于1月30日在局部麻醉下行脑膜活检术。病变硬脑膜呈灰红色肉芽样增厚(图 3A)。病理学检查结果:脑膜纤维组织增生伴大量炎性细胞浸润(图 3B)。免疫组织化学检查结果:IgG部分阳性、IgG4散在阳性、CD38阳性、CD138阳性、Kappa阳性、Lamba阳性、CD1a阴性、S-100阴性、CD68阳性、波形蛋白(Vimentin)阳性、Ki-67阳性(约10%)、上皮膜抗原(EMA)阴性、雌激素受体(ER)阴性、过碘酸希夫染色(PAS)阴性。诊断为IHCP, 给予地塞米松10 mg静脉滴注, 1次/d, 共5 d, 患者头痛症状明显好转。改为泼尼松口服后出院。目前仍在随访中, 无复发。
|
| 图 1 患者入院时头颅CT表现 Fig. 1 Head CT image on admission |
|
| A、B:轴位T1WI、T2WI扫描显示左侧颅板下硬脑膜弥漫性增厚, 病变呈等信号; C、D:横断面、冠状位T1WI增强扫描显示左侧半球硬脑膜、大脑镰、左侧小脑幕异常增厚伴明显强化, 软脑膜强化. 图 2 患者左颞顶钻孔引流术后6 d头颅MRI检查表现 Fig. 2 Cranial MRI image on day 6 after Burr hole drainage for hematoma |
|
| A:大体表现; B:脑膜病变组织HE染色可见, 硬脑膜纤维组织增生(黑色箭头), 伴大量淋巴细胞、浆细胞等慢性炎性细胞(白色箭头)浸润, 标尺=100 μm. 图 3 患者脑膜活检标本病理学表现 Fig. 3 Gross manifestation and photomicrograph of the meningeal specimen |
IHCP的病因和发病机制不明, 一般认为与自生免疫失调有关, 炎症可累及颅内及脊髓硬脑膜[1]。本病多慢性起病, 以成人多见, 男性为主。头痛是最常见的症状, 多颅神经麻痹、小脑共济失调、脊髓压迫等症状亦较为多见。少数患者可有短暂性脑缺血发作、脑积水等表现[1-2]。本例以慢性硬脑膜下血肿为发病表现, 相关报道罕见。IHCP头颅CT检查多无特殊表现, 有时大脑镰或小脑幕增厚出现高密度改变, 可误诊为蛛网膜下腔出血[3]。MRI检查是评价IHCP病变范围和严重程度的主要方法, 也可作为随访观察疗效的手段。MRI可见病变硬脑膜呈局灶性或弥漫性增厚, T1WI呈等或略低信号, T2WI为低信号; 增厚的硬脑膜多呈条带状或斑块状, 增强扫描后明显强化, 可见于脑膜或硬脊膜任何部位。本例患者MRI增强表现亦较为典型。IHCP在血清学检查多无特异性表现, 患者可有C反应蛋白、免疫球蛋白增多, 红细胞沉降率增加等免疫功能异常表现。部分患者存在颅内压增高和脑脊液异常改变[4], 脑血管造影检查可发现合并有静脉窦的狭窄或梗阻[5]。本例患者头颅CT血管造影未见明显颅内血管性病变, 但可见左侧(手术侧)皮层静脉充盈, 呈流出受阻表现, 推测亦存在静脉窦狭窄梗阻的可能。
IHCP诊断的确立是基于典型的MRI表现、脑膜组织活检以及排除各种继发性因素[3], 是一个排除性诊断。病理学检查是确诊依据。典型的病理组织学表现为硬脑膜增厚伴明显纤维化、大量炎性细胞浸润, 以及坏死和肉芽肿形成[6]。免疫组织化学检查可帮助鉴别和排除特异性感染、肿瘤、IgG4相关性脑膜炎等情况。本例患者为年轻男性, 以头痛、左侧慢性硬脑膜下血肿为主要发病表现, 术后颅内压持续性升高、红细胞沉降率增加、脑脊液中免疫球蛋白增多等表现难以单纯用慢性硬脑膜下血肿的病理表现来解释。通过实验室及病理学检查排除了结核、神经梅毒、肿瘤等, 同时排除真菌感染、富含淋巴浆细胞型脑膜瘤及罗道(Rosai-Dorfman)病侵及硬脑膜。还需与以下特殊情况进行鉴别:①IgG4相关性肥厚性脑膜炎(HCP):本例患者免疫组织化学检查见少量IgG4阳性细胞(每个高倍镜视野少于10个), 但未达到IgG4相关性HCP的诊断标准[7]。②慢性硬脑膜下血肿患者血肿外膜亦可增厚, 与IHCP患者的影像学表现不易区分, 本例患者的MRI表现也一度被认为是血肿外膜的“正常”表现。但慢性硬脑膜下血肿外膜与IHCP在病理表现上有本质区别:前者硬脑膜结构仍保持正常且完整, 血肿外膜在肉眼下多表现为灰红色质脆的膜样结构, 组织学检查除纤维增生和炎性细胞浸润外, 大量的新生血管形成是其显著特征[8]; 而本例病变源于硬脑膜, 大体表现呈灰红色肉芽样增厚, 血供不丰富, 显微镜下见脑膜纤维组织增生伴大量炎性细胞浸润, 但未见明显血管结构, 故两者可以区分。本例患者发病的原因不明, 患者同时出现慢性硬脑膜下血肿与IHCP, 两者孰为因果难下定论。硬脑膜内层和蛛网膜间并无明确的解剖学间隙, 其间为一层移行延续的边界细胞层, 而该细胞层的局部炎性反应则是慢性硬脑膜下血肿发生、发展的重要因素[9]。Zhao等[4]发现部分IHCP同时伴有脑脊液IgG、蛋白含量增多, 因此认为系炎性反应累及蛛网膜, 进而破坏血脑脊液屏障, 导致脑脊液的炎性改变。本例患者MRI检查发现软脑膜强化, 亦伴有脑脊液的炎性改变, 且病变硬脑膜Ki-67达10%, 考虑IHCP增殖进展导致的炎性渗出可能为慢性硬脑膜下血肿形成的起始因素。
IHCP发病与自身免疫失调有关, 目前治疗主要是应用皮质激素。大部分文献报道患者对于皮质激素反应良好, 但有的患者停药后出现复发, 成为激素依赖。对于皮质激素治疗无效, 或产生了激素依赖并有不良反应的患者, 每周低剂量皮下应用甲氨蝶呤可能有效, 同时也可作为补充以减少激素用量[10]。对于出现局部占位效应、脑神经受压明显者, 手术减压治疗也是一种选择[11], 但术后仍需药物治疗及长期随访。本例提示IHCP也可以出现以慢性硬脑膜下血肿为表现的伴发症状。鉴于慢性硬脑膜下血肿在神经外科极为常见, 而表现为慢性硬脑膜下血肿的IHCP易被忽略, 故需要临床注意鉴别。
| [1] | ABURAHMA S K, ANABTAWI A G, AL RIMAWI H S, et al. Idiopathic hypertrophic pachymeningitis in a child with hydrocephalus[J]. Pediatr Neurol, 2009, 40 (6) :457–460. doi:10.1016/j.pediatrneurol.2008.12.018 |
| [2] | FAN Y, LIAO S, YU J, et al. Idiopathic hypertrophic cranial pachymeningitis manifested by transient ischemic attack[J]. Med Sci Monit, 2009, 15 (12) :CS178–CS181. |
| [3] | 汪阳, 王淳良, 杨玄勇, 等. 慢性肥厚性硬脑膜病变误诊为蛛网膜下腔出血二例并文献复习[J]. 中华神经外科杂志, 2012, 28 (1) : 84–86. WANG Yang, WANG Chunliang, YANG Xuanyong, et al. Chronic hypertrophic cranial pachymeningitis misdiagnosed as subarachnoid hemorrhage:report of 2 cases and review of the literature[J]. Chinese Journal of Neurosurgery, 2012, 28 (1) :84–86. (in Chinese) |
| [4] | ZHAO M, QIAO L, SHI J, et al. Arachnoid involved in idiopathic hypertrophic pachymeningitis[J]. J Neurol Sci, 2014, 346 (1-2) :227–230. doi:10.1016/j.jns.2014.08.033 |
| [5] | BHATIA R, TRIPATHI M, SRIVASTAVA A, et al. Idiopathic hypertrophic cranial pachymeningitis and dural sinus occlusion:two patients with long-term follow up[J]. J Clin Neurosci, 2009, 16 (7) :937–942. doi:10.1016/j.jocn.2008.08.012 |
| [6] | 熊斌, 姚生, 刘建国, 等. 特发性肥厚性硬脑膜炎的临床、病理特点及治疗体会[J]. 中国神经免疫学和神经病学杂志, 2008, 15 (3) : 179–182. XIONG Bin, YAO Sheng, LIU Jianguo, et al. Clinical manifestations, pathology features and treatment experience of IHCP[J]. Chinese Journal of Neuroimmunology and Neurology, 2008, 15 (3) :179–182. (in Chinese) |
| [7] | LINDSTROM K M, COUSAR J B, LOPES M B. IgG4-related meningeal disease:clinico-pathological features and proposal for diagnostic criteria[J]. Acta Neuropathol, 2010, 120 (6) :765–776. doi:10.1007/s00401-010-0746-2 |
| [8] | SHIM Y S, PARK C O, HYUN D K, et al. What are the causative factors for a slow, progressive enlargement of a chronic subdural hematoma?[J]. Yonsei Med J, 2007, 48 (2) :210–217. doi:10.3349/ymj.2007.48.2.210 |
| [9] | KOLIAS A G, CHARI A, SANTARIUS T, et al. Chronic subdural haematoma:modern management and emerging therapies[J]. Nat Rev Neurol, 2014, 10 (10) :570–578. doi:10.1038/nrneurol.2014.163 |
| [10] | BOSMAN T, SIMONIN C, LAUNAY D, et al. Idiopathic hypertrophic cranial pachymeningitis treated by oral methotrexate:a case report and review of literature[J]. Rheumatol Int, 2008, 28 (7) :713–718. doi:10.1007/s00296-007-0504-5 |
| [11] | LU Y R, YEH J H, TSAI M D, et al. Focal idiopathic hypertrophic pachymeningoencephalitis[J]. J Formos Med Assoc, 2008, 107 (2) :181–184. doi:10.1016/S0929-6646(08)60132-1 |




