干眼是由于泪液质或量或流体动力学异常引起的泪膜不稳定和(或)眼表损害从而导致眼不适症状及视功能障碍的一类疾病[1]。有研究发现,在成年人群中干眼的发病率高达14%~33%,并且其发病率随着年龄的增加而上升[2-4]。泪膜是眼表重要的屈光介质,其完整性和稳定性对于维持正常眼表环境及视觉质量起着至关重要的作用。泪膜的最外层——脂质层主要由睑板腺分泌而成;当睑板腺出现终末导管阻塞和/或睑板腺分泌物质或量改变等[5-6]即睑板腺功能障碍(meibomian gland dysfunction)时,泪膜的稳定性下降,从而可引发干眼。研究表明,约三分之二的干眼病例由阻塞性睑板腺功能障碍引起,在欧洲,约20%的人口患有阻塞性睑板腺功能障碍,而在亚洲这一比例高达60%[6-8]。因此,泪膜及睑板腺功能的准确评估对于干眼的诊断具有重要意义。目前临床上最常采用的评估泪膜功能的方法是荧光素染色测量泪膜破裂时间(tear break-up time,BUT),得到荧光素钠BUT(fluorescein BUT,FBUT)睑板腺的评估主要采用裂隙灯下观察睑板腺形态及分泌物性状的方法。这些传统方法不仅具有侵袭性,而且受主观因素影响较大,准确性较低。本研究通过使用Keratograph 5M眼表综合分析仪比较健康人群和干眼患者的泪膜及睑板腺改变情况,并与传统测量方法比较,评估该仪器临床应用性能,从而为临床诊断干眼寻求方便、准确、干扰因素小的检测手段。
1 对象与方法 1.1 研究对象选取2014年5月至2015年3月就诊于浙江大学医学院附属邵逸夫医院眼科中心符合干眼组入选标准的72眼及来自健康志愿者的健康对照组72眼。入选干眼组考虑以下方面:①主观症状:异物感、烧灼感、疲劳感、干燥感、不适感、视力波动等;②泪膜稳定性:FBUT;③泪液分泌试验:不使用表面麻醉的Schirmer Ⅰ试验;④眼表面损害:荧光素染色阳性。在上述几项中,有主观症状+FBUT≤5 s或主观症状+泪液分泌试验结果≤5 mm/min或主观症状+(5 s<FBUT≤10 s)+眼表面损害或主观症状+(5 mm/min<泪液分泌试验结果≤10 mm/min)+眼表面损害即入选干眼组[1]。排除标准:①曾有眼部手术史、外伤史;②2周内使用过角膜接触镜;③眼部用药史:影响泪液分泌及泪膜稳定性的药物如人工泪液、非甾体类抗炎药、皮质类固醇等;④患有其他眼表疾病:如胬肉、角结膜炎症、泪道疾病、倒睫等;⑤患有其他全身系统性疾病,如类风湿性关节炎、红斑狼疮等。
干眼组平均年龄为(43.80±14.04)岁(22~76岁),其中男性27例,女性45例;健康对照组平均年龄为(39.72±17.27)岁(23~72岁),其中男性28例,女性44例。两组受试者平均年龄和性别构成差异均无统计学意义(均P>0.05)。
本研究获得所有参与者的知情同意,并符合赫尔辛基宣言的相关伦理要求。
1.2 设备与试剂Keratograph 5M眼表综合分析仪由德国Oculus公司生产。一次性荧光素钠试纸购自天津晶明新技术开发有限公司。
1.3 检查流程每位受试者的所有检查均在同一天由同一位医师完成。首先由该医师指导受试者通过眼表疾病指数(ocular surface disease index,OSDI)问卷进行眼部主观症状评估,然后使用Keratograph 5M测量下睑中央泪河高度(tear meniscus height,TMH)和非侵袭BUT(noninvasive BUT,NIBUT),并使用该仪器行上下睑板腺红外照相后评分,最后荧光素钠染色后裂隙灯下测量并记录FBUT。每项检查的间隔时间不少于10 min。
1.4 采用眼表疾病指数问卷评估眼部症状采用目前国际上最常用的评估眼表疾病严重程度的方法之一——OSDI问卷[9]。该问卷由国际干眼工作小组制定,用来快速评估与干眼相关的眼表刺激症状及对视功能的影响情况。问卷主要包括眼部不适、视功能及环境触发三部分共12条症状项目:①畏光;②异物感;③酸胀痛;④视物模糊;⑤低视力;⑥阅读困难;⑦夜间驾驶困难;⑧无法使用电脑工作;⑨无法看电视;⑩刮风时眼睛不适; B11 干燥时眼睛不适; B12 开空调时眼睛不适。由同一医师指导受试者填写该问卷,评估近1周内是否出现过问卷中所提到的症状,两眼分别评估,每项记分:从未出现该症状计0分,小部分时间出现计1分,一半时间出现计2分,大部分时间出现计3分,症状持续出现计4分。12条症状项目可以不全部回答,总分计算公式为(所有回答项目得分总和×100)/(回答项目数×4),满分为100分[10]。判定标准:0~12分为正常眼表状态,13~22分为轻度干眼状态,23~32分为中度干眼状态,33~100分为严重干眼状态[11]。
1.5 采用Keratograph 5M测量TMH、NIBUT以及上下睑板腺红外照相评分采用Keratograph 5M对所有受试者眼表及睑板腺进行相关检查并记录数据。TMH测量:首先采用不会引起反射性流泪的红外光对患者下睑中央进行对焦后,嘱患者轻轻瞬目,切换白光快速拍摄后使用仪器自带测量工具测量下睑TMH;每眼检查三次,取平均值记录。NITBUT测量:令患者注视前方,使用红外光源对焦后按照屏幕提示嘱患者瞬目两次后尽可能坚持不要眨眼,仪器会录下患者持续睁眼时间内泪膜变化的视频,同时自动计算出首次NIBUT和平均NIBUT;同样每眼检查三次,取平均值记录。 睑板腺红外照相评分:先后翻转受试者上、下眼睑,应用仪器红外摄像系统对上、下睑板腺分别进行拍摄。拍摄的图片经过系统所带的Meibo-Scan增强对比模式处理后,睑板腺表现为白色纹理,其余结构则为深灰色背景,见图 1。对睑板腺中央三分之一区域进行评分,包括三方面: (1)睑板腺萎缩(表现为腺体变细、缩短):0分,该区域内每条睑板腺均无萎缩;1分,该区域内只有部分睑板腺萎缩,但仍有无萎缩的腺体;2分,该区域内每条睑板腺均萎缩。 (2)睑板腺扭曲(表现为腺体扭曲、卷绕):0分,该区域内每条睑板腺均无扭曲;1分,该区域内只有部分睑板腺扭曲,但仍有形态正常无扭曲的腺体;2分,该区域内每条睑板腺均扭曲。(3)睑板腺钙化(表现为腺体中高反光亮点):0分,该区域内每条睑板腺均无钙化;1分,该区域内至少有一条腺体存在钙化,但仍有无钙化的腺体;2分,该区域内每条腺体均钙化。上述(1)~(3)评分上下睑板腺分别统计,将三项分数相加即得上或下睑板腺得分,将上下睑板腺得分相加即为最后总分。满分12分,分数越高,表示睑板腺功能越差。
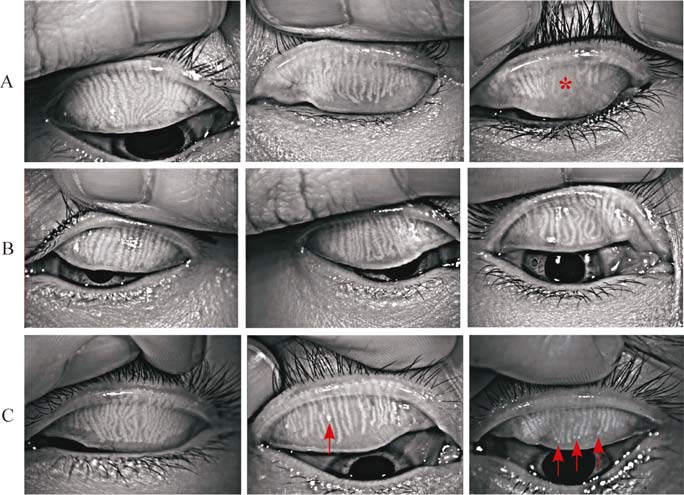
|
| 以上睑板腺为例,观察睑板腺中央三分之一区域。A:睑板腺萎缩,左为睑板腺区域中所有的 腺体均无萎缩,形态正常,计为0分;中为睑板腺中央三分之一区域部分腺体变细、变短,计为1 分;右为上睑板腺中央所有腺体均萎缩(*所示区域),计为2分。B:睑板腺扭曲,左示每条腺体 形态均正常,计为0分;中示仅数条腺体卷曲,仍有部分形态正常,则计为1分;右示每条腺体形 态均不正常,表现为扭曲、卷绕,计为2分。C:睑板腺钙化,左示每条腺体均无钙化,计为0分;中示 仅有部分腺体有高反光钙化灶(箭头所示),计为1分;右示每条腺体中均可观察到钙化点(箭头所示),计为2分。 图 1 Keratograph 5M拍摄的睑板腺照相图评分示意 Fig. 1 Scoring criteria by meibography images taken by Keratograph 5M staining |
在一次性荧光素钠试纸上滴一滴无菌等渗氯化钠溶液,待试纸浸润后用棉签小心擦去试纸上多余的液体,翻开被检者下睑并将湿润的试纸条轻轻触碰下睑结膜囊中央,嘱患者眨眼数次,裂隙灯钴蓝光下观察,自最后一次瞬目后自然平视睁眼至角膜出现第一个黑斑的时间为FBUT。
1.7 统计学方法统计分析使用SPSS 22.0软件进行,正态分布的计量资料用均数±标准差(x±s)表示,非正态分布数据用中位数(四分位数)[M(Q1,Q3)]表示。所有变量的正态性检验用Kolmogorov-Smirnov检验;对于服从正态分布的变量使用t检验,对于不服从正态分布的使用Wilcoxon符号秩和检验;双变量相关性分析对于服从正态分布的变量使用Pearson相关分析,不服从正态分布的使用Spearman相关分析。P<0.05为差异有统计学意义。
2 结 果 2.1 两组OSDI评分比较干眼组患者OSDI评分为16.7(10.0,25.0),明显高于健康对照组0(0,2.8),差异有统计学意义(P<0.01)。对所有受试者调查结果发现,其中异物感为最常见的症状,其次为迎风不适和畏光。
2.2 两组TMH和NIBUT比较两组TMH和NIBUT测量结果见表 1。干眼组下睑中央TMH低于健康对照组,提示干眼组患者的泪液分泌量少于健康对照组。而干眼组首次NIBUT短于健康对照组;同样,平均NIBUT也较健康对照组短,提示干眼组患者的泪膜稳定性较健康对照组差。
| (x±s) | ||||
| 组别 | n | TMH(mm) | 首次NIBUT(s) | 平均NIBUT(s) |
| 干眼组 | 72 | 0.19±0.04 | 5.00±1.96 | 8.49±3.66 |
| 健康对照组 | 72 | 0.28±0.06* | 10.81±5.38* | 14.21±5.38* |
| TMH:泪河高度;NIBUT:非侵袭式泪膜破裂时间.与干眼组比较,*P<0.01. | ||||
干眼组上下睑板腺红外线照相评分总分(3.13±1.36)高于健康对照组(1.80±0.92),差异有统计学意义(P<0.01)。检测者上下睑总分与首次NIBUT、平均NIBUT呈负相关,与年龄无相关性,见表 2。
| 睑板腺评分 | 首次NIBUT | 平均NIBUT | 年龄 | ||||
| r值 | P值 | r值 | P值 | r值 | P值 | ||
| 上睑板腺 | 萎缩 | -0.244 | 0.041 | -0.279 | 0.019 | 0.154 | 0.211 |
| 扭曲 | -0.190 | 0.115 | -0.008 | 0.950 | -0.213 | 0.081 | |
| 钙化 | -0.366 | 0.002 | -0.178 | 0.141 | 0.250 | 0.040 | |
| 下睑板腺 | 萎缩 | -0.095 | 0.434 | -0.343 | 0.004 | 0.069 | 0.576 |
| 扭曲 | -0.190 | 0.114 | -0.097 | 0.426 | -0.155 | 0.207 | |
| 钙化 | -0.144 | 0.235 | -0.220 | 0.067 | -0.169 | 0.168 | |
| 总分 | -0.449 | <0.01 | -0.398 | <0.01 | 0.031 | 0.802 | |
| NIBUT:非侵袭式泪膜破裂时间. | |||||||
相关性分析结果显示,Keratograph 5M测得的首次NIBUT与FBUT呈正相关(r=0.833,P<0.01),平均NIBUT与FBUT也同样呈正相关(r=0.727,P<0.01),图 2。提示Keratograph 5M测得的NIBUT与传统检测的FBUT相关性良好。
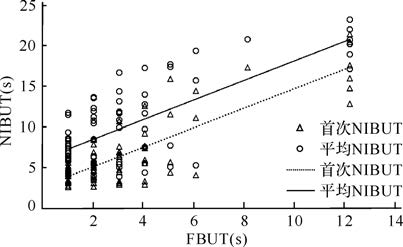
|
| NIBUT:非侵袭式泪膜破裂时间;FBUT:首次泪膜破裂时间. 图 2 Keratograph 5M测得的NIBUT与FBUT的相关性分析 Fig. 2 Correlation between NIBUT and FBUT |
干眼是目前临床上最常见的眼科疾病之一。随着现代社会的发展,人类对电脑、手机等电子设备的广泛使用导致用眼过度,此外由于大气污染等因素,干眼的发病率呈逐年上升趋势。目前业界普遍认为泪膜稳定性的检测以及睑板腺形态的观察可作为判断干眼的重要依据。
FBUT是评估泪膜稳定性最传统的方法,但由于该方法是侵袭性的,测量中需要使用荧光素进行染色,每次检查的荧光素浓度和用量无法统一量化控制,并且荧光素本身也有可能导致刺激性流泪从而使测量结果产生误差。另外,也有非侵袭的测量方式评估泪膜功能,包括泪液脂质层干涉仪[12-13]、泪膜镜等[14-15],但结果均具有一定的主观性。至于对睑板腺的评估目前常用的方法主要包括裂隙灯下观察(睑缘形态是否规整、有无睑缘充血、睑板腺开口有无阻塞或脂栓形成、Marx线有无移位等四项内容),同样具有较大的主观性。此外也有学者对睑板腺进行红外线照相后计算睑板腺缺失率[16],该方法需要使用另外的相应软件通过勾画睑板腺缺失区域从而计算睑板腺缺失率,十分繁琐并且对于睑板腺缺失区域的划分偏差较大,可重复性较低,并且其结果只是对睑板腺数量进行评估,忽略了形态、钙化等方面的影响,不能全面反映睑板腺功能。
在本研究中,我们使用最新的眼表综合分析仪Keratograph 5M对干眼患者进行泪膜及睑板腺分析。该仪器能同时测量多项干眼相关指标,如TMH、BUT、眼红分析、脂质层录像、睑板腺红外线照相、角膜荧光素染色照相等,具有规范化、一体化、程序化的特点。其中对BUT的测量无需荧光素染色,采用非侵袭的方法,计算机自动测算首次及平均NIBUT,很好地避免了传统荧光素染色测量方法对眼表的刺激以及人为计时可能产生的误差[17-18]。此外,本研究从睑板腺萎缩、扭曲、钙化三方面对睑板腺功能进行综合评估,较传统计算睑板腺功能障碍更加全面、简便。
本研究中使用Keratograph 5M测量结果干眼组与健康对照组的TMH、首次NIBUT和平均NIBUT均有显著差异,这与Hong等[18]的研究相符。Arriola-Villalobos等[19]使用该仪器测量健康人群的下睑中央TMH结果为0.24 mm,比我们测得的数据小,这可能与种族及年龄差异有关。Abdelfattah等[20]在2015年的一项研究中使用Keratograph 5M分析223只有眼表疾病的患眼(包括诊断为干眼或睑板腺功能障碍)和73只正常眼,结果显示患者组的TMH高于对照组,推测可能是由于患者组反射性流泪引起。而Lan等[21]对健康人群进行首次NIBUT测量,平均值(10.33±5.24)s与本研究测得的(10.81±5.38)s较为接近。此外,本研究发现首次NIBUT和平均NIBUT值与FBUT之间均存在显著的正相关关系,这与Jiang等[22]在2014年的报道结果相符,从而说明NIBUT同样可以很好地反映泪膜稳定性,并且由于其属于非接触式自动分析,较传统使用荧光素钠染色测量更实用。对于睑板腺的评估,Srinibasan等[23]使用Keratograph 4对睑板腺进行照相分析,猜测睑板腺钙化点与年龄有关。本研究统计结果显示,上睑板腺钙化与患者年龄相关,下睑板腺钙化与患者年龄无明显相关性。
本研究旨在使用目前最新的眼表综合分析仪器Keratograph 5M比较健康人群和干眼患者的泪膜及睑板腺功能,通过与传统测量方法的比较来评估该仪器的临床使用价值。综合各项检查结果,Keratograph 5M测量的BUT与传统方法测量结果具有良好的相关性,并且较传统方法更加客观、灵敏,对眼睛刺激少。此外,本研究中使用的睑板腺照相评分系统能全面、准确、快速地评估睑板腺形态及功能,可弥补传统裂隙灯评估方法的不足,对临床有较强的指导意义,同时可为临床干眼及眼表疾病相关研究进行标准化的评估提供借鉴。
| [1] | 中华医学会眼科学分会角膜病学组. 干眼临床诊疗专家共识(2013年)[J]. 中华眼科杂志, 2013, 49 (1) : 73–75. Cornea Group. Ophthalmology Branch of Chinese Medical Association. Experts consensus on diagnosis and treatment of xerophthalmia(2013 version)[J]. Chinese Journal of Ophthalmology, 2013, 49 (1) :73–75. (in Chinese) |
| [2] | MCCARTY C A, BANSAL A K, LIVINGSTON P M, et al. The epidemiology of dry eye in Melbourne, Australia[J]. Ophthalmology, 1998, 105 (6) :1114–1119. doi:10.1016/S0161-6420(98)96016-X |
| [3] | MOSS S E, KLEIN R, KLEIN B E. Prevalence of and risk factors for dry eye syndrome[J]. Arch Ophthalmol, 2000, 118 (9) :1264–1268. doi:10.1001/archopht.118.9.1264 |
| [4] | SCHEIN O D, MUNOZ B, TIELSCH J M, et al. Prevalence of dry eye among the elderly[J]. Am J Ophthalmol, 1997, 124 (6) :723–728. doi:10.1016/S0002-9394(14)71688-5 |
| [5] | GEERLING G, TAUBER J, BAUDOUIN C, et al. The international workshop on meibomian gland dysfunction: report of the subcommittee on management and treatment of meibomian gland dysfunction[J]. Invest Ophthalmol Vis Sci, 2011, 52 (4) :2050–2064. doi:10.1167/iovs.10-6997g |
| [6] | NICHOLS K K, FOULKS G N, BRON A J, et al. The international workshop on meibomian gland dysfunction: executive summary[J]. Invest Ophthalmol Vis Sci, 2011, 52 (4) :1922–1929. doi:10.1167/iovs.10-6997a |
| [7] | FINIS D, SCHRADER S, GEERLING G. Meibomian gland dysfunction[J]. Klin Monbl Augenheilkd, 2012, 229 (5) :506–513. doi:10.1055/s-0031-1299533 |
| [8] | SCHAUMBERG D A, NICHOLS J J, PAPAS E B, et al. The international workshop on meibomian gland dysfunction: report of the subcommittee on the epidemiology of, and associated risk factors for, MGD[J]. Invest Ophthalmol Vis Sci, 2011, 52 (4) :1994–2005. doi:10.1167/iovs.10-6997e |
| [9] | BAUDOUIN C, ARAGONA P, VAN SETTEN G, et al. Diagnosing the severity of dry eye: a clear and practical algorithm[J]. Br J Ophthalmol, 2014, 98 (9) :1168–1176. doi:10.1136/bjophthalmol-2013-304619 |
| [10] | SCHIFFMAN R M, CHRISTIANSON M D, JACOBSEN G, et al. Reliability and validity of the ocular surface disease index[J]. Arch Ophthalmol, 2000, 118 (5) :615–621. doi:10.1001/archopht.118.5.615 |
| [11] | MILLER K L, WALT J G, MINK D R, et al. Minimal clinically important difference for the ocular surface disease index[J]. Arch Ophthalmol, 2010, 128 (1) :94–101. doi:10.1001/archophthalmol.2009.356 |
| [12] | GOTO E, TSENG S C. Kinetic analysis of tear interference images in aqueous tear deficiency dry eye before and after punctal occlusion[J]. Invest Ophthalmol Vis Sci, 2003, 44 (5) :1897–1905. doi:10.1167/iovs.02-0818 |
| [13] | GOTO E, TSENG S C. Differentiation of lipid tear deficiency dry eye by kinetic analysis of tear interference images[J]. Arch Ophthalmol, 2003, 121 (2) :173–180. doi:10.1001/archopht.121.2.173 |
| [14] | MENGHER L S, BRON A J, TONGE S R, et al. A non-invasive instrument for clinical assessment of the pre-corneal tear film stability[J]. Curr Eye Res, 1985, 4 (1) :1–7. doi:10.3109/02713688508999960 |
| [15] | WANG J, PALAKURU J R, AQUAVELLA J V. Correlations among upper and lower tear menisci, noninvasive tear break-up time, and the Schirmer test[J]. Am J Ophthalmol, 2008, 145 (5) :795–800. doi:10.1016/j.ajo.2007.12.035 |
| [16] | NICHOLS J J, BERNTSEN D A, MITCHELL G L, et al. An assessment of grading scales for meibography images[J]. Cornea, 2005, 24 (4) :382–388. doi:10.1097/01.ico.0000148291.38076.59 |
| [17] | FULLER D G, PORTS K, WKIM J. Noninvasive tear breakup times and ocular surface disease[J]. Optom Vis Sci, 2013, 90 (10) :1086–1091. doi:10.1097/OPX.zjdxxbyxb-45-4-42200023 |
| [18] | HONG J, SUN X, WEI A, et al. Assessment of tear film stability in dry eye with a newly developed keratograph[J]. Cornea, 2013, 32 (5) :716–721. doi:10.1097/ICO.0b013e3182714425 |
| [19] | ARRIOLA-VILLALOBOS P, FERNANDEZ-VIGO J I, DIAZ-VALLE D, et al. Assessment of lower tear meniscus measurements obtained with Keratograph and agreement with Fourier-domain optical-coherence tomography[J]. Br J Ophthalmol, 2015, 99 (8) :1120–1125. doi:10.1136/bjophthalmol-2014-306453 |
| [20] | ABDELFATTAH N S, DASTIRIDOU A, SADDA S R, et al. Noninvasive imaging of tear film dynamics in eyes with ocular surface disease[J]. Cornea, 2015, 34 (Suppl 10) :S48–S52. |
| [21] | LAN W, LIN L, YANG X, et al. Automatic noninvasive tear breakup time (TBUT) and conventional fluorescent TBUT[J]. Optom Vis Sci, 2014, 91 (12) :1412–1418. doi:10.1097/OPX.zjdxxbyxb-45-4-42200418 |
| [22] | JIANG Y, YE H, XU J, et al. Noninvasive Keratograph assessment of tear film break-up time and location in patients with age-related cataracts and dry eye syndrome[J]. J Int Med Res, 2014, 42 (2) :494–502. doi:10.1177/0300060513504701 |
| [23] | SRINIVASAN S, MENZIES K, SORBARA L, et al. Infrared imaging of meibomian gland structure using a novel keratograph[J]. Optom Vis Sci, 2012, 89 (5) :788–794. doi:10.1097/OPX.0b013e318253de93 |




