新辅助化疗作为乳腺癌综合治疗常用的手段之一,正发挥着日益重要的作用,特别是对于局部晚期乳腺癌患者[1-3]。目前比较一致的观点认为,新辅助化疗能使肿瘤的分期降低,增加保乳的机会[4],虽然新辅助化疗和术后辅助化疗患者无病生存期(disease-free survival,DFS)和总生存期(overall survival,OS)并无明显差异[5],但是新辅助化疗后获得病理完全缓解(pathological complete response,pCR)者其DFS和OS均明显延长。如果在新辅助化疗中疗效达到pCR,三阴性乳腺癌(TNBC)患者可获得与非TNBC患者类似的生存情况。但新辅助化疗对TNBC的综合疗效目前仍存在争议,TNBC患者若未能在新辅助化疗中获得pCR,其预后往往非常不佳,复发和转移的概率较未获得pCR的非TNBC患者明显增高,生存期也明显缩短[6]。鉴于pCR已经成为评价乳腺癌新辅助化疗方案疗效最重要的指标之一[7],近年的一些临床研究正在通过加入新的抗癌药物、分子靶向治疗药物等途径以求进一步提高pCR率。
现有结果表明,蒽环类药物联合紫杉醇类化合物有提高患者临床疗效及pCR的趋势,但差异并无统计学意义,卡培他滨、吉西他滨等联合蒽环类或紫杉醇类新辅助化疗方案不能有效提高pCR及保乳手术概率[8-10]。因此,在新辅助化疗中加入分子靶向治疗是近年的研究热点之一。对于Her2阴性乳腺癌患者的新辅助治疗,其分子靶向治疗主要是针对血管内皮生长因子的单克隆抗体即贝伐珠单克隆抗体(贝伐珠单抗)的研究。
目前已有大量贝伐珠单抗应用于乳腺癌新辅助治疗的Ⅱ期或Ⅲ期随机临床试验,不同试验中对于联用贝伐珠单抗的疗效及不良反应报道并不一致[10-15]。为衡量贝伐珠单抗在乳腺癌新辅助治疗中的有效性及安全性,我们通过文献检索,收集Her2阴性乳腺癌患者使用新辅助化疗联合贝伐珠单抗对比单用新辅助化疗的前瞻性随机对照研究结果,采用meta分析的方法进行评价,以期获得更加可靠的结论,进而指导临床实践。
1 资料与方法 1.1 纳入标准和排除标准 1.1.1 纳入标准收集已经公开发表的关于使用单纯新辅助化疗(化疗组)对比新辅助化疗联合贝伐珠单抗(联合组)靶向治疗对于Her2阴性乳腺癌患者的有效性和安全性的Ⅱ期或Ⅲ期前瞻性随机对照研究。新辅助化疗方案无限制,但同一个研究,联合组与化疗组的新辅助化疗方案相同。主要研究指标为pCR(定义为乳腺和腋窝淋巴结无浸润性肿瘤,可有导管内原位癌),如果研究结果报告了乳腺组织和乳腺组织加腋窝淋巴结两个pCR,选用后者;次要研究指标为Ⅲ~Ⅳ级不良反应发生率,包括中性粒细胞减少、中性粒细胞减少性发热、黏膜炎、手足综合征、周围神经病变、感染、手术并发症及高血压。
1.1.2 排除标准不可手术的晚期乳腺癌研究;Her2阳性乳腺癌新辅助治疗研究;非前瞻性随机对照试验研究;联合组与化疗组基线均衡性差,两者无明显可比性的研究;疗效评定指标不明确的研究;失访率超过10%的研究。
1.2 检索策略计算机检索PubMed、 the Cochrane Library、Web of Science、中国期刊全文数据库和万方医药期刊全文数据库,检索时限均截至2015年8月,语种不限。手动检索近5年重要国际肿瘤学会议摘要,包括美国临床肿瘤大会、欧洲肿瘤内科学会年会、圣安东尼奥乳腺癌会议。当同一个研究有多篇文献报道时,只评估最新、最近的文献。
以主题词结合自由词的方式检索,根据不同数据库选择不同主题词(如MeSH)。所有的检索策略经过多次预检索后确定。中文检索词包括乳腺肿瘤、乳腺癌、乳癌、新辅助治疗、贝伐单抗、贝伐珠单抗、安维汀。英文检索词包括breast neoplasm、breast cancer、breast tumor、human mammary carcinoma、human mammary neoplasm、neoadjuvant、Avastin、bevacizumab。以PubMed为例,其检索式为(“breast neoplasms”[MeSH Terms] OR breast neoplasm OR breast cancer OR breast tumor OR human mammary carcinoma OR human mammary neoplasm)AND(neoadjuvant OR preoperative OR induction OR primary systemic OR primary chemotherapy)AND(bevacizumab OR Avastin)AND(Clinical Trial[ptyp]),并根据所纳入文献的参考文献进行扩大检索。
1.3 文献筛选及资料提取由两位研究者(韩瑞和王冠英)独立筛选文献,并交叉核对,遇到分歧时通过讨论、查阅原始资料或请教相关专家解决。资料如有出入,通过共同复查文献并请教专家核准数据。资料提取的内容包括:第一作者姓名,发表年份,可评价疗效病例数,入组患者的年龄,雌激素受体/孕激素受体状态,淋巴结是否阳性,干预措施(化疗方案剂量、贝伐珠单抗剂量及持续时间),研究指标包括pCR率、Ⅲ~Ⅳ级不良反应发生例数等。
1.4 方法学质量评价对所纳入研究的方法学质量评价由两位研究者(韩瑞和王冠英)独立完成,按照Cochrane系统评价员手册[11]进行,内容包括:随机序列产生、分配隐藏、盲法、意向性分析、资料完整性、选择性报告结果。依据评价结果,将纳入的研究分为A、B、C三个等级。
1.5 统计学方法运用RevMan v5.3软件进行统计分析。对每项研究均计算其危险比(RR)及95%可信区间(95%CI)。用Q检验对纳入的研究进行异质性分析,检验水准为α=0.1。并用I2 对异质性进行定量分析,显著性水平设定为50%,I2≥50%时表明各项研究结果间异质性较大。各研究无明显异质性时,采用固定效应模型、Mantel Haenszel法进行meta分析;存在明显异质性时,首先分析异质性产生的原因,如处理后仍无法消除异质性,则采用随机效应模型。所得P值均为双侧检验。
2 结 果 2.1 文献筛选依上述检索策略最初获得346篇文献,剔除重复文献后保留302篇。通过阅读文题和摘要,剔除综述、个案报道、回顾性及观察性研究、干预措施不符合纳入标准等的文献后保留144篇。严格按纳入、排除标准复筛后有七项前瞻性随机对照研究入选,其中一项因入组病例数过少、文献质量差而排除,最终纳入NSABP B-40[10]、ARTemis[12]、Gepar Quinto[13]、CALGB 40603[14]、NeoAva[15]、CN-01026715[16]六项研究,均为英文文献。
2.2 纳入研究的基本特征和方法学质量评价所纳入的六项研究中患者均为Her2 阴性,其中CALGB 40603研究[14]患者激素受体状态均为阴性,其余五项研究患者激素受体状态或者阳性、或者阴性。NeoAva[15]研究结果来自会议摘要,其贝伐珠单抗的剂量未具体描述。纳入研究的基本特征详见表 1,方法学质量评价见表 2。
| 纳入研究名称(作者) | 国家或地区 | 激素受体阴性占比 | 各组纳入患者例数 | 治疗方案 |
| NSABP B-40 Ⅲ期 (Bear等)[10] | 美国 | 41% | 化疗组201 | 多西他赛100 mg/m2,1次/3周×4$\to $多柔比星(60 mg/m2)-环磷酰胺 (600 mg/m2),1次/3周×4 |
| 联合组199 | 上述化疗+贝伐珠单抗15 mg/kg,1次/3周×6(术后继续10个周期) | |||
| 化疗组204 | 卡培他滨825 mg/m2,2次/d,口服第1~14天+多西他赛100 mg/m2,第 1天,1次/3周$\to $多柔比星(60 mg/m2)-环磷酰胺(600 mg/m2), 1次/3周×4 | |||
| 联合组201 | 上述化疗+贝伐珠单抗15 mg/kg,1次/3周×6(术后继续10个周期) | |||
| 化疗组197 | 吉西他滨1000 mg/m2,第1、8天+多西他赛100 mg/m2,第1天,1次/3周$\to $多柔比星(60 mg/m2)-环磷酰胺(600 mg/ m2),1次/3周×4 | |||
| 联合组204 | 上述化疗+贝伐珠单抗 15 mg/kg ,1次/3周×6(术后继续10个周期) | |||
| ARTemis Ⅱ期 (Earl 等)[12] | 英国 | 31% | 化疗组401 | 多西他赛100 mg/m2,1次/3周×3$\to $FEC 1次/3周 ×3 |
| 联合组399 | 上述化疗+贝伐珠单抗 15 mg/kg,1次/3周 ×3 | |||
| GeparQuinto Ⅲ期(Von Minckwitz等)[13] | 德国 瑞士 | 34% | 化疗组974 | EC ,1次/3周 ×4$\to $多西他赛100 mg/m2,1次/3周×4 |
| 联合组974 | 上述化疗+贝伐珠单抗15 mg/kg,1次/3周×8 | |||
| CALGB 40603 Ⅱ期 (Sikov 等)[14] | 美国 | 100% | 化疗组107 | 紫杉醇80 mg/m2,1次/周×12$\to $ddAC× 4 |
| 联合组105 | 上述化疗+贝伐珠单抗10 mg/kg,1次/2周× 9 | |||
| 化疗组111 | 紫杉醇80 mg/m2,1次/周×12$\to $ddAC× 4+卡铂AUC6,1次/3周× 4 | |||
| 联合组110 | 上述化疗+贝伐珠单抗10 mg/kg,1次/2周× 9 | |||
| NeoAva Ⅱ期 (Engebraaten等)[15] | 欧洲 | 17.6% | 化疗组37 | 4×FEC$\to $紫杉醇80 mg/m2,1次/周×12 |
| 联合组37 | 上述化疗+贝伐珠单抗 | |||
| CN-01026715 Ⅱ期 (Hurvitz等)[16] | 美国 | 未报道 | 化疗组32 | TAC× 6+足量安慰剂1次/3周× 6 |
| 联合组30 | TAC× 6+贝伐珠单抗15 mg/kg,1次/3周×6$\to $贝伐珠单抗持续用至 52周 | |||
| FEC:氟尿嘧啶(500 mg/m2 )+表柔比星(100 mg/m2 )+环磷酰胺(500 mg/m2);EC:表柔比星(90 mg/m2)+环磷酰胺(600 mg/m2); ddAC:剂量密集型化疗,即多柔比星(60 mg/m2)+环磷酰胺(600 mg/m2)1次/2周 ;TAC:多西他赛(75 mg/m2)+多柔比星(50 mg/m2)+环磷酰胺(500 mg/m2). | ||||
| 纳入研究 | 随机序列产生 | 分配隐藏 | 盲法 | 意向性分析 | 资料完整性 | 选择性报告结果 |
| NSABP B-40 Ⅲ期 | 低风险 | 低风险 | 高风险 | 低风险 | 低风险 | 低风险 |
| GeparQuinto Ⅱ期 | 低风险 | 低风险 | 高风险 | 低风险 | 低风险 | 低风险 |
| ARTemis Ⅲ期 | 低风险 | 低风险 | 高风险 | 低风险 | 低风险 | 低风险 |
| CALGB 40603 Ⅱ期 | 低风险 | 低风险 | 高风险 | 低风险 | 低风险 | 低风险 |
| NeoAva Ⅱ期 | 低风险 | 低风险 | 高风险 | 风险未知 | 低风险 | 低风险 |
| CN-01026715 Ⅱ期 | 低风险 | 低风险 | 低风险 | 风险未知 | 低风险 | 低风险 |
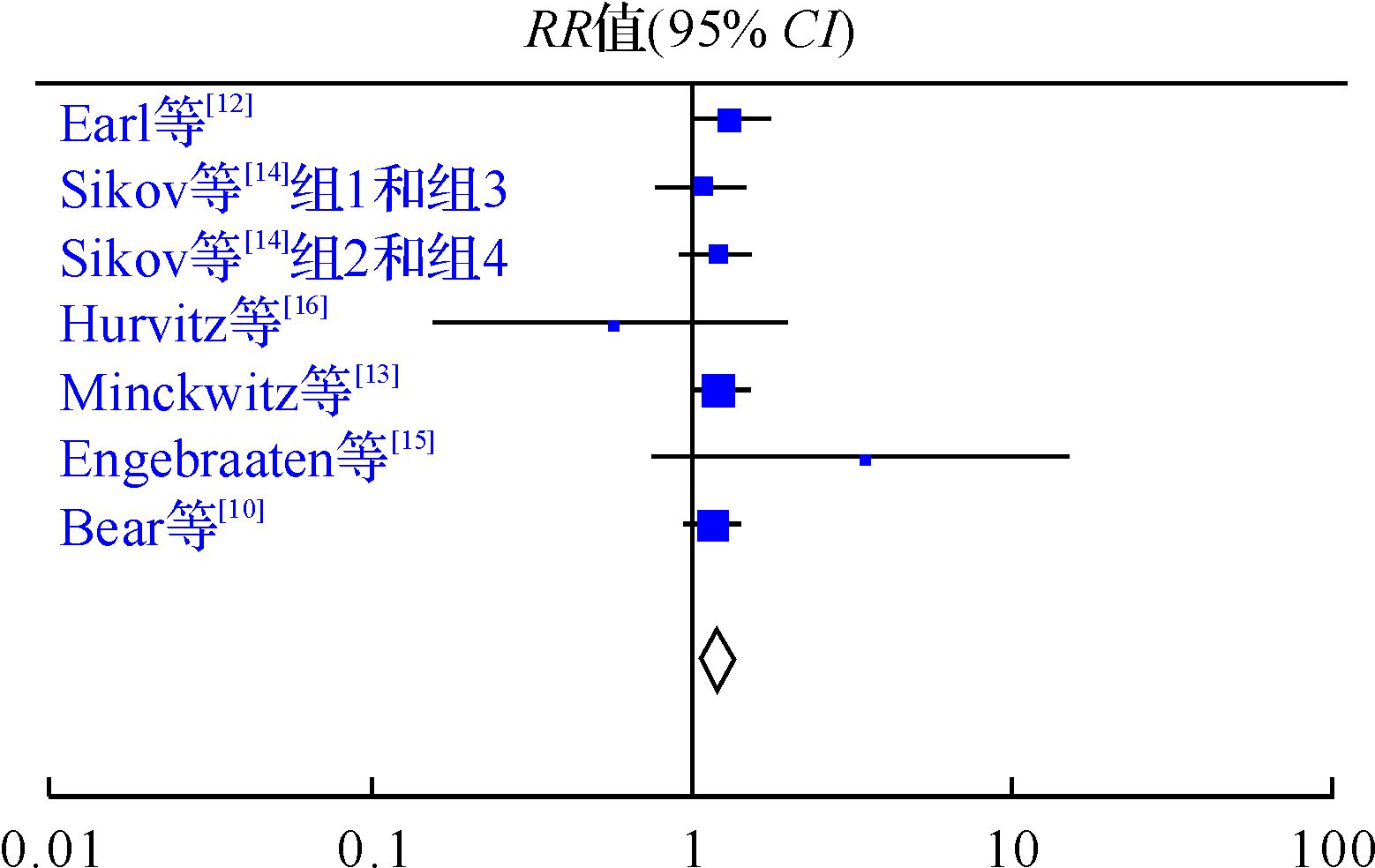
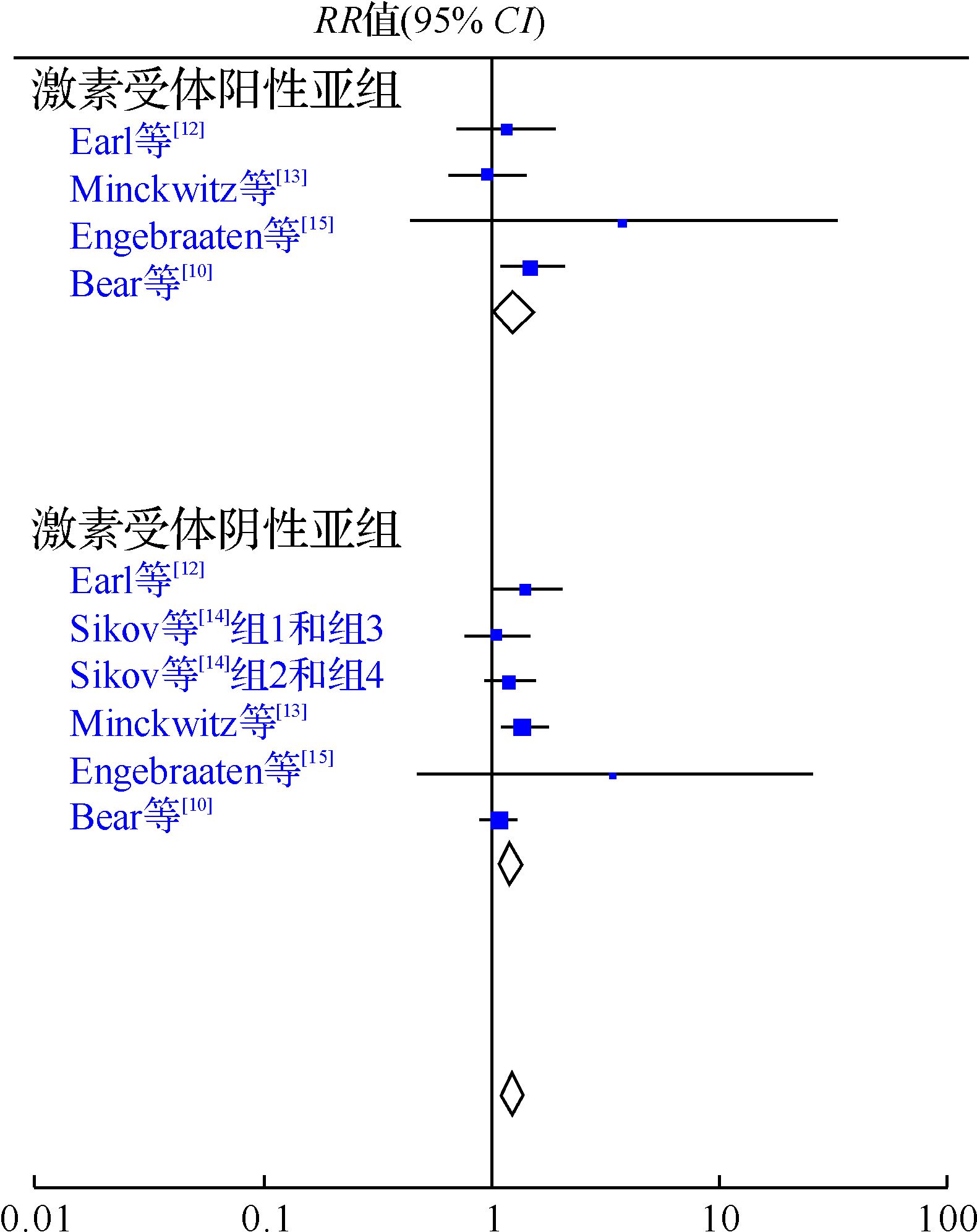
六项研究均以pCR作为主要研究终点,且异质性检验结果显示研究间差异无统计学意义(I2=0%,P=0.67),因此采用固定效应模型进行分析。研究结果显示,联合组的pCR率为24.7%(545/2204),化疗组的pCR率为20.1%(450/2236)。与化疗组比较,联合组的pCR率提高(RR=1.23,95%CI: 1.10~1.37,P<0.01),见图 1。亚组分析显示,联用贝伐珠单抗后,激素受体阳性患者pCR由10.2%(131/1281)提高到13.1%(169/1289)(RR=1.28,95%CI: 1.04~1.58,P<0.05);而激素受体阴性乳腺癌患者的pCR率也有提高(37.1%与46.3%,RR=1.25,95%CI: 1.12~1.39,P<0.01),见图 2。
|
| 图 1 新辅助化疗联合贝伐珠单抗与否治疗Her2阴性乳腺癌患者pCR率比较的meta分析 Fig. 1 Forest plot for the meta-analysis about the efficacy of neoadjuvant chemotherapy combined with bevacizumab versus neoadjuvant chemotherapy alone for Her2-negative breast cancer |
|
| 图 2 新辅助化疗联合贝伐珠单抗与否治疗Her2阴性而激素受体阳性或阴性乳腺癌患者pCR率比较的meta分析 Fig. 2 Forest plot for the subgroup analysis about the efficacy of neoadjuvant chemotherapy combined with bevacizumab versus neoadjuvant chemotherapy alone for Her2-negative breast cancer |
三~四级不良反应方面,联合组的不良反应发生率升高,如高血压(3.2%与0.6%,RR=5.292,95%CI:2.933~9.549,P<0.01)、黏膜炎(10.5%与2.0%,RR=5.340,95%CI:3.743~7.617,P<0.01),其他不良反应如中性粒细胞减少性发热、感染、手术并发症、中性粒细胞减少、手足综合征的发生率联合组也均高于化疗组(均P<0.05),而周围神经病变毒性反应两组间比较差异并无统计学意义(P>0.05),详见表 3。
| 不良反应 | 试验数 | 事件数/患者总数 | 危险比 | 95%可信区间 | P值 | |
| 联合组 | 化疗组 | |||||
| 三~四级高血压 | 4 | 68/2145 | 13/2170 | 5.292 | 2.933~9.549 | <0.01 |
| 三~四级黏膜炎 | 3 | 185/1761 | 35/1779 | 5.340 | 3.743~7.617 | <0.01 |
| 三~四级中性粒细胞减少 | 4 | 1170/2130 | 1110/2144 | 1.061 | 1.003~1.122 | 0.039 |
| 三~四级中性粒细胞减少性发热 | 3 | 225/1761 | 125/1779 | 1.818 | 1.476~2.240 | <0.01 |
| 三~四级感染 | 3 | 192/1930 | 116/1951 | 1.673 | 1.340~2.089 | <0.01 |
| 手术并发症 | 3 | 80/1019 | 40/977 | 1.918 | 1.326~2.774 | <0.01 |
| 三级手足综合征 | 2 | 117/1546 | 75/1561 | 1.575 | 1.189~2.087 | <0.01 |
| 三~四级周围神经病变 | 2 | 16/599 | 14/609 | 1.162 | 0.572~2.359 | 0.678 |
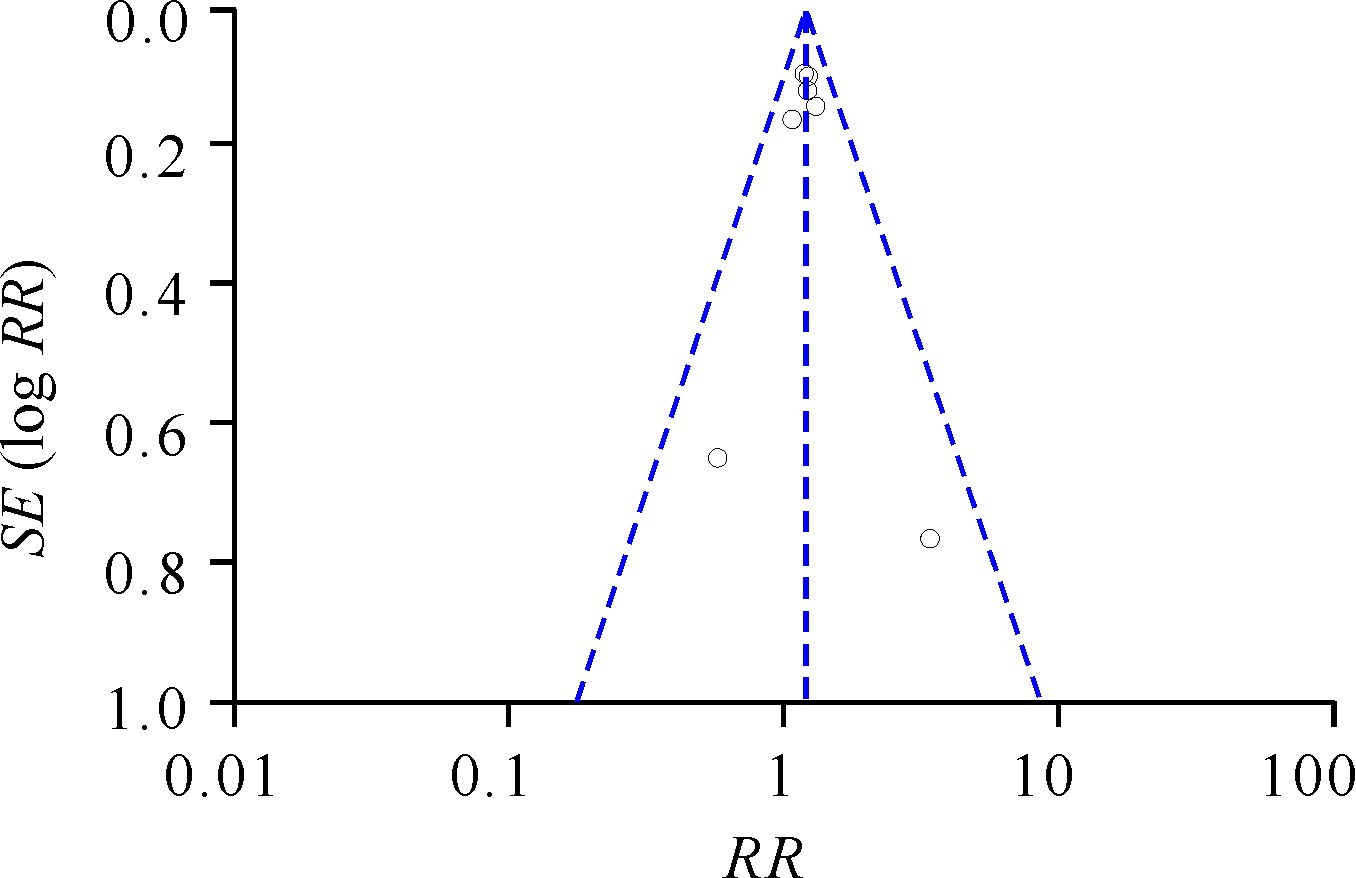
漏斗图分析结果(图 3)显示基本对称,可见本次meta分析的结果比较可靠。
|
| 图 3 meta分析漏斗图 Fig. 3 Funnel plot for evaluation of publication bias in the meta-analysis |
本研究系统地收集了Her2阴性乳腺癌患者新辅助化疗联合贝伐珠单抗靶向治疗的随机对照研究证据。研究结果显示,在新辅助化疗加入贝伐珠单抗后,患者的pCR率由20.1%(450/2236)提高到24.7%(545/2204);亚组分析中,激素受体阳性、Her2 阴性乳腺癌患者的pCR率由10.2%(131/1281)提高到13.1%(169/1289),激素受体阴性乳腺癌患者的pCR率也有明显提高(37.1%与46.3%)。Ⅲ~Ⅳ级不良反应中,联合组高血压、黏膜炎的发生率更高,其他的不良反应如中性粒细胞减少性发热、感染、手术并发症、中性粒细胞减少、手足综合征也增加,而另一常见的周围神经病变毒性反应两组比较差异并无统计学意义。这些证据均支持Her2阴性乳腺癌患者采用新辅助化疗联合贝伐珠单抗的治疗方式。
新辅助治疗的目的之一为使得原本无法切除的肿瘤获得切除的机会、降低局部晚期乳腺癌的分期、增加保乳手术的概率[1-2]。来自Mieog等[17]的系统评价结果显示,新辅助化疗使可手术乳腺癌患者的保乳手术率提高8%,且新辅助化疗后达到pCR患者的存活率、无病生存期明显优于达临床完全缓解和临床部分缓解的患者。一项meta分析也证实,在新辅助化疗中获得pCR是延长总生存期、无病生存期及无复发生存期的独立预后因素[6]。本文纳入的一项ARTemis[12]研究结果提示,与单纯多西他赛序贯FEC化疗比较,联合贝伐珠单抗后并未降低进行全乳腺切除术患者的比例(48%与51%)。然而,在获得pCR的患者中,行全乳腺切除手术患者的比例低于未获得pCR患者[42/146(29%)与335/618(54%)]。如患者达到pCR,或者即便乳腺残留有微小病灶,其进行全乳腺切除术的概率也小于那些既未获得pCR也并非微小残留病灶的患者[90/243(37%)与287/522 (55%)]。此外,新辅助治疗还可提示不同组织分型和病理状态的乳腺癌个体对化学药物治疗的敏感性和反应率,为术后治疗方案的选择提供参考。
已证实贝伐珠单抗在Her2阴性转移性乳腺癌患者中有良好的临床疗效[18]。一项多中心、随机、开放式试验E2100研究结果表明,在无化疗史的转移性Her2阴性乳腺癌患者中,贝伐珠单抗+紫杉醇治疗在无进展生存时间方面较紫杉醇单药治疗有5.5个月的优势。基于这一结果,美国食品药品监督管理局(FDA)曾批准贝伐珠单抗+紫杉醇作为无化疗史的转移性Her2阴性乳腺癌患者的治疗方案。但后续的AVADO[19]和RIBBON1[20]这两项安慰剂对照试验结果并未证实这类患者在无进展生存方面有治疗收益,且患者严重的Ⅲ~Ⅳ级不良事件增加。安全问题已成为限制贝伐珠单抗在转移性乳腺癌患者临床治疗中应用的原因之一。同样,在新辅助治疗方面,贝伐珠单抗联合化疗较单独的化疗方案增加Ⅲ~Ⅳ级不良事件的发生率,如与贝伐珠单抗相关的高血压、头痛和/或左心室收缩功能紊乱或使化疗药物毒性集聚,导致例如中性粒细胞减少及其引起的发热、黏膜炎、手足综合征或感染。上述大多类似的不良反应在以前的贝伐珠单抗试验中已有报道[17-19]。本文meta分析结果同样显示,贝伐珠单抗与新辅助化疗联合治疗后患者多种不良反应发生率升高,如高血压(3.2%与0.6%)、黏膜炎(10.5%与2.0%),其他不良反应如中性粒细胞减少性发热、感染、手术并发症、中性粒细胞减少、手足综合征的发生率也高于化疗组,因此,如何选择合适的治疗患者减少不良反应的发生是一个临床难点,治疗中应权衡利弊,以使患者获得最大效益。
值得注意的是,在两个试验NSABP B-40和GeparQuinto 的亚组分析中,联合治疗获益结果出现了分歧。NSABP B-40 研究[10]中贝伐珠单抗可提高激素受体阳性、Her2 阴性乳腺癌患者的pCR率,而GeparQuinto临床试验[12]加用贝伐珠单抗后pCR获益的主要人群为激素受体阴性乳腺癌患者,且这部分患者pCR的获益可转化为总生存率的获益。这种矛盾的结果可能提示激素受体不是贝伐珠单抗是否有效或Her2阴性患者是否能从新辅助化疗中收益的关键因素,或者需要更多高质量的临床试验及后续分析,进一步在治疗过程中或术后收集活组织切片或标本,为鉴定敏感性生物标志物提供帮助,从而最终能够筛选出那些可以从贝伐珠单抗中获益最大的患者。
当然,本文分析也有一定的局限性。首先,本文纳入的研究数量和病例数不够多。理论上部分阴性结果的小样本试验难以发表,故meta分析潜在的发表偏倚是不可完全避免的。漏斗图检测结果显示,本研究虽然只纳入6篇文献,但并不存在明显的发表偏倚。及时纳入将来发表的相关文献进行数据更新,是纠正潜在的发表偏倚并得到更加可信结果的有效途径。其次,由于无法完全得到纳入研究中的总存活率方面的数据,本文尚无法有效评价pCR更高组的患者是否有更长的生存期,尽管CTNeoBC meta分析[21]结果显示pCR是乳腺癌个体患者在新辅助治疗后有生存获益的阳性预测因子,但pCR获益幅度不能预测长期临床获益,且侵袭性乳腺癌亚型患者pCR与长期生存的相关性较大。因此还需要更多的时间来明确不同类型的乳腺癌患者中pCR是否可以转化为总存活率的提升。
总而言之,本研究显示了在Her2阴性乳腺癌患者的新辅助治疗中采用化疗联合贝伐珠单抗靶向治疗可显著增加患者pCR率,但这种联合也增加了相关不良反应的发生率。这些在新辅助治疗中因为贝伐珠单抗使用增加引起的不良反应,仍有必要进一步观察及随访。而靶向药物联合化疗在Her2阴性乳腺癌新辅助治疗中的pCR优势能否带来患者无瘤生存期或总生存期的延长,也仍有待进一步验证。
| [1] | FISHER B, BROWN A, MAMOUNAS E, et al. Effect of preoperative chemotherapy on local-regional disease in women with operable breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-18[J]. J Clin Oncol, 1997, 15 (7) :2483–2493. |
| [2] | FISHER B, BRYANT J, WOLMARK N, et al. Effect of preoperative chemotherapy on the outcome of women with operable breast cancer[J]. J Clin Oncol, 1998, 16 (8) :2672–2685. |
| [3] | GIANNI L, BASELGA J, EIERMANN W, et al. PhaseⅢtrial evaluating the addition of paclitaxel to doxorubicin followed by cyclophosphamide, methotrexate, and fluorouracil, as adjuvant or primary systemic therapy: European Cooperative Trial in Operable Breast Cancer[J]. J Clin Oncol, 2009, 27 (15) :2474–2481. doi:10.1200/JCO.2008.19.2567 |
| [4] | HUNT K K, YI M, MITTENDORF E A, et al. Sentinel lymph node surgery after neoadjuvant chemotherapy is accurate and reduces the need for axillary dissection in breast cancer patients[J]. Ann Surg, 2009, 250 (4) :558–566. |
| [5] | BEAR H D, ANDERSON S, SMITH R E, et al. Sequential preoperative or postoperative docetaxel added to preoperative doxorubicin plus cyclophosphamide for operable breast cancer: National Surgical Adjuvant Breast and Bowel Project Protocol B-27[J]. J Clin Oncol, 2006, 24 (13) :2019–2027. doi:10.1200/JCO.2005.04.1665 |
| [6] | LIEDTKE C, MAZOUNI C, HESS K R, et al. Response to neoadjuvant therapy and longterm survival in patients with triple-negative breast cancer[J]. J Clin Oncol, 2008, 26 (8) :1275–1281. doi:10.1200/JCO.2007.14.4147 |
| [7] | KONG X, MORAN M S, ZHANG N, et al. Meta-analysis confirms achieving pathological complete response after neoadjuvant chemotherapy predicts favourable prognosis for breast cancer patients[J]. Eur J Cancer, 2011, 47 (14) :2084–2090. doi:10.1016/j.ejca.2011.06.014 |
| [8] | VON MINCKWITZ G, KVMMEL S, VOGEL P, et al. Neoadjuvant vinorelbine-capecitabine versus docetaxel-doxorubicin-cyclophosphamide in early nonresponsive breast cancer: phaseⅢrandomized GeparTrio trial[J]. J Natl Cancer Inst, 2008, 100 (8) :542–551. doi:10.1093/jnci/djn085 |
| [9] | MILLER K, WANG M, GRALOW J, et al. Paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breast cancer[J]. N Engl J Med, 2007, 357 (26) :2666–2676. doi:10.1056/NEJMoa072113 |
| [10] | BEAR H D, TAILG G, RASTOGI P, et al. Bevacizumab added to neoadjuvant chemotherapy for breast cancer[J]. N Engl J Med, 2012, 366 (4) :310–320. doi:10.1056/NEJMoa1111097 |
| [11] | HIGGINS J P, ALTMAN D G, GOTZSCHE P C, et al. The Cochrane Collaboration's tool for assessing risk of bias in randomized trials[J]. BMJ, 2011, 343 :d5928. doi:10.1136/bmj.d5928 |
| [12] | EARL H M, HILLER L, DUNN J A, et al. Efficacy of neoadjuvant bevacizumab added to docetaxel followed by fluorouracil, epirubicin, and cyclophosphamide, for women with HER2-negative early breast cancer(ARTemis): an open-label, randomised, phase 3 trial[J]. Lancet Oncol, 2015, 16 (6) :656–666. doi:10.1016/S1470-2045(15)70137-3 |
| [13] | VON MINCKWITZ G, EIDTMANN H, REZAI M, et al. Neoadjuvant chemotherapy and bevacizumab for HER2-negative breast cancer[J]. N Engl J Med, 2012, 366 (4) :299–309. doi:10.1056/NEJMoa1111065 |
| [14] | SIKOV W M, BERRY D A, PEROU C M, et al. Impact of the addition of carboplatin and/or bevacizumab to neoadjuvant once-per-week paclitaxel followed by dose-dense doxorubicin and cyclophosphamide on pathologic complete response rates in stageⅡtoⅢtriple-negative breast cancer: CALGB 40603(Alliance)[J]. J Clin Oncol, 2015, 33 (11) :13–21. |
| [15] | ENGEBRAATEN O, VASKE C, KROHN M, et al. Molecular response in breast cancer tumors treated with neoadjuvant chemotherapy with and without bevacizumab: results from NeoAva-A randomized phaseⅡstudy[J]. Cancer Res, 2013, 73 . |
| [16] | HURVITZ S A, HEGDE P, BOSSERMAN L, et al. Molecular changes in breast tumors following bevacizumab-based treatment: final analysis of a randomized neoadjuvant study of bevacizumab or placebo, followed by chemotherapy with or without bevacizumab, in patients with stageⅡorⅢbreast cancer[J]. Cancer Res, 2012, 72 . |
| [17] | MIEOG J S, VAN DER HAGE J A, VAN DE VELDE C J. Preoperative chemotherapy for women with operable breast cancer[J]. Cochrane Database Syst Rev, 2007, 18 (2) :CD005002. |
| [18] | MILLER K, WANG M, GRALOW J, et al. Paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breast cancer[J]. N Engl J Med, 2007, 357 (26) :2666–2676. doi:10.1056/NEJMoa072113 |
| [19] | MILES D W, CHAN A, DIRIX L Y, et al. PhaseⅢstudy of bevacizumab plus docetaxel compared with placebo plus docetaxel for the firstline treatment of human epidermal growth factor receptor 2-negative metastatic breast cancer[J]. J Clin Oncol, 2010, 28 (20) :3239–3247. doi:10.1200/JCO.2008.21.6457 |
| [20] | ROBERT N J, DIÉRAS V, GLASPY J, et al. RIBBON-1: randomized, double-blind, placebo-controlled, phaseⅢtrial of chemotherapy with or without bevacizumab for first-line treatment of human epidermal growth factor receptor 2-negative, locally recurrent or metastatic breast cancer[J]. J Clin Oncol, 2011, 29 (10) :1252–1260. doi:10.1200/JCO.2010.28.0982 |
| [21] | CORTAZAR P, ZHANG L, UNTCH M, et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis[J]. Lancet, 2014, 384 (9938) :164–172. doi:10.1016/S0140-6736(13)62422-8 |




