2. 宜康(杭州)生物技术有限公司, 浙江 杭州 310015
2. Abcam(Hangzhou)Biotechnology Co. Ltd., Hangzhou 310015, China
环鸟苷酸(guanosine 3′,5′-cyclic monophosphate,cGMP)和环腺苷酸(adenosine 3′,5′-cyclic monophosphate,cAMP)是细胞内的第二信使,广泛存在于原核生物和真核生物[1]。两者具有相反的生理效应,前者促进细胞分裂,抑制细胞分化;后者则促进分化,抑制分裂[2]。cGMP有两种作用方式,一是直接作用,cGMP及其同系物可以作为离子通道的配体直接参与细胞功能的调控 [3];另一种是间接作用,是cGMP作用的主要方式,通过激活cGMP依赖性蛋白激酶G而发挥作用[4],对细胞内多种代谢途径产生影响。cGMP可以降低心肌代谢、收缩力和功能[5],参与干细胞的增殖与分化[6],还具有抑制糖异生以及兴奋副交感神经的功能。cGMP对视觉信号传导 [7]、平滑肌和骨骼肌[8, 9]、神经系统功能 [10]、血小板活化、骨生长[11]等的调节有非常重要的作用。
作为反映疾病发病机制的一项常用检测指标,cGMP在临床和基础研究中具有重要价值,其检测结果准确与否将影响研究的质量。20世纪70~80年代,竞争性蛋白质结合分析法[12]和放射性免疫分析法[13]是检测cGMP的主要方式。但由于放射性免疫分析法对人体有潜在危害,目前已逐步被以多克隆抗体或鼠单克隆抗体为关键试剂的酶标记法和荧光ELISA法取代。然而,多克隆抗体制备的ELISA试剂盒具有批次间差异大和特异性差的问题,鼠单克隆抗体制备的ELISA试剂盒虽无上述缺点,但不同cGMP浓度间的吸光度值相差非常小,使用者难以得到可重复的检测数据。兔单克隆抗体由改进的兔骨髓瘤细胞和脾细胞融合而成的杂交瘤细胞株产生,是Epitomics公司独家拥有的专利技术,具有更高的抗体特性。本研究拟在制备高质量兔抗cGMP单克隆抗体基础上,建立cGMP竞争ELISA方法,以期提高cGMP检测方法的准确性。
1 材料与方法 1.1 材料和设备cGMP、cAMP、环磷酸肌苷(cIMP)、环单磷酸胞苷(cCMP)、单磷酸腺苷(AMP)、腺苷-5′-二磷酸(ADP)、腺苷-5′-三磷酸 (ATP)、鸟苷-5′-单磷酸(GMP)、鸟苷-5′-二磷酸 (GDP)、鸟苷-5′-三磷酸(GTP)均购自美国Sigma-Aldrich公司;钥孔血蓝蛋白(KLH)、碳二亚胺(DEC)、3-(2-吡啶二巯基)丙酸N-羟基琥珀酰亚胺酯(SPDP)、4-(N-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(Sulfo-SMCC)购自美国Thermo Fisher Scientific公司;辣根过氧化物酶(HRP)标记的羊抗兔IgG-Fc购自美国Jackson ImmunoResearch公司;HRP购自上海国源生物公司;Jurkat细胞(人外周血白血病T细胞)和Hela细胞(宫颈癌细胞)购自中国科学院上海生命科学研究院细胞资源中心;HepG2细胞(人肝癌细胞)购自中国典型培养物保藏中心(武汉大学);Raji细胞(伯基特淋巴瘤)来自英国Abcam公司; cGMP ELISA鼠单克隆抗体试剂盒购自美国NewEast Biosciences公司。主要的设备为酶标仪(Model 680,美国Bio-Rad公司);洗板机(ELx50,美国伯腾仪器有限公司)。
1.2 制备并鉴定免疫抗原分别采用DEC、SMCC和SPDP三种方法制备免疫抗原,按照Thermo Fisher的操作说明书将cGMP偶联到KLH。偶联结束后,将其置于4 ℃冰箱,用0.01 mol/L的PBS(pH值7.2)连续透析24 h,期间多次换液。透析后将cGMP浓度调整至免疫浓度,分装并于-20 ℃保存。
由于KLH的分子量较大,所以采用间接ELISA法鉴定交联效果。将3种方法交联完成的cGMP-KLH分别用pH 9.6的碳酸盐缓冲液稀释后包被酶标板,采用购买的商品化cGMP鼠单克隆抗体来鉴定免疫抗原的交联效果。间接ELISA操作程序参照Tijssen的方法[14]。
1.3 制备cGMP兔单克隆抗体和测定抗体效价将上述交联效果最好的cGMP-KLH免疫新西兰大白兔,应用Epitomics公司的兔单克隆抗体技术制备针对cGMP的兔单克隆抗体。采用间接ELISA方法测定cGMP兔单克隆抗体的效价。
1.4 确定cGMP兔单克隆抗体与cGMP-HRP最佳工作浓度采用1.2中交联效果最好的方法来制备得到cGMP-HRP,并加入50%甘油于-20 ℃保存。采用方阵法确定cGMP兔单克隆抗体与cGMP-HRP的最佳工作浓度。其简要的步骤为:用2 μg/mL羊抗兔IgG包板,孵育;采用洗板机洗板并封闭后,将cGMP-HRP按照1∶50、1∶100、1∶200稀释,cGMP兔单克隆抗体稀释为0.2 μg/mL、0.1 μg/mL、0.05 μg/mL及0 μg/mL,并将稀释好cGMP兔单克隆抗体和cGMP-HRP各取25 μL加到酶标板,孵育;清洗并加入酶底物;加入终止液并用酶标仪读取450 nm波长吸光度值。根据实验结果优化并建立cGMP的竞争ELISA方法。
1.5 检测cGMP兔单克隆抗体特异性将cGMP、cAMP、cIMP、cCMP、AMP、ADP、ATP、GMP、GDP、GTP做系列稀释,采用优化好的竞争ELISA法检测cGMP 兔单克隆抗体与cGMP以及cGMP结构类似物的交叉反应率,以50%抑制浓度(IC50)计算。交叉反应率=(cGMP IC50/各结构类似物IC50)×100%,并因此判定cGMP 兔单克隆抗体的特异性。
1.6 建立cGMP竞争ELISA方法 1.6.1 标准曲线的建立在上述最佳条件下,将cGMP标准品稀释成125.0、62.5、31.2、15.6、7.8、3.9、1.9、0 ng/mL系列质量浓度。采用优化好的竞争ELISA方法,用酶标仪测定波长为450 nm的吸光度值,并记录结果。计算各质量浓度所对应的抑制率=B/B0×100%(B是不同浓度的cGMP吸光度值,B0是cGMP为0 ng/mL的吸光度值),以cGMP标准品浓度为横坐标、抑制率为纵坐标绘制曲线,并按照王自良等[15]竞争ELISA灵敏度为B/B0=83%的抗原浓度作为其最低检测限。
1.6.2 检测回收率在标准曲线范围选择添加浓度。将cGMP用人血清稀释3个浓度梯度,使其终质量浓度分别为5、15、60 ng/mL,每个浓度设8个重复,用已优化的竞争ELISA方法重复测定3次。根据标准曲线查对应的cGMP浓度,按照张书杰等[16]方法计算回收率,回收率(%)=实测浓度/添加浓度×100%。
1.6.3 验证精密度取不同包被批次的20批包被板,分别测定在标准曲线范围内的3个质量浓度(5、15、60 ng/mL)的添加样,每个浓度设3个重复,计算批次内和批次间的变异系数。
1.7 cGMP兔单克隆抗体竞争ELISA方法用于样本分析将Jurkat细胞、Hela细胞、HepG 2细胞和Raji细胞培养到对数生长期,按照Abcam公司的免疫沉淀法裂解液制备方法制备这4种细胞的裂解液。分别用cGMP兔单克隆抗体以及cGMP鼠单克隆抗体试剂盒检测这4个细胞裂解液中cGMP的含量。
2 结 果 2.1 免疫抗原鉴定结果由图 1可见,以SMCC交联的cGMP-KLH在以1.0 μg/mL和0.1 μg/mL包被酶标板时,能被cGMP鼠单克隆抗体识别,且波长为450 nm的吸光度值均超过1.5,证明该方法的偶联是成功的。SPDP法制备的cGMP-KLH在1 μg/mL包被酶标板时,结果与SMCC法相近,但0.1 μg/mL包被时,所检测的吸光度值下降至0.5。因此选择SMCC法交联的cGMP-KLH作为免疫抗原进一步免疫新西兰大白兔。

|
| 图 1 间接ELISA法鉴定合成的cGMP-KLH Fig.1 The synthetic antigens determined by indirect ELISA |
由图 2可见,该cGMP兔单克隆抗体在抗体稀释至3.1 ng/mL时,仍能得到很高的吸光度值,其对应的信号值是阴性孔的5.6倍。说明抗cGMP兔单克隆抗体具有较高的效价。
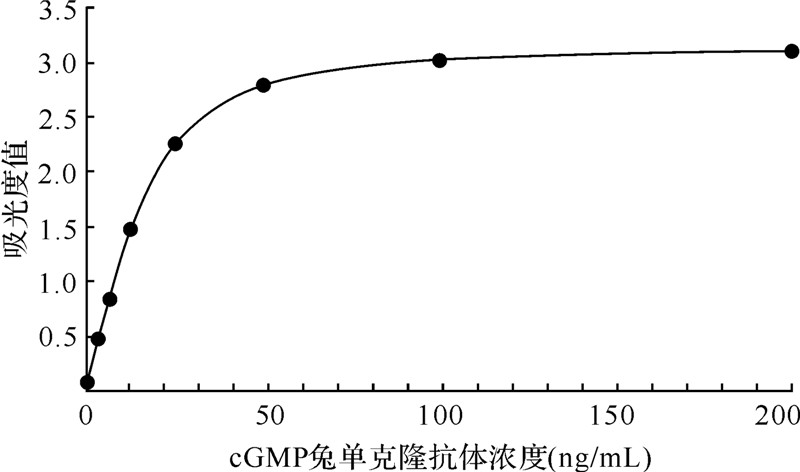
|
| 图 2 间接ELISA法测定cGMP兔单克隆抗体的效价 Fig.2 The cGMP RabMab titer determined by indirect ELISA |
方阵实验结果确定cGMP兔单克隆抗体最佳工作浓度为0.2 μg/mL;cGMP-HRP的最佳工作浓度为1∶100稀释。
2.4 cGMP兔单克隆抗体特异性由表 1 可知,cGMP兔单克隆抗体的IC50为12.57 ng/mL,与cIMP的交叉反应率为33.1%,与其他结构类似物的交叉反应率均小于1.2%。说明cGMP兔单克隆抗体具有很高的特异性。
| 化合物名称 | IC50(ng/mL) | 交叉反应率(%) | |
| cGMP | 12.57 | 100 | |
| cIMP | 37.98 | 33.1 | |
| GTP | >1000 | <1.2 | |
| GMP | >1000 | <1.2 | |
| GDP | >1000 | <1.2 | |
| AMP | >1000 | <1.2 | |
| cAMP | >1000 | <1.2 | |
| ADP | >1000 | <1.2 | |
| ATP | >1000 | <1.2 | |
| cCMP | >1000 | <1.2 | |
在优化的条件下建立了cGMP检测标准曲线(图 3)。该方法的检 测范围为0~120 ng/mL,IC50为12.57 ng/mL,最低检测限为1.95 ng/mL。
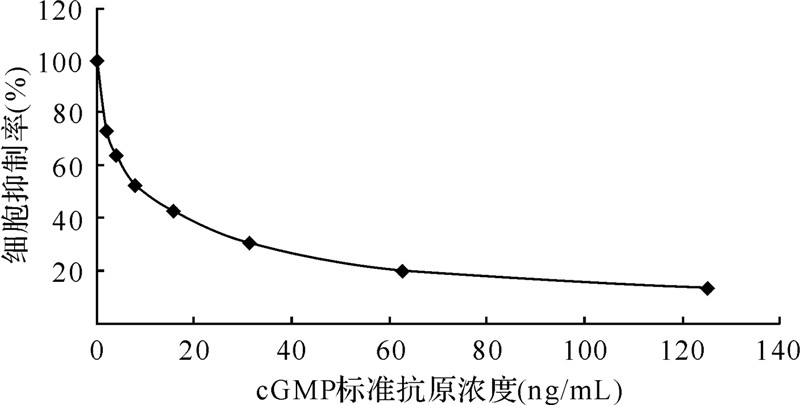
|
| 图 3 cGMP 标准曲线 Fig.3 Calibration curve of cGMP |
由表 2可见,以5、15、 60 ng/mL添加浓度测得的回收率为89%~103%(平均93.7%),变异系数为6.8%~13.8%(平均9.4%),符合准确度的测定标准。
添加浓度 (ng/mL) | 实测浓度 (ng/mL) | 回收率 (%) | 变异系数 (%) |
| 5.00 | 5.15 | 103 | 13.80 |
| 15.00 | 13.34 | 89 | 6.80 |
| 60.00 | 53.11 | 89 | 7.50 |
由表 3、4可知,该方法的批次内变异系数和批次间变异系数均小于15%,表明该方法有较高的精密度,批次内和批次间差异符合要求。
| cGMP质量浓度(ng/mL) | 实测浓度(ng/mL) | 变异系数(%) |
| 5 | 6.42±0.75 | 11.68 |
| 15 | 17.5±0.93 | 5.29 |
| 60 | 63.77±6.65 | 10.42 |
| cGMP质量浓度(ng/mL) | 实测浓度(ng/mL) | 变异系数(%) |
| 5 | 6.05±0.84 | 13.85 |
| 15 | 14.62±1.93 | 13.22 |
| 60 | 59.92±6.79 | 11.33 |
采用cGMP兔单克隆抗体竞争ELISA方法与cGMP鼠单克隆抗体试剂盒检测细胞裂解中的cGMP含量见表 5。经商品化cGMP鼠单克隆抗体试剂盒检测验证,cGMP兔单克隆抗体竞争ELISA的检测结果与cGMP鼠单克隆抗体试剂盒法相比,两种方法的检测结果基本一致。这说明应用cGMP兔单克隆抗体建立的竞争ELISA方法能准确检测样本中的cGMP含量。
| (ng/mL) | ||
| 细胞裂解液 | 兔单克隆抗体 | 鼠单克隆抗体试剂盒 |
| —:测不出 | ||
| Jurkat细胞 | 33 | 38 |
| Hela细胞 | — | — |
| HepG-2细胞 | 50 | 40 |
| Raji细胞 | 3.5 | 3.1 |
目前,ELISA方法广泛应用于cGMP的检测分析。在建立ELISA方法的过程中,抗原质量的好坏直接影响着抗体的质量及该方法的灵敏度和特异性等。cGMP由于分子量小,自身没有免疫原性,因此需要与大分子蛋白质结合,形成具备免疫原性的抗原,才能获得抗cGMP的兔单克隆抗体,从而建立竞争ELISA方法。利用3种不同原理的交联方式进行交联,最终确认用SMCC的偶联效果最好。而EDC方法交联效果欠佳可能与EDC是双功能基团导致特异性不理想有关。SPDP法则介于两者之间。
兔单克隆抗体由于具有亲和力高、特异性高、识别表位多的特点,已广泛运用于生命科学研究的各个领域[17]以及抗体药物的开发,其在蛋白质修饰、免疫组织化学染色以及小分子农药残留检测[18]方面具有独特优势。与兔同源性超过95%以上的抗原将很难获得针对该抗原的兔单克隆抗体,这个缺点与不能制备与鼠同源性高的抗原的鼠单克隆抗体是一致的。
利用成功偶联的cGMP-KLH以及Epitomics的兔单克隆抗体开发技术,得到cGMP 兔单克隆抗体。该抗体具有效价高和亲和性较好的特点,与cAMP、cCMP、GMP、GDP、AMP等结构类似物均无交叉反应性。通过优化工作浓度,建立cGMP竞争ELISA检测方法,其检测范围为0~120 ng/mL,IC50为12.57 ng/mL,检测限为1.95 ng/mL,通过添加回收实验测得回收率在89%~103%,批次内和批次间的变异系数均低于15%。本研究建立的cGMP检测方法特异度高,重复性好,可直接检测cGMP的浓度,但检测灵敏度稍差,在后续试验中将结合荧光素法,进一步提高该方法的检测灵敏度,为cGMP的各种研究奠定基础。
| [1] | RUSSELL P N, CHRISTOPHER J S. Cyclic nucleotides [J]. Phytochemistry, 2004,65(17):2423-2437. |
| [2] | 堐榜琴,张建国. 关于cGMP和cAMP与细胞分裂、分化及癌变关系的研究[J]. 中国组织化学与细胞化学杂志,2011,20(1):98-99. YA Bang-qin, ZHANG Jian-guo. Study on the relationship between cGMP, cAMP and cell division, differentiation and carcinogenesis [J]. Chinese Journal of Histochemistry and Cytochemistry,2011,20(1):98-99. (in Chinese) |
| [3] | NIE H G, ZHANG W, HAN D Y, et al. 8-pCPT-cGMP stimulates alphabetagamma-ENaC activity in oocytes as an external ligand requiring specific nucleotide moieties[J]. Am J Physiol Renal Physiol, 2010,298(2):F323-F334. |
| [4] | 高建林,李青南. 第二信使cAMP、cGMP信号通路调节骨形成的研究进展[J]. 中国药理学通报, 2010,26(12):1545-1549. GAO Jian-lin, LI Qing-nan. Regulation of bone formation via cAMP, cGMP signaling pathways [J]. Chinese Pharmacological Bulletin, 2010,26(12):1545-1549. (in Chinese) |
| [5] | MOALEM J, WEISS H R, DAVIDOV T, et al. Heart failure reduces both the effects and interaction between cyclic GMP and cyclic AMP [J]. J Surg Res, 2006,134(2):300-306. |
| [6] | KALPANA M, JOSHUA S K, FERID M. Nitric oxide-cyclic GMP signaling in stem cell differentiation [J]. Free Radic Biol Med, 2011,51(12):2150-2157. |
| [7] | 糜漫天,朱俊东,韦 娜,等. 牛磺酸及微量营养素对大鼠视网膜NOS表达及cGMP含量影响的研究[J]. 中国应用生理学杂志, 2000,16(4):343-346. MI Man-tian, ZHU Jun-dong, WEI Na, et al. Influences of taurine and micronutrients on nitric oxide synthase expression and cGMP content in rat retina [J]. Chinese Journal of Applied Physiology, 2000,16(4):343-346. (in Chinese) |
| [8] | 王海华,闵志雪,戚仁斌,等. iNOS-GC-cGMP信号活化参与了内毒素血症大鼠血管低反应性的发生机制[J]. 中国病理生理杂志, 2012,28(6):1076-1081. WANG Hai-hua, MIN Zhi-xue, QI Ren-bin, et al. iNOS-GC-cGMP signaling activation might be involved in vascular hyporeactivity in endotoxemic rats [J]. Chinese Journal of Pathophysiology, 2012,28(6):1076-1081. (in Chinese) |
| [9] | EARL W G, RUSSELL C S. Nitric oxide and cyclic GMP regulate early events in agrin signaling in skeletal muscle cells [J]. Exp Cell Res, 2010,316(12):1935-1945. |
| [10] | WANG X, ROBINSON P J. Cyclic GMP-dependent protein kinase and cellular signaling in the nervous system [J]. J Neurochem, 1997,68(2):443-456. |
| [11] | 苑晓烨,曾 强,李绍冰,等. NO/cGMP/PKG信号通路与血管钙化的关系[J]. 临床荟萃, 2010,25(22):2023-2025. YUAN Xiao-hua, ZENG Qiang, LI Shao-bing, et al. The relationship between NO/cGMP/PKG pathway and vascular calcification [J]. Clinical Focus, 2010,25(22):2023-2025. (in Chinese) |
| [12] | HONMA M, SATOH T, TAKEZAWA J, et al. An ultrasensitive method for the simultaneous determination of cyclic AMP and cyclic GMP in small-volume samples from blood and tissue [J]. Biochem Med, 1977,18(3):257-273. |
| [13] | GOLDBERG M L. Radioimmunoassay for adenosine 3', 5'-cyclic monophosphate and guanosine 3', 5'-cyclic monophosphate in human blood, urine, and cerebrospinal fluid [J]. Clin Chem, 1977,23(3): 576-580. |
| [14] | TIJSSEN P. Practice and theory of enzyme immunoassay [M]. Amsterdam: Elsever, 1985:173-210. |
| [15] | 王自良,王建娜,张海棠,等. 苯巴比妥单克隆抗体的研制及竞争ELISA血药浓度监测方法的建立[J]. 中国药学杂志, 2006,41(23):1826-1830. WANG Zi-liang, WANG Jian-na, ZHANG Hai-tang, et al. Development of monoclonal antibodies against phenobarbital and monitor of phenobarbital concentration in serum by competitive ELISA [J]. Chinese Pharmaceutical Journal, 2006,41(23):1826-1830. (in Chinese) |
| [16] | 张书杰,雷雅静,徐晓倩,等. 沙丁胺醇多克隆抗体的制备及间接ELISA方法的建立[J]. 浙江大学学报(医学版), 2013,42(1):19-24. ZHANG Shu-jie, LEI Ya-jing, XU Xiao-qian, et al. Preparation of salbutamol polyclonal antibodies and development of indirect competitive enzyme-linked immunoassay [J]. Journal of Zhejiang University(Medical Sciences), 2013,42(1):19-24. (in Chinese) |
| [17] | 李婷婷,崔慧斐. 兔单克隆抗体的发展及应用前景[J]. 食品与药品,2012,14(9):373-376. LI Ting-ting, CUI Hui-fei. Development and application prospects of rabbit monoclonal antibody [J]. Food and Drug, 2012,14(9):373-376. (in Chinese) |
| [18] | 张建群,杨 扬,王艺熹,等. β-肾上腺素受体激动剂莱克多巴胺兔单克隆抗体的制备[J]. 农业生物技术学报,2007,15(3):398-403. ZHANG Jian-qun, YANG Yang, WANG Yi-xi, et al. Production of a rabbit monoclonal antibody for β-adrenergic agonist ractopamine detection [J]. Journal of Agricultural Biotechnology, 2007,15(3):398-403. (in Chinese) |




