2. 浙江大学医用高分子材料研究所, 浙江 杭州 310031
2. Institute of Biomedical Polymers, Zhejiang University, Hangzhou 310031, China
临床上很多患者由于创伤、肿瘤、炎症等因素影响造成不同程度的骨组织缺损。自体骨和异体异种骨是临床上常用的骨修复材料。自体骨移植是公认的骨缺损修复的金标准,但可供骨源有限,且骨获取时可能会造成供区软硬组织缺损甚至邻近重要结构损伤。而异体骨和异种骨移植存在免疫排斥反应的可能,也有获得性病毒或细菌感染的风险。因此,有必要研发出理想的人工骨修复材料,最终取代自体骨和异体异种骨移植。
磷酸钙骨水泥(calcium phosphate cement,CPC)作为骨修复材料具有良好的骨传导性、生物相容性和可塑性,具可降解等优点,已被应用于临床骨缺损的修复治疗[1, 2, 3]。但是CPC材料的微孔孔隙率低且孔径小(数十微米),不利于血管和新骨长入。CPC降解非常缓慢,而这也影响所负载的药物或生长因子的释放[4, 5]。有研究采用添加造孔剂、发泡、有机泡沫浸渍、颗粒沥滤等以提高CPC的孔隙率和形成大孔径[6, 7]。明胶是一种天然的高分子聚合物,具有良好的生物相容性,能在体内较快降解,降解后局部仅形成微酸环境,不会影响成骨。以明胶复合CPC较单纯的CPC材料有更高的孔隙率和孔径,有利于新骨形成。尽管目前主流意见认为材料孔径在50~500 μm有利于材料的成骨化及血管生成[8, 9, 10, 11],但尚未进一步优化明胶颗粒(gelatin particle,GP)粒径范围,亦不清楚何种GP配比所制备的GP/CPC材料更有利于新骨形成。本文就此探讨和比较了以不同粒径的GP按不同配比制备的GP/CPC复合材料的理化特性和其在修复兔临界颅骨缺损时的效果。
1 材料与方法 1.1 实验动物、主要试剂及仪器24周龄健康新西兰大白兔14只(体质量2.5~3.0 kg)来自浙江大学实验动物中心。主要试剂有GP(Type B,美国Sigma公司)、CPC粉剂和CPC固化液(上海瑞邦生物材料有限公司)、DMEM 培养基和胎牛血清(美国Gibco公司)、原代兔骨髓基质干细胞[赛业(广州)生物科技有限公司]。主要仪器有全自动样品快速研磨仪(Tissuelyser-24,上海净信实业发展有限公司)、万能力学测试机(Instron 5543A,英斯特朗公司)、扫描电镜(KYKY-EM3200,北京中科科仪股份有限公司)、切片机(LEICA RM2235,德国徕卡仪器公司)等。
1.2 不同粒径的GP和不同GP质量占比的GP/CPC复合材料的制备本研究采用不同粒径的GP以不同质量占比与CPC复合,制备4组GP/CPC复合人工骨材料,分别为:A组(GP粒径200~300 μm,质量占比10%);B组(GP粒径200~300 μm,质量占比5%);C组(GP粒径100~200 μm,质量占比10%);D组(GP粒径100~200 μm,质量占比5%)。
首先采用全自动快速研磨仪将大颗粒明胶碾碎,通过标准分样筛选出粒径范围为100~200 μm和200~300 μm的两组GP,并经低温冻干24 h,紫外线照射后于4 ℃保存备用。两组GP经真空喷金后于扫描电镜下观察并随机选取20个样本测量粒径,结果取平均值。按各组要求将GP与CPC粉末充分混合后加入CPC固化液搅拌得到4组GP/CPC复合材料糊剂,用于充填兔颅骨缺损。另外,糊剂注入直径10 mm、高10 mm的玻璃圆柱体模具,固化后脱模制成圆柱形GP/CPC复合材料试件,用来检测材料的理化和生物学特性。
1.3 GP/CPC复合材料理化特性检测 1.3.1 孔隙率测定测4组GP/CPC复合材料各取10个试件,并以纯CPC试件作为对照,测定试件经体外浸泡1周后的孔隙率:将初始体积为V0的试件置于37 ℃磷酸盐缓冲液(PBS)中水浴1周,取出后冻干24 h,称量干燥的试件质量(M1);再将试件浸泡于无水乙醇中24 h,取出后即刻称量含有无水乙醇的试件质量(M2)。按如下公式计算经PBS浸泡1周后复合材料试件的孔隙率(P):P=[(M2-M1)/ρ]/V0×100%. 其中ρ为37 ℃时无水乙醇的密度。
1.3.2 GP/CPC复合材料表面超微结构观察4组GP/CPC复合材料浸泡于PBS中1周,彻底干燥后真空喷金,置于扫描电镜下观察各组复合材料的表面微观形态。
1.3.3 抗压强度测定4组GP/CPC复合材料各取10个试件,应用万能力学测试机测定试件的弹性模量表示抗压强度,测定时设定加载速度为0.5 mm/min。
1.4 GP/CPC复合材料体外生物相容性检测A、B、C、D 4组GP/CPC复合材料试件各浸泡于10 mL含10%胎牛血清的DMEM培养液中,24 h后收集4组浸泡液于4 ℃备存。另取原代兔骨髓基质干细胞传代培养,将第3代兔骨髓基质干细胞以1×105个/孔的密度接种于六孔培养板中,并置于37 ℃、5%二氧化碳培养箱中培养24 h使细胞贴壁生长。对照组兔骨髓基质干细胞仍然以DMEM培养液继续培养,另4组兔骨髓基质干细胞分别以4组浸泡液继续培养。48 h后于倒置相差显微镜下观察细胞形态和生长情况。
1.5 制备颅骨缺损动物模型及GP/CPC复合材料修复缺损评价GP/CPC复合材料修复颅骨缺损动物实验经浙江大学医学院附属第二医院伦理委员会批准。新西兰兔经耳缘静脉注射戊巴比妥钠(33 mg/kg)麻醉后,自颅顶部纵向切开皮肤、皮下组织及骨膜,骨膜下钝性分离暴露颅骨,采用环钻和球钻制备4个直径为8 mm的圆形骨缺损,分别以A、B、C、D组复合材料糊剂充填(图 1)。待材料固化后逐层缝合关闭切口。术后连续3 d予以青霉素皮下注射(16万IU/kg,每日1次)预防感染。术后6周、12周时采用空气栓塞法分别处死7只实验兔,收集颅骨标本。标本经10%甲醛溶液固定、常规脱钙、酒精梯度脱水、石蜡包埋后,切取5 μm厚组织切片,经苏木素-伊红(HE)染色后置于光镜下行组织学观察。
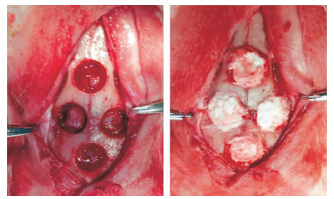
|
| 兔颅骨制备4个直径为8 mm的圆形骨缺损(左),分别充填以A、B、C、D组材料糊剂(右). 图 1 兔颅骨缺损模型的制备及GP/CPC复合材料填塞后大体图 Fig. 1 Rabbit models of skull defect and treatment with GP/CPC stuffing |
将组织学图像应用Image J 1.48 u生物图像分析软件测量骨缺损区的新骨面积,计算新骨形成量(newly formed bone inside scaffolds,nBIS)。nBIS=骨组织面积/缺损总面积×100%。
1.6 统计学分析采用SPSS 16.0 统计软件进行统计学分析。计量资料以均数±标准差(x±s)表示,组间比较均采用单因素方差分析,P<0.05认为差异有统计学意义。
2 结 果 2.1 GP粒径及外观GP通过标准分样筛选出粒径范围为100~200 μm和200~300 μm两组。在扫描电镜下,GP呈乳白色、形状不规则、分散性良好(图 2)。筛选的两组GP粒径分别为(152±26)μm和(248±31)μm,符合预期的100~200 μm和200~300 μm粒径范围。

|
| 扫描电镜下观察,两组GP均呈现为形状不规则,分散性好,相互之间无明显粘连.标尺=200 μm. 图 2 GP电镜扫描图 Fig. 2 Images of GP scanned by electron microscope |
体外浸泡1周后,GP/CPC复合材料的孔隙率显著高于单纯CPC材料。A、B、C、D 4组的孔隙率分别为54.1%±1.4%、46.8%±3.7%、52.0%±1.6% 和44.3%±3.1%,均高于单纯CPC组(28.0%±2.0%,均P<0.05)。提示GP/CPC复合材料中GP的含量对材料的孔隙率有重要影响,含10%GP的GP/CPC复合材料孔隙率显著高于含5%GP的GP/CPC复合材料(A组与B组,C组与D组,均P<0.05)。不同GP粒径的GP/CPC复合材料间的孔隙率则无明显差异(A组与C组,B组与D组,均P>0.05),见图 3。
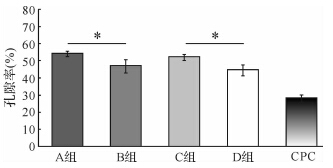
|
| A组:GP粒径200~300 μm,质量占比10%;B组:GP粒径200~300 μm,质量占比5%;C组:GP粒径100~200 μm,质量占比10%;D组:GP粒径100~200 μm,质量占比5%;CPC:单纯磷酸钙骨水泥.两组比较,*P<0.05. 图 3 各组GP/CPC复合材料的孔隙率比较 Fig. 3 Inter-group comparisons on porosity in different groups of GP/CPC |
扫描电镜显示,在体外浸泡1周后,A组和C组的复合材料表面孔隙密度明显高于B组和D组,而A组和B组的表面孔隙孔径明显大于C组和D组。提示GP粒径200~300 μm、质量占比10%的GP/CPC复合材料表面孔隙密度及表面孔隙孔径均较大(图 4)。
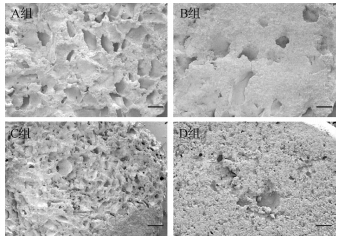
|
| A组:GP粒径200~300 μm,质量占比10%;B组:GP粒径200~300 μm,质量占比5%;C组:GP粒径100~200 μm,质量占比10%;D组:GP粒径100~200 μm,质量占比5%.A组和C组形成的微孔密度较高,A组和B组形成的微孔孔径较大.标尺=200 μm. 图 4 4组GP/CPC复合材料表面的电镜扫描图像 Fig. 4 Surface images of GP/CPC materials scanned by electron microscope |
GP/CPC复合材料的抗压试验显示,A、B、C、D 4组弹性模量分别为(23.4±10.1)MPa、(35.3±9.6)MPa、(46.2±10.7)MPa和(80.7±32.9)MPa,含5%GP的GP/CPC复合材料其弹性模量均高于含10%GP的GP/CPC复合材料(A组与B组,C组与D组,均P﹤0.05);粒径为100~200 μm GP的GP/CPC复合材料其弹性模量高于粒径为200~300 μm GP的GP/CPC复合材料(A组与C组,B组与D组,均P>0.05),提示GP/CPC复合材料中GP含量及粒径增大均会降低复合材料的抗压强度(图 5)。
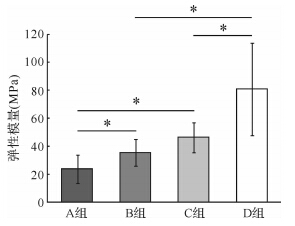
|
| A组:GP粒径200~300 μm,质量占比10%;B组:GP粒径200~300 μm,质量占比5%;C组:GP粒径100~200 μm,质量占比10%;D组:GP粒径100~200 μm,质量占比5%.组间比较,*P<0.05. 图 5 4组GP/CPC复合材料弹性模量比较 Fig. 5 Inter-group comparison on elasticity modulus |
兔骨髓基质干细胞体外培养实验显示,经4组GP/CPC复合材料体外浸泡液培养的兔骨髓基质干细胞均生长良好,细胞呈长梭形,鱼群状排列(图 6)。各实验组兔骨髓基质干细胞的细胞形态和增殖结果均与对照组相似。结果显示GP/CPC复合材料生物相容性较好。
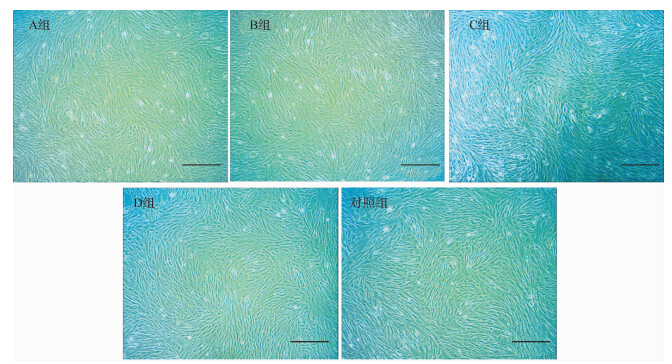
|
| A组:GP粒径200~300 μm,质量占比10%;B组:GP粒径200~300 μm,质量占比5%;C组:GP粒径100~200 μm,质量占比10%;D组:GP粒径100~200 μm,质量占比5%.经A、B、C、D 4组GP/CPC复合材料体外浸泡液培养的兔骨髓基质干细胞呈长梭形,鱼群状排列,且与对照组的细胞形态和增殖结果相似.标尺=400 μm. 图 6 兔骨髓基质干细胞在不同GP/CPC复合材料浸泡液中培养的细胞形态 Fig. 6 Histomorphology of cultured rabbit bone marrow stromal cells treated with GP/CPC of different gelatin particle size and ratio |
14只动物术后均存活,切口一期愈合。术后6周时各组标本的骨缺损区主要为大量复合材料所占据,但有新生骨组织自骨缺损边缘长入。新骨组织主要为编织骨,少见骨小梁结构。4组标本中,A组和C组的新骨形成相对更活跃。12周时,复合材料进一步降解,而新骨量则明显高于6周时,且各组标本中均可见有粗细不等的骨小梁形成,自周围向中心区域生长的新骨组织开始相互交汇连接成片。其中,A组标本中可见有少量脂肪细胞位于新骨中,显示其组织学结构较为成熟(图 7)。
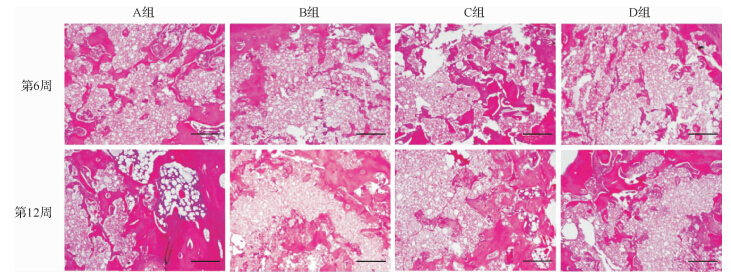
|
| A组:GP粒径200~300 μm,质量占比10%;B组:GP粒径200~300 μm,质量占比5%;C组:GP粒径100~200 μm,质量占比10%;D组:GP粒径100~200 μm,质量占比5%.术后6周时骨缺损区主要为大量GP/CPC复合材料,可见新生骨组织;12周时各组标本中GP/CPC复合材料进一步降解,而新骨量则明显增加.标尺=400 μm. 图 7 各组GP/CPC材料修复兔颅骨缺损的组织HE染色结果 Fig. 7 HE staining of rabbit skull bone repaired by GP/CPC |
在组织形态测量中,6周时A、B、C、D 4组的nBIS分别为26.3%±3.8%、13.1%±6.3%、21.0%±6.4%和9.4%±4.3%;12周时A、B、C、D 4组的nBIS分别为41.0%±8.8%、30.3%±5.9%、37.3%±9.0%和22.8%±5.7%。各组12周时nBIS均高于6周时(均P<0.05)。无论是6周时或者12周时,A组nBIS均高于B组,C组均高于D组(均P<0.05),表明含10%GP的GP/CPC复合材料修复颅骨缺损时较含5%GP者更有利于骨缺损区的新骨形成。同时,A组的nBIS高于C组,B组也高于D组(均P<0.05)。这显示制备GP/CPC复合材料时,采用粒径为200~300 μm的GP也更有利于新骨形成(图 8)。
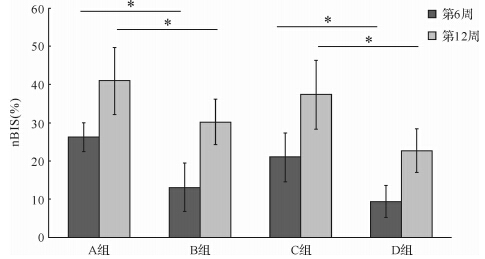
|
| A组:GP粒径200~300 μm,质量占比10%;B组:GP粒径200~300 μm,质量占比5%;C组:GP粒径100~200 μm,质量占比10%;D组:GP粒径100~200 μm,质量占比5%.组间比较,*P<0.05. 图 8 4组标本nBIS比较结果 Fig. 8 Inter-group comparison on nBIS |
GP/CPC复合材料的性能与GP粒径及质量占比之间存在一定关联。对于性能良好的GP/CPC复合材料,不仅要求其表面具有一定程度的孔隙率、抗压强度,而且要求其适合植入并融合成骨。既往有研究指出,复合材料表面的孔径大小、孔隙率和孔隙的连通性均与其成骨传导性能有很大关系,然而对具体多大程度的孔径最适于骨形成至今尚无定论[12, 13]。有研究认为允许可见的骨组织通过的孔径至少需要40 μm[14],也有研究指出当GP粒径在100 μm左右时最适合成骨[15]。本实验将GP根据粒径不同,人为分成100~200 μm与200~300 μm两组,并分别对其表面孔隙率、抗压强度及生物相容性等材料性能进行了分析比较。结果显示,不论从电镜扫描定性分析还是利用孔隙率计算模型检测定量分析,GP粒径大小并不影响复合材料的表面孔隙率;较小GP粒径(100~200 μm)的GP/CPC复合材料其弹性模量相对较大,即抗压强度较大;然而在生物相容性方面,动物实验结果表明,较大GP粒径(200~300 μm)的GP/CPC复合材料则显示出更佳的生物相容性和成骨性,此与先前一些研究结果相符[16, 17]。综上结果,GP粒径可以影响材料的抗压强度和生物相容性。
除了GP粒径外,GP/CPC复合材料中明胶合成的质量占比也是一项重要的影响因子。先前有文献报道,在成骨性方面明胶质量占比15%的GP/CPC复合材料优于明胶质量占比10%者,而在抗压强度方面前者劣于后者[18]。为此,本实验将质量占比分为5%与10%两组,同样分析相应的材料性能,结果显示10%质量占比的GP/CPC复合材料其表面孔隙率较大,对应的生物相容性和成骨性也较优,然而其抗压强度较小。上述结果说明,明胶在复合材料中的质量占比对材料的孔隙率、抗压强度及生物相容性均有不同维度的影响,这一影响与GP粒径一样,不是单向的,尤其对于抗压强度的影响,往往与生物相容性和成骨性并不一致。因此,在实际临床应用中应综合考虑患者病情及植骨需求,在材料的抗压强度与生物相容性、成骨性两者之间权衡取舍。
本实验尚存在一些不足,主要有三点:其一,本实验分组相对简单,对于GP粒径和GP质量占比这两个影响因素的具体量化分组仅分别设置两个组别进行比较,结合国外一些研究[8, 9, 10, 11],可以进一步对明胶粒径50~500 μm范围做更细致的组分,而明胶质量占比也可再增设组别作为比较,通过增加组间比较或可更好地了解这两大因素对GP/CPC复合材料性能的影响程度;其二,本实验尚缺少对GP/CPC复合材料降解性能的分析比较,考虑到理想的复合材料的降解速度应该与骨形成的速度相匹配,降解过快或过慢都不利于新骨的长入[19, 20, 21, 22]。因此,降解性对于GP/CPC复合材料性能也是一项重要的评价指标,在今后的研究中需对这一指标的影响因素做进一步分析。其三,本实验的骨再生过程是一直无应力状态下的生长,缺乏考虑外力对骨修复的影响。因此,在今后的研究中可增加外力这一影响因素从而使结论更加接近临床实际。
综上所述,GP粒径和GP质量占比是影响GP/CPC复合材料性能的两大重要因素,其对材料表面孔隙率、抗压强度、生物相容性及成骨性等指标均有不同程度与维度的影响,且这种影响是复杂多元化的。因此,在实际临床应用过程中,需综合考虑患者病情及植骨需求,对上述影响因素进行权衡取舍,从而实现材料的最大临床效能。
| [1] | RUH P Q, KROESE-DEUTMAN H C, WOLKE J G, et al. Bone inductive properties of rhBMP-2 loaded porous calcium phosphate cement implants in cranial defects in rabbits [J]. Biomaterials, 2004,25(11):2123-2132. |
| [2] | BOSE S, TARAFDER S. Calcium phosphate ceramic systems in growth factor and drug delivery for bone tissue engineering: a review [J]. Acta Biomater,2012,8(4):1401-1421. |
| [3] | KEMPEN D H, LU L, HEFFERAN T E, et al. Retention of in vitro and in vivo BMP-2 bioactivities in sustained delivery vehicles for bone tissue engineering [J]. Biomaterials,2008,29(22):3245-3252. |
| [4] | VLAD M D, SINDILAR E V, MARINOSO M L, et al. Osteogenic biphasic calcium sulphate dihydrate/iron-modified alpha-tricalcium phosphate bone cement for spinal applications: in vivo study [J]. Acta Biomater,2010,6(2):607-616. |
| [5] | DEL REAL R P, OOMS E, WOLKE J G, et al. In vivo bone response to porous calcium phosphate cement [J]. J Biomed Mater Res A,2003,65(1):30-36. |
| [6] | MOONEY D J, BALDWIN D F, SUH N P, et al. Novel approach to fabricate porous sponges of poly(D,L-lactic-co-glycolic acid) without the use of organic solvents [J]. Biomaterials,1996,17(14):1417-1422. |
| [7] | THOMSON R C, MIKOS A G, BEAHM E, et al. Guided tissue fabrication from periosteum using preformed biodegradable polymer scaffolds [J]. Biomaterials, 1999,20(21):2007-2018. |
| [8] | NARAYAN D, VENKATRAMAN S S. Effect of pore size and interpore distance on endothelial cell growth on polymers [J]. J Biomed Mater Res A,2008,87(3):710-718. |
| [9] | OH S H, PARK I K, KIM J M, et al. In vitro and in vivo characteristics of PCL scaffolds with pore size gradient fabricated by a centrifugation method [J]. Biomaterials,2007,28(9):1664-1671. |
| [10] | KARAGEORGIOU V, KAPLAN D. Porosity of 3D biomaterial scaffolds and osteogenesis [J]. Biomaterials,2005,26(27):5474-5491. |
| [11] | AKAY G, BIRCH M A, BOKHARI M A. Microcellular polyHIPE polymer supports osteoblast growth and bone formation in vitro [J]. Biomaterials,2004,25(18):3991-4000. |
| [12] | LU J X, FLAUTRE B, ANSELME K, et al. Role of interconnections in porous bioceramics on bone recolonization in vitro and in vivo [J]. J Mater Sci Mater Med,1999,10(2):111-120. |
| [13] | MASTROGIACOMO M, SCAGLIONE S, MARTINETTI R, et al. Role of scaffold internal structure on in vivo bone formation in macroporous calcium phosphate bioceramics [J]. Biomaterials,2006,27(17):3230-3237. |
| [14] | MURPHY C M, HAUGH M G, O'BRIEN F J. The effect of mean pore size on cell attachment, proliferation and migration in collagen-glycosaminoglycan scaffolds for bone tissue engineering [J]. Biomaterials,2010,31(3):461-466. |
| [15] | GRIFFON D J, SEDIGHI M R, SCHAEFFER D V, et al. Chitosan scaffolds: interconnective pore size and cartilage engineering [J]. Acta Biomater,2006,2(3):313-320. |
| [16] | SOBRAL J M, CARIDADE S G, SOUSA R A, et al. Three-dimensional plotted scaffolds with controlled pore size gradients: effect of scaffold geometry on mechanical performance and cell seeding efficiency [J]. Acta Biomater,2011,7(3):1009-1018. |
| [17] | HOLLINGER J O, KLEINSCHMIDT J C. The critical size defect as an experimental model to test bone repair materials [J]. J Craniofac Surg,1990,1(1):60-68. |
| [18] | KASUYA A, SOBAJIMA S, KINOSHITA M. In vivo degradation and new bone formation of calcium phosphate cement-gelatin powder composite related to macroporosity after in situ gelatin degradation [J]. J Orthop Res,2012,30(7):1103-1111. |
| [19] | LIN A S, BARROWS T H, CARTMELL S H, et al. Microarchitectural and mechanical characterization of oriented porous polymer scaffolds [J]. Biomaterials,2003,24(3):481-489. |
| [20] | KOKUBO T, KIM H M, KAWASHITA M. Novel bioactive materials with different mechanical properties [J]. Biomaterials,2003,24(13):2161-2175. |
| [21] | LASCHKE M W, STROHE A, SCHEUER C, et al. In vivo biocompatibility and vascularization of biodegradable porous polyurethane scaffolds for tissue engineering [J]. Acta Biomater,2009,5(6):1991-2001. |
| [22] | BURG K J, PORTER S, KELLAM J F. Biomaterial developments for bone tissue engineering [J]. Biomaterials,2000,21(23):2347-2359. |



