恶性肿瘤的发病率和致死率均居全球首位,影响患者预后的首要因素是局部复发和远处转移[1]。研究证实,上皮—间质转化(epithelial-mesenchymal transition,EMT)是肿瘤发展中的一个重要环节,肿瘤细胞经历EMT后,获得侵袭的特征,浸润至周围的基质中,形成促进肿瘤生长与转移的微环境,EMT与肿瘤的侵袭、转移及其干细胞样特征的形成有关[2]。经历EMT的肿瘤经过传统治疗后,对化学疗法及药物产生抗性与耐药,导致肿瘤的复发与转移。EMT是一个动态过程,多个细胞信号转导通路参与调节其发生与变化。本文结合目前的研究,就肿瘤细胞的EMT及其调节机制作一综述。
1 EMT的概念及其发生20世纪80年代初,Greenberg等[3]在研究中发现,晶状体上皮细胞在三维凝胶中培养可以形成伪足并向间质样细胞形态转变,首次提出了EMT的概念。EMT是指在特定的生理和病理条件下,具有极性的上皮细胞失去上皮细胞特性而获得间质样细胞(成纤维样细胞)特性的现象。上皮细胞EMT具体表现为:①形态改变——细胞形态由鹅卵石样变为纺锤体样,细胞极性丧失,骨架改变,浸润与迁移能力增强;②分子标志物改变——上皮化分子标志物E-钙黏蛋白(E-cadherin)等分子表达水平下降,间质化分子标志物波形蛋白(vimentin)等表达水平上升。
EMT的发生通常有3种不同的生物学背景:①在胚胎早期发育过程中:一些上皮细胞通过EMT和间质—上皮转化(mesenchymal-epithelial transitions)完成组织或器官的发育,如原肠胚、心瓣膜以及神经嵴的形成;②在组织损伤的修复过程中:通过产生成纤维细胞来修复由创伤或者炎症反应造成的组织或器官的损伤;③参与肿瘤的发生、发展过程中:上皮细胞来源的肿瘤细胞EMT后获得运动和侵袭能力,再经血液、淋巴循环向远端转移[4]。
以下两个因素可诱导肿瘤细胞发生EMT:
(1)生长因子。早期研究发现,肝细胞生长因子(hepatocyte growth factor,HGF)能够改变肿瘤细胞表面E-cadherin的表达促进肿瘤细胞发生EMT。后期研究发现,转化生长因子β(transforming growth factor β,TGF-β)、胰岛素样生长因子(insulin-like growth factor)、成纤维细胞生长因子(fibroblast growth factor)以及表皮生长因子(epithelial growth factor)等,也能与相应的膜受体结合,激活其下游的信号通路,从而诱导肿瘤细胞EMT的发生[5]。目前研究认为TGF-β是EMT中最相关的细胞因子,常作为诱导细胞发生EMT的阳性对照。
(2)肿瘤微环境。肿瘤微环境由细胞外基质(extracellular matrix),与肿瘤相关的成纤维细胞、肌成纤维细胞、免疫细胞和与肿瘤发展与转移相关的可溶性因子等构成[6]。在肿瘤微环境中,肿瘤细胞之间能通过一些介质如生长因子、细胞因子和细胞外基质蛋白的自分泌或旁分泌诱导EMT的发生[7, 8]。乳腺癌细胞中,与肿瘤相关的成纤维细胞能够诱导肿瘤细胞发生EMT[9]。在口腔鳞状细胞癌中,口腔鳞状上皮细胞通过分泌TGF-β直接诱导该细胞本身出现肌成纤维母细胞表型,肌成纤维细胞又能通过TGF-β信号通路诱导鳞状上皮细胞分泌HGF,HGF能促进肿瘤细胞的增殖与侵袭[10]。
缺氧是肿瘤微环境的特征之一。缺氧条件下,肿瘤细胞通过缺氧诱导因子(hypoxia-inducible factors)直接或间接(通过上调TGF-β1表达)促进EMT转录阻遏物Snail的表达[11],还可以通过激活表皮生长因子受体(EGFR)信号通路,诱导肿瘤细胞发生EMT[12]。以上研究均证实,肿瘤微环境能够诱导并维持EMT这一过程。
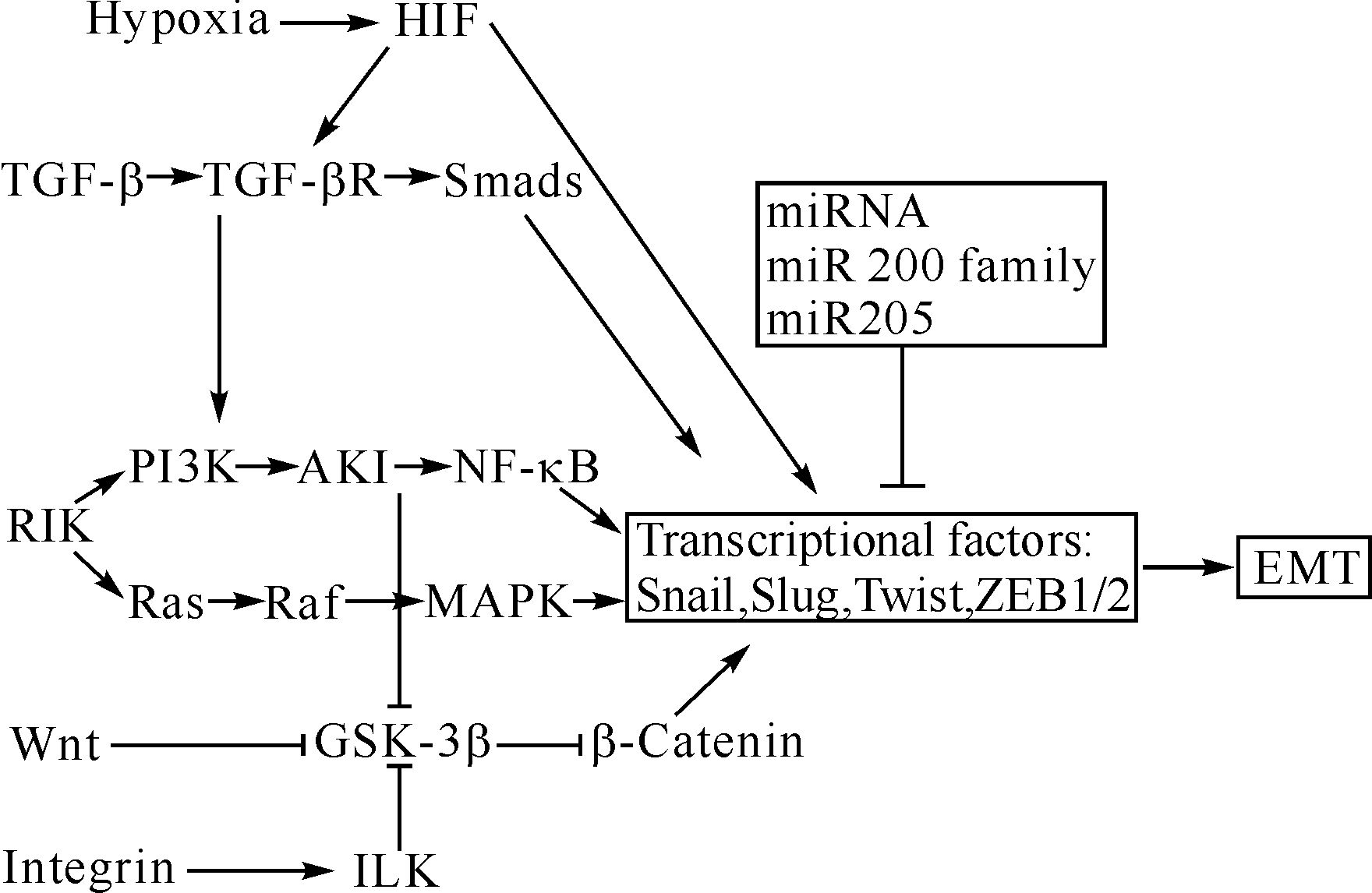
2 肿瘤细胞中EMT的调节机制EMT是一个动态的过程,多种转录因子ZEB1/2、bHLH蛋白(Twist)以及Snail家族(Snail、Slug)等参与其中,其主要调节机制如图1所示。
|
| TGF-β:转化生长因子β;PI3K/AKT:磷脂酰肌醇3-激酶/丝氨酸—苏氨酸激酶;Ras-Raf-MAPK:膜受体酪氨酸蛋白激酶;Integrin:整合素;ILK:整合素连接激酶;NF-κB:核因子κB;Hypoxia:缺氧;HIF:缺氧诱导因子;miRNA:微RNA; family,家族;Transcriptional factors:转录因子;EMT:上皮—间质转化. 图1 上皮—间质转化的调节机制示意图 Fig.1 Scheme of regulation mechanism of epithelial-mesenchymal transition |
E-cadherin是一种在大多数上皮组织中均表达的钙依赖性跨膜糖蛋白,通过细胞外的免疫球蛋白结构域相互连接,并通过细胞质内的α、β连接蛋白与肌动蛋白骨架相连接,使细胞与细胞之间形成紧密的连接[13]。E-cadherin能够维持上皮细胞的表型,EMT过程中其表达水平的下降可导致细胞黏附能力降低,肿瘤细胞脱落易于移行而促进肿瘤的转移[14]。大量的研究证实,多数与EMT相关的信号通路都与E-cadherin的表达下调有关,如TGF-β/Smad、整合素连接激酶(integrin-linked kinase)、Wnt/β-Catenin、磷脂酰肌醇3-激酶/丝氨酸—苏氨酸激酶(phosphatidylinositol 3-kinase / serine / threonine kinase)、膜受体酪氨酸蛋白激酶(Ras-Raf-mitogen activated protein kinase)以及North信号通路等,这些信号通路都能通过激活其下游的转录因子,在转录水平调控EMT[1]。
综上所述,E-cadherin表达下调促进肿瘤转移。但最近的研究结果表明,E-cadherin表达上调在肿瘤发展方面也有一定作用。E-cadherin在上皮细胞来源的卵巢癌组织中大量表达,但正常的卵巢组织很少表达,这并没有完全遵循传统的EMT模式[15, 16]。体外实验证实,正常的卵巢表面上皮细胞系转染携带E-cadherin的质粒后,会出现与恶性程度及扩散能力增加相关的表型改变,从中分离出卵巢癌细胞株,经腹腔注射给予SCID小鼠,使其种植在小鼠肠系膜、网膜,可见小鼠产生腹腔积液,同时肿瘤细胞侵入到肝脏和大腿的肌肉组织中[17]。这一结果表明过表达E-cadherin会导致正常细胞产生与促肿瘤增殖和恶化相关的变化。在炎性乳腺癌中也发现E-cadherin的过表达[18]。在一些肿瘤的侵袭过程中,肿瘤细胞的上皮特性并不会消失,而是以聚集成一个整体并保持紧密连接的形式进行侵袭,称集群细胞迁移[19]。E-cadherin能够稳定集群细胞间的相互作用,由一个细胞牵拉另一个细胞移动产生牵引力,进而再使后面连接的细胞发生被动的迁移[20];此外,E-cadherin还能够促进单个肿瘤细胞直接产生牵引力,使其移动[21, 22]。这都提示我们,E-cadherin的表达上调并不一定阻碍肿瘤细胞的转移与侵袭,还可能促进肿瘤细胞的生存与发展。
2.2 微小RNA与EMT微小RNA (microRNA,miRNA,miR)是一类内源性的小分子非编码RNA,由19-25个单核苷酸组成。成熟的单链miRNA与RNA诱导的基因沉默复合物(RISC)结合,形成RISC复合物。该复合物与靶基因的mRNA结合,作用于mRNA的3′-非翻译区,将其降解或抑制其翻译,从转录水平调控基因表达[23]。近年来对于miRNA的研究阐明miRNA参与肿瘤转移中基因与蛋白表达的调节。miR-200家族(miR-200a、miR-200b、miR-200c、miR-141、miR-429)和miR-205在EMT的调节过程中起到重要作用[24]。这些miRNA的低表达可以上调E-cadherin转录阻遏物锌指蛋白(ZEB1/ZEB2)的表达水平,从而降低E-cadherin的表达水平,促进EMT;而miRNA过表达又可逆转EMT。
2.3 TGF-β信号通路与EMTTGF-β是一种具有多效性和多向性、在多种肿瘤中高表达的多功能细胞因子,有3种不同的亚型:TGF-β1、TGF-β2、TGF-β3,目前对于TGF-β1的研究最为广泛和深入。TGF-β在肿瘤的发展过程中发挥双重作用:在早期,抑制肿瘤生长;在后期,通过促进EMT来促进肿瘤发展。TGF-β诱导肿瘤细胞发生EMT的信号通路根据有无Smad蛋白参与分为两种:①Smad依赖的经典TGF-β信号通路;②非Smad依赖的TGF-β信号通路。在TGF-β/Smad信号通路中,TGF-β与细胞膜表面的特异性受体结合,使Smad2/Smad3磷酸化,并与Smad4结合形成异源三聚体进入细胞核,使Snail/Slug、Twist、ZEB1等转录因子表达增加,下调E-cadherin的表达,进而在转录水平调控EMT[25]。而对于非Smad依赖信号通路,TGF-β能够通过激活其他EMT相关的信号通路如整合素、PI3K/AKT、丝裂原活化蛋白激酶(MAPK)信号通路等诱导EMT的发生,如TGF-β与相应的跨膜受体结合后,激活PI3K,产生第二信使PIP3,使AKT磷酸化。磷酸化的AKT通过抑制其下游的GSK-3β使β-catenin无法降解而积累进入细胞核内;或通过活化核因子-κB,激活其下游的转录因子,调控EMT[26]。除PI3K/AKT信号通路外,TGF-β还能通过Ras-Raf-MAPK途径,如细胞外信号调节激酶ERK1/2(extrallular signal regulated protein kinase 1/2),p38MAPK等激活下游转录因子诱导靶基因的转录[27],进而调控EMT。
2.4 其他信号转导通路与EMT除TGF-β信号通路外,还有其他的信号通路与EMT的调节相关,如Wnt/β-catenin信号通路[28]等。在Wnt/β-catenin信号通路中,Wnt蛋白与相应的跨膜受体结合,抑制GSK-3β,使β-catenin无法降解而积累,当β-catenin积累到一定程度时进入细胞核内,与核内的转录因子(lymphoid enhancer factor/T cell factor)共同作用,激活与EMT相关的靶基因,降低E-cadherin的表达,参与EMT过程[28, 29]。此外,Wnt信号通路还能通过激活整合素连接激酶和PI3K/AKT,抑制GSK-3β使β-catenin积累。有研究证实,MAPK/ERK途径也能够抑制GSK-3β从而导致β-catenin的积累,促进EMT的发生和维持[30]。
2.5 转录因子与EMT促进细胞上皮表型抑制和间质表型活化相关的基因表达涉及到一些主要的调控因子,其中包括ZEB1/2、bHLH蛋白以及Snail家族等。在EMT的早期阶段,这些转录因子被激活,与E-cadherin启动子区域的E-Box结合,下调E-cadherin的表达水平[31],促进肿瘤发展。这些转录因子的基因表达谱不同,对EMT的作用也取决于所涉及的细胞或组织类型以及引发EMT的信号通路,它们在表达上相互制约,在功能上相互协调,调节靶基因的表达。各种信号通路如TGF-β、Wnt和PI3K/AKT信号通路等都与E-cadherin的转录阻遏物有关。
3 EMT与肿瘤治疗针对EMT相关信号通路的研究为肿瘤的治疗提供了方向,也成为临床新药开发的主要目标。研究发现,整合素连接激酶能够活化AKT导致EMT的发生,在内分泌癌中,下调整合素连接激酶能够抑制肿瘤细胞的EMT及其转移[32]。半胱氨酸蛋白酶抑制剂C(CystC)能干扰正常细胞和肿瘤细胞的TGF-β信号通路[33]。Ras途径也为肿瘤治疗药物的研究提示了靶标,如法尼基转移酶抑制剂(farnesyltransferase inhibitors)通过抑制Ras与细胞膜结合而发挥抗肿瘤作用,已应用于多种肿瘤的治疗[34]。Src激酶抑制剂如达沙替尼(dasatinib)能够有效抑制发生EMT的细胞生长,从而抑制肿瘤生长[35]。
此外,RNA干扰和miRNA沉默为肿瘤的治疗提供了新的方向。例如,由短发卡RNA引起的Snail基因表达沉默能够逆转EMT,并对体内肿瘤的生长也有抑制作用[36]。体内针对TGF-β的小分子干扰RNA能够抑制肿瘤的转移,提示可以通过抑制肿瘤细胞基质中TGF-β的分泌来阻止EMT的发生[37]。Krutzfeldt等[38]提出,内源性miRNA的特异性沉默以及RNA拮抗剂也能够使体内特异的miRNA表达沉默。因而,以miRNA作为靶点抑制EMT的发生也是肿瘤治疗的一种新策略。
4 结 语肿瘤细胞发生EMT受到多种因素的调控,肿瘤细胞经历EMT后可迁移到邻近的器官或向远端转移,并对传统的化疗及药物治疗出现抵抗与耐药。然而,研究表明EMT并不是一个不可逆转的过程,逆转或抑制EMT或许是抑制肿瘤细胞迁移或向远端转移的有效途径。因此,进一步加深对EMT相关调控因子的研究,不仅有助于更好地理解肿瘤细胞EMT发生的机制,而且为了解肿瘤转移与复发的机制提供新的方向,为肿瘤的治疗提供新的线索,即通过抑制肿瘤细胞EMT而降低肿瘤细胞的耐药性——这可作为肿瘤常规疗法的补充进而成为一种新的个性化肿瘤治疗方法。以EMT为靶点的抗肿瘤新药研发将是一个新的研究方向。
| [1] | THIERY J P, ACLOQUE H, HUANG R Y, et al. Epithelial-mesenchymal transitions in development and disease [J]. Cell, 2009, 139(5): 871-890. |
| [2] | TSAI J H, YANG J. Epithelial-mesenchymal plasticity in carcinoma metastasis [J]. Genes Dev, 2013, 27(20): 2192-2206. |
| [3] | GREENBURG G, HAY E D. Epithelia suspended in collagen gels can lose polarity and express characteristics of migrating mesenchymal cells [J]. J Cell Biol, 1982, 95(1): 333-339. |
| [4] | BARTIS D, MISE N, MAHIDA R Y, et al. Epithelial-mesenchymal transition in lung development and disease: does it exist and is it important? [J]. Thorax, 2014, 69(8): 760-765. |
| [5] | XIONG J, SUN Q, JI K, et al. Epidermal growth factor promotes transforming growth factor-beta1-induced epithelial-mesenchymal transition in HK-2 cells through a synergistic effect on Snail [J]. Mol Biol Rep, 2014, 41(1): 241-250. |
| [6] | JUNG H Y, FATTET L, YANG J. Molecular pathways: Linking tumor microenvironment to epithelial to mesenchymal transition in metastasis. Clin Cancer Res, 2015, 21(5): 962-968. |
| [7] | CHUNG H W, LIM J B. Role of the tumor microenvironment in the pathogenesis of gastric carcinoma [J]. World J Gastroenterol, 2014, 20(7): 1667-1680. |
| [8] | LEIBOVICH-RIVKIN T, LIUBOMIRSKI Y, BERNSTEIN B, et al. Inflammatory factors of the tumor microenvironment induce plasticity in nontransformed breast epithelial cells: EMT, invasion, and collapse of normally organized breast textures [J]. Neoplasia, 2013, 15(12): 1330-1346. |
| [9] | LEBRET S C, NEWGREEN D F, THOMPSON E W, et al. Induction of epithelial to mesenchymal transition in PMC42-LA human breast carcinoma cells by carcinoma-associated fibroblast secreted factors [J]. Breast Cancer Res, 2007, 9(1): R19. |
| [10] | LEWIS M P, LYGOE K A, NYSTROM M L, et al. Tumour-derived TGF-beta1 modulates myofibroblast differentiation and promotes HGF/SF-dependent invasion of squamous carcinoma cells [J]. Br J Cancer, 2004, 90(4): 822-832. |
| [11] | MATSUOKA J, YASHIRO M, FUYUHIRO Y, et al. Hypoxia stimulates the EMT of gastric cancer cells through autocrine TGFβ signaling [J].PLoS One, 2013, 8(5): e62310. |
| [12] | MISRA A, PANDEY C, SZE S K, et al. Hypoxia activated EGFR signaling induces epithelial to mesenchymal transition (EMT) [J]. PLoS One, 2012, 7(11): e49766. |
| [13] | TEPASS U, TRUONG K, GODT D, et al. Cadherins in embryonic and neural morphogenesis [J]. Nat Rev Mol Cell Biol, 2000, 1(2): 91-100. |
| [14] | SHARGH S A, SAKIZLI M, KHALAJ V, et al. Downregulation of E-cadherin expression in breast cancer by promoter hypermethylation and its relation with progression and prognosis of tumor [J]. Med Oncol, 2014, 31(11): 250. |
| [15] | ELLOUL S, VAKSMAN O, STAVNES H T, et al. Mesenchymal-to-epithelial transition determinants as characteristics of ovarian carcinoma effusions [J]. Clin Exp Metastasis, 2010, 27(3): 161-172. |
| [16] | HUDSON L G, ZEINELDIN R, STACK M S. Phenotypic plasticity of neoplastic ovarian epithelium: unique cadherin profiles in tumor progression [J]. Clin Exp Metastasis, 2008, 25(6): 643-655. |
| [17] | ONG A, MAINES-BANDIERA S L, ROSKELLEY C D, et al. An ovarian adenocarcinoma line derived from SV40/E-cadherin-transfected normal human ovarian surface epithelium [J]. Int J Cancer, 2000, 85(3): 430-437. |
| [18] | YE Y, TELLEZ J D, DURAZO M, et al. E-cadherin accumulation within the lymphovascular embolus of inflammatory breast cancer is due to altered trafficking [J]. Anticancer Res, 2010, 30(10): 3903-3910. |
| [19] | FRIEDL P, GILMOUR D. Collective cell migration in morphogenesis, regeneration and cancer [J]. Nat Rev Mol Cell Biol, 2009, 10(7): 445- 457. |
| [20] | MACPHERSON I R, HOOPER S, SERRELS A, et al. p120-catenin is required for the collective invasion of squamous cell carcinoma cells via a phosphorylation-independent mechanism [J]. Oncogene, 2007, 26(36): 5214-5228. |
| [21] | NIEWIADOMSKA P, GODT D, TEPASS U. DE-Cadherin is required for intercellular motility during Drosophila oogenesis [J]. J Cell Biol, 1999, 144(3): 533-547. |
| [22] | KARDASH E, REICHMAN-FRIED M, MAITRE J L, et al. A role for Rho GTPases and cell-cell adhesion in single-cell motility in vivo [J]. Nat Cell Biol, 2010, 12(1): 47-53. |
| [23] | LIN CW, KAO S H, YANG P C. The miRNAs and Epithelial-Mesenchymal Transition in Cancers [J]. Curr Pharm Des, 2014, 20(33): 5309-5318. |
| [24] | DIAZ-LOPEZ A, MORENO-BUENO G, CANO A. Role of microRNA in epithelial to mesenchymal transition and metastasis and clinical perspectives [J]. Cancer Manag Res, 2014, 6: 205-216. |
| [25] | KATSUNO Y, LAMOUILLE S, DERYNCK R. TGF-beta signaling and epithelial-mesenchymal transition in cancer progression [J]. Curr Opin Oncol, 2013, 25(1): 76-84. |
| [26] | SUWANABOL P A, SEEDIAL S M, ZHANG F, et al. TGF-beta and Smad3 modulate PI3K/Akt signaling pathway in vascular smooth muscle cells [J]. Am J Physiol Heart Circ Physiol, 2012, 302(11): H2211-2219. |
| [27] | SANTARPIA L, LIPPMAN S M, EL-NAGGAR A K. Targeting the MAPK-RAS-RAF signaling pathway in cancer therapy [J]. Expert Opin Ther Targets, 2012, 16(1): 103-119. |
| [28] | AREND R C, LONDONO-JOSHI A I, STRAUGHN J M JR., et al. The Wnt/beta-catenin pathway in ovarian cancer: a review [J]. Gynecol Oncol, 2013, 131(3): 772-779. |
| [29] | CHO S W, KIM Y A, SUN H J, et al. Therapeutic potential of Dickkopf-1 in wild-type BRAF papillary thyroid cancer via regulation of beta-catenin/E-cadherin signaling [J]. J Clin Endocrinol Metab, 2014, 99(9):E1641-E1649. |
| [30] | GONG K, ZHOU F, HUANG H, et al. Suppression of GSK3beta by ERK mediates lipopolysaccharide induced cell migration in macrophage through beta-catenin signaling [J]. Protein Cell, 2012, 3(10): 762-768. |
| [31] | PUISIEUX A, BRABLETZ T, CARAMEL J. Oncogenic roles of EMT-inducing transcription factors [J]. Nat Cell Biol, 2014, 16(6): 488-494. |
| [32] | CORTEZ V, NAIR B C, CHAKRAVARTY D, et al. Integrin-linked kinase 1: role in hormonal cancer progression [J]. Front Biosci (Schol Ed), 2011, 3: 788-796. |
| [33] | RIVENBARK A G, COLEMAN W B. Epigenetic regulation of cystatins in cancer [J]. Front Biosci (Landmark Ed), 2009, 14: 453-462. |
| [34] | PELAIA G, GALLELLI L, RENDA T, et al. Effects of statins and farnesyl transferase inhibitors on ERK phosphorylation, apoptosis and cell viability in non-small lung cancer cells [J]. Cell Prolif, 2012, 45(6): 557-565. |
| [35] | WILSON C, NICHOLES K, BUSTOS D, et al. Overcoming EMT-associated resistance to anti-cancer drugs via Src/FAK pathway inhibition [J]. Oncotarget, 2014, 5(17): 7328-7341. |
| [36] | MIKAMI S, KATSUBE K, OYA M, et al. Expression of Snail and Slug in renal cell carcinoma: E-cadherin repressor Snail is associated with cancer invasion and prognosis [J]. Lab Invest, 2011, 91(10): 1443-1458. |
| [37] | MOORE L D, ISAYEVA T, SIEGAL G P, et al. Silencing of transforming growth factor-beta1 in situ by RNA interference for breast cancer: implications for proliferation and migration in vitro and metastasis in vivo [J]. Clin Cancer Res, 2008, 14(15): 4961-4970. |
| [38] | KRUTZFELDT J, RAJEWSKY N, BRAICH R, et al. Silencing of microRNAs in vivo with ‘antagomirs’[J]. Nature, 2005, 438(7068): 685-689. |



