2. 丽水市人民医院血液科, 浙江 丽水 323000
2.Department of Hematology, Lishui Peoples Hospital, Lishui 323000, China
BL融合基因产生于9号和22号染色体易位(Ph1染色体), 是慢性髓性白血病(chronic myeloid leukemia, CML)的特征性分子标志[1]。BCR-ABL融合蛋白具有持续激活的酪氨酸激酶活性, 能够激活多种下游信号分子, 如信号传导及转录激活因子(STAT)、磷脂酰肌醇 3激酶/蛋白激酶 B (PI3K/AKT)、细胞外调节蛋白激酶 (ERK)等促进细胞发生恶性转化[2, 3]。伊马替尼作为高度特异性的酪氨酸激酶抑制剂(TKI)对于CML具有显著疗效, 已成为初诊CML患者的一线治疗药物[4]。
在伊马替尼时代之前, 重组人干扰素α2b(以下简称干扰素)是治疗CML慢性期患者的一线药物。目前, 由于经济条件等因素限制, 国内仍有患者将干扰素作为一线治疗; 其中一些患者干扰素治疗失败或者不耐受后再选择伊马替尼。有关伊马替尼治疗干扰素失败或者不耐受患者的疗效如何国内尚无系统报道。本文回顾性分析和比较了伊马替尼治疗新诊断与干扰素治疗失败患者的疗效, 以期为临床治疗策略提供借鉴。
1 对象和方法 1.1 对象86例CML慢性期患者均为2001年至2008年在浙江大学医学院附属第一医院门诊治疗的患者, 其中新诊断患者61例, 干扰素治疗失败或者不耐受(统称为干扰素治疗失败组)25例。由于CML治疗疗效评价标准有演变, 本研究对CML的诊断和疗效标准参照“中国慢性髓性白血病诊断与治疗指南(2013年版)”[5]。部分细胞遗传学反应(partial cytogenetic response)定义为Ph1阳性细胞为1%~35%, 完全细胞遗传学反应(complete cytogenetic response)定义为Ph1阳性细胞为0; 主要分子生物学反应(major molecular remission)定义为BCR-ABL融合基因≤0.1%, 完全分子生物学反应(complete molecular remission)定义为未检测到BCR-ABL融洽基因。伊马替尼治疗后原发性细胞遗传学耐药定义为治疗6个月没有获得细胞遗传学反应, 或12个月没有获得部分细胞遗传学缓解, 或18个月没有获得完全细胞遗传学缓解。继发性细胞遗传学耐药定义为获得完全细胞遗传学缓解后又丢失[6]。两组患者临床特征见表1。86例患者均给予伊马替尼治疗, 剂量每天400mg。
| [n(%)或M(min-max)] | |||
| 项目 | 干扰素治疗 失败组(n=25) | 新诊断组 (n=61) | P值 |
| 性别 男 | 15(60.0) | 38(62.3) | 0.843 |
| 女 | 10(40.0) | 23(37.7) | |
| 伊马替尼治疗时年龄(岁) | 45(3~65) | 42(7~73) | 0.466 |
| 血小板数(×109/L) | 452(87~950) | 437(98~2349) | 0.438 |
| 脾大有 | 18(72.0) | 45(73.8) | 0.866 |
| 无 | 7(28.0) | 16(26.2) | |
| 外周血原始细胞 有 | 5(20.0) | 9(14.8) | 0.550 |
| 无 | 20(80.0) | 52(75.2) | |
| 额外异常染色体 有 | 1(4.0) | 2(3.3) | 1 |
| 无 | 24(96.0) | 59(96.7) | |
| 诊断至伊马替尼 治疗时间(月) | 26(2~92) | 0(0~36) | 0.000 |
取患者骨髓2mL, 用直接法和/或不加植物血凝素的短期培养法制备染色体标本, 应用R显带技术显带后进行核型分析。每个患者分析中期分裂相20~40个, 按照人类细胞遗传学国际命名体制进行染色体核型报告。
1.3 实时定量PCR检测BCR-ABL融合基因骨髓血单个核细胞分离, 用Trizol(美国Invitrogen公司)提取总RNA, 应用随机引物和逆转录酶试剂盒(大连TaKaRa公司)逆转录合成cDNA第一链, 按操作说明进行。BCR-ABL mRNA扩增引物和探针参照北京大学人民医院血液病研究所序列[7]。
1.4 统计学处理采用SPSS 16.0统计软件处理。两组患者临床特点比较采用卡方检验, 所有数据均采用中位数(范围)[M(min~max)]表示。治疗反应累积发生率采用Kaplan-Meier方法, 比较用log-rank检验。P<0.05为差异有统计学意义。
2 结果 2.1 两组患者一般情况比较两组患者的临床特征包括性别、年龄、血小板数及有无脾大、外周血原始细胞和额外异常染色体差异均无统计学意义, 见表1。
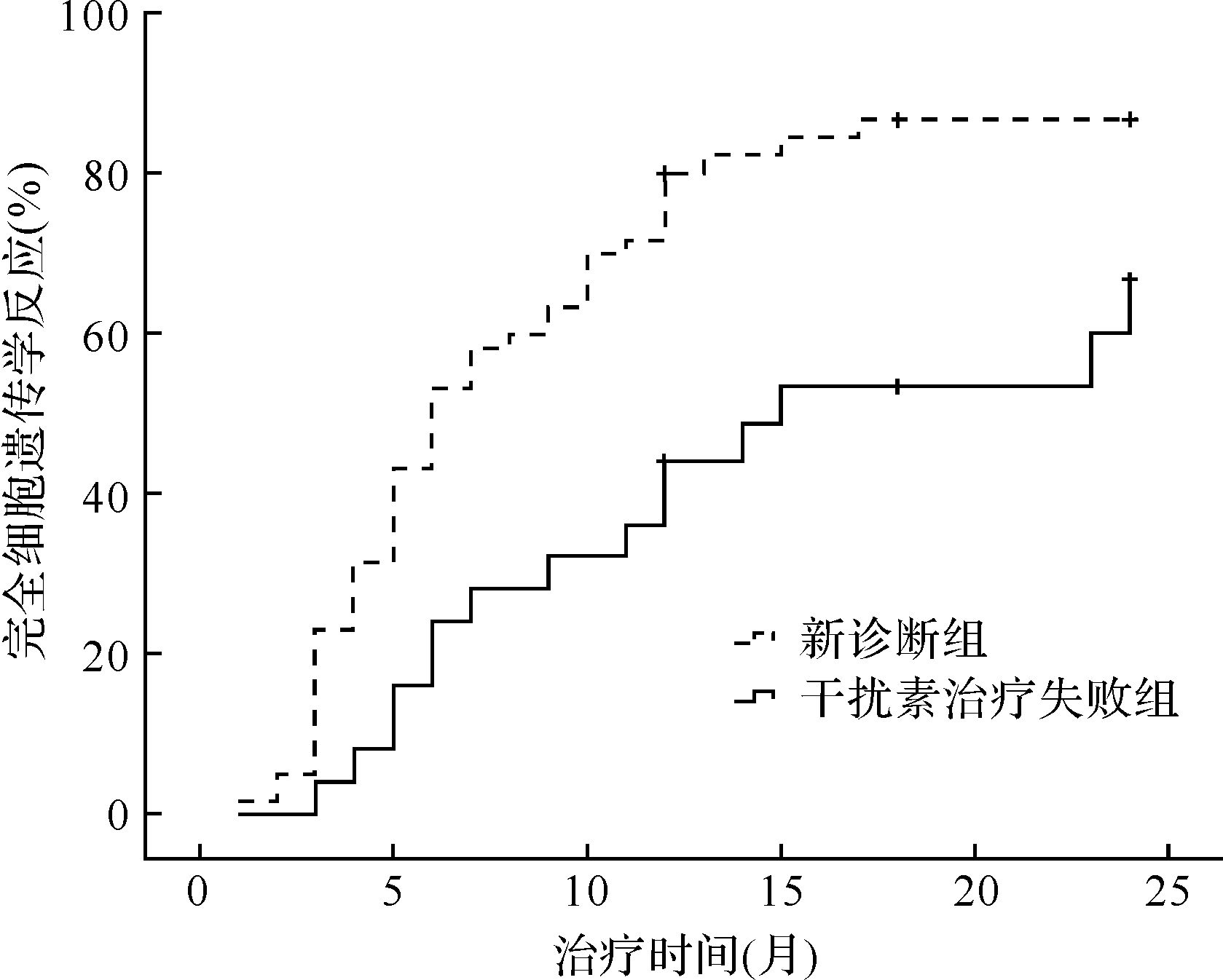
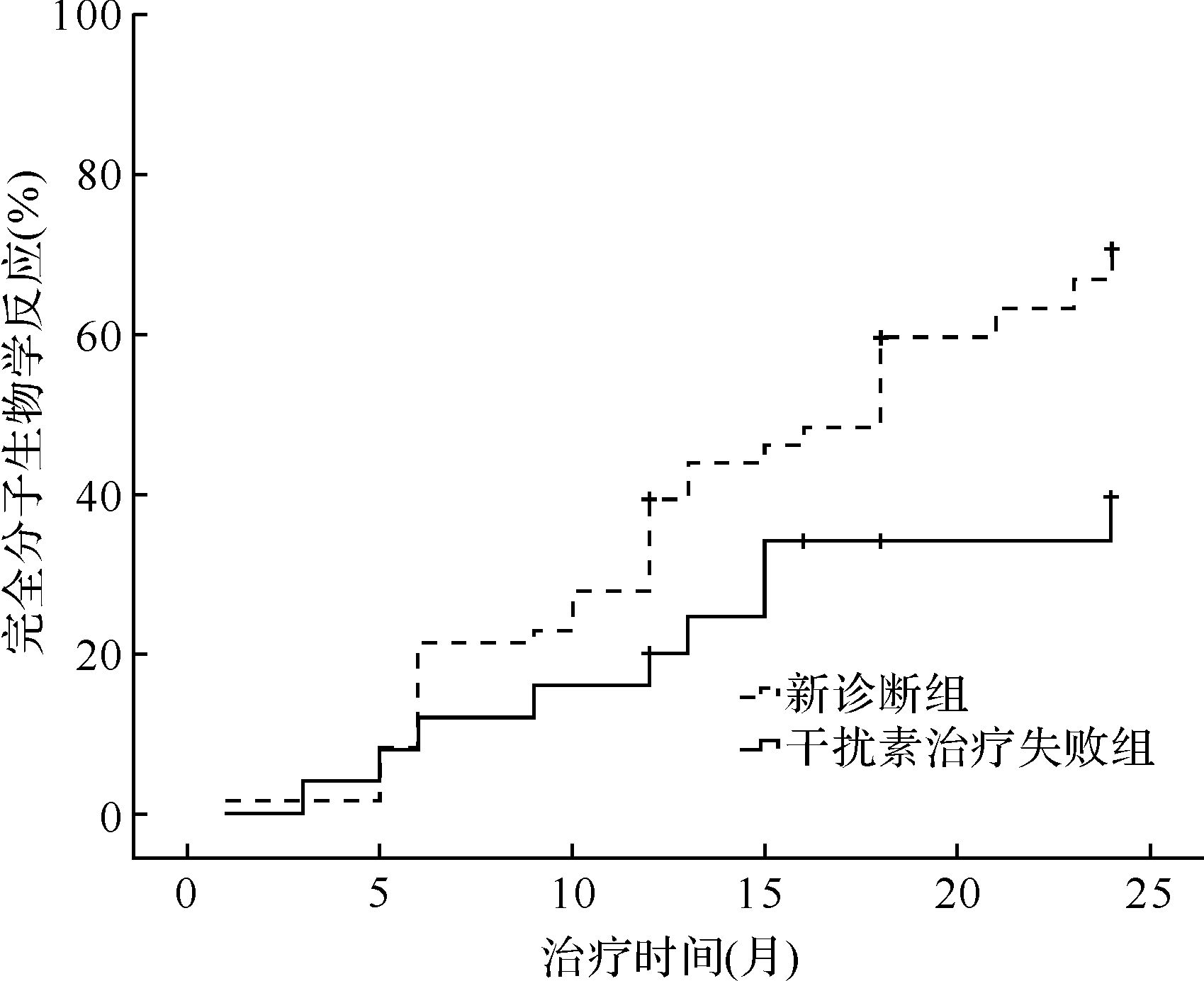
2.2 两组患者治疗后细胞遗传学和分子生物学反应比较治疗24个月时, 新诊断组和干扰素治疗失败组CML患者获得部分细胞学反应分别为57/61(93.4%)和23/25(92.0%), 差异无统计学意义(P>0.05)。但在新诊断组中, 有50/61(81.9%)患者治疗6个月时就获得部分细胞学反应, 而干扰素治疗失败组仅为9/25(36.0%)。新诊断组和干扰素治疗失败组患者获得完全细胞学反应的患者分别为53/61(86.9%)和17/25(68.0%), 两者差异有统计学意义(P<0.001)。新诊断组和干扰素治疗失败组患者达到完全细胞学反应的中位时间分别为5个月(1~17个月)和10个月(3~34个月), 差异有统计学意义(P=0.001), 见图1。新诊断组和干扰素治疗失败组患者获得完全分子生物学反应分别为43/61(70.4%)和10/25(40.0%), 差异有统计学意义(P=0.033), 见图2。
|
| 图1 新诊断组和干扰素治疗失败组患者完全细胞遗传学反应比较 Fig.1 Complete cytogenetic response in patients receiving imatinib as initial treatment versus those after failure of IFN-α2b |
|
| 图2 新诊断组和干扰素治疗失败组患者完全分子生物学反应比较 Fig.2 Complete molecular response in patients receiving imatinib as initial treatment versus those after failure of IFN-α2b |
两组患者中有28例是细胞遗传学耐药, 其中新诊断组为14例(22.9%), 原发性细胞遗传学耐药有4例(6.6%); 干扰素治疗失败组为14例(56.0%), 均为原发性细胞遗传学耐药。表明干扰素治疗失败的患者对伊马替尼的耐药率显著高于新诊断组(P=0.003)。
2.4 两组患者治疗后毒副作用比较两组患者的血液学和非血液学毒副作用相似。主要是水钠潴留, 新诊断组和干扰素治疗失败组分别为67.0%和68.7%; 腹泻分别为30.0%和28.3%; 肌肉酸痛分别为22.2%和24.1%。但干扰素治疗失败组患者出现Ⅲ~Ⅳ级贫血和白细胞减少显著多于新诊断组, 见表2。
| [n(%)] | |||
| 指标 | 干扰素治疗失败组 (n=25) | 新诊断组 (n=61) | P值 |
| 血红蛋白<79g/L | 3(12.0) | 0(0) | 0.022 |
| 白细胞数<1.9×109/L | 8(32.0) | 3(4.9) | 0.002 |
| 血小板数<49×109/L | 7(28.0) | 7(11.5) | >0.05 |
细胞遗传学和分子生物学反应是衡量伊马替尼治疗CML患者疗效的主要指标。按照《中国CML诊断与治疗指南(2013年版)》标准[5], 应用400mg的伊马替尼治疗CML慢性期患者最佳反应是6个月时达到部分细胞学反应, 12个月达到完全细胞学反应。我们的研究发现, 干扰素治疗失败的CML患者使用伊马替尼治疗未达到最佳反应的标准。上述指南认为在任何时候获得主要分子生物学反应属于最佳反应, 本文资料表明, 干扰素治疗失败组患者应用400mg的伊马替尼治疗疗效较新诊断患者差。Kantarjian等[8]报道, 400mg伊马替尼治疗新诊断和干扰素失败或者不耐受的CML患者细胞遗传学反应在3、6、9个月时均有明显差异。其中, 6个月时获得部分细胞学缓解的患者分别为80.0%和28.0%, 与本研究结果相似。
虽然主要分子生物学反应和完全细胞学反应是CML疗效的主要标准[5], 但近年来的研究表明, 达到深层次的分子生物学反应包括完全分子生物学反应患者有较好的长期无病生存转归[9]。我们的资料表明, 新诊断患者伊马替尼治疗获得完全分子生物学反应远远多于干扰素治疗失败组患者, 进一步提示CML患者应尽早应用伊马替尼作为一线治疗。
本文资料表明, 干扰素治疗失败组患者细胞遗传学耐药比例显著高于新诊断组, 分别为56.0%和22.9%。干扰素治疗失败组患者疗效差的原因尚不明了, 我们推测可能与CML病程长短有关。理由如下: (1)新近研究表明应用伊马替尼治疗3个月时, BCR-ABL融合基因≤10%的患者5年内获得累积主要分子生物学反应比例显著高于BCR-ABL融合基因>10%的患者[9], 说明越早获得较深程度分子生物学反应, 疗效越好; (2)BCR-ABL融合基因的异常扩增或基因突变可导致丝裂原活化蛋白激酶(MAPK)、STAT和PI3K/AKT激活信号途径异常激活, 是伊马替尼耐药的主要机制之一[6, 10, 11]。文献报道, CML患者处于晚期慢性期的基因突变发生率为17%, 而处于早期慢性期的突变发生率仅为6.6%[12]。其中CML慢性期患者接受伊马替尼治疗前病史在12个月或以上的称晚期慢性期, 而应用伊马替尼作为初始治疗的称早期慢性期[13]。本研究中, 新诊断组患者平均病程为3.7个月; 而干扰素治疗失败组患者大多数符合晚期慢性期标准, 平均病程为30.6个月。尽管本研究中的患者没有检测基因突变, 但干扰素治疗失败组患者病程长, 可能有较高的BCR-ABL基因突变率。
以往对伊马替尼治疗疗效不佳者增加伊马替尼剂量到600mg/d, 甚至800mg/d。但目前认为对治疗反应次佳以及失败的患者应及时行BCR-ABL激酶区突变检测, 适时更换第二代TKI治疗[5]。由于伊马替尼剂量增加会导致血液学毒性增加[14], 本研究中的干扰素治疗失败组患者Ⅲ~Ⅳ级的贫血和白细胞减少例数显著多于新诊断组, 因此, 对治疗反应次佳以及失败的患者不适合通过增加伊马替尼剂量来提高疗效。
综上所述, 应用400mg 伊马替尼治疗CML, 与新诊断患者相比, 干扰素治疗失败或者不耐受者原发性细胞遗传学耐药发生率高, 6个月和12个月获得最佳反应患者比例低。另一方面, 干扰素治疗失败组患者服用伊马替尼的Ⅲ~Ⅳ级贫血和白细胞减少例数也多于新诊断组。因此, 建议CML患者应及早使用伊马替尼治疗, 对干扰素治疗失败或者不耐受者应及时行BCR-ABL激酶区突变检测, 适时更换第二代TKI治疗。
| [1] | JABBOUR E, CORTES J, RAVANDI F, et al.Targeted therapies in hematology and their impact on patient care: chronic and acute myeloid leukemia [J].Semin Hematol, 2013, 50(4):271-283. |
| [2] | VAN ETTEN. Mechanisms of transformation by the BCR-ABL oncogene: new perspectives in the post-imatinib era[J]. Leuk Res, 2004, 28 Suppl 1: S21-28. |
| [3] | JABBOUR E J, CORTES J E, KANTARJIAN H M.Resistance to tyrosine kinase inhibition therapy for chronic myelogenous leukemia: a clinical perspective and emerging treatment options [J].Clin Lymphoma Myeloma Leuk, 2013, 13(5):515-529. |
| [4] | DEININGER M, BUCHDUNGER E, DRUKER B J. The development of imatinib as a therapeutic agent for chronic myeloid leukemia[J]. Blood, 2005, 105(7): 2640-2653. |
| [5] | 中华医学会血液学分会.中国慢性髓性白血病诊断与治疗指南(2013年版)[J].中华血液学杂志, 2013, 34(5):464-470.Chinese Society of Hematology, Chinese Medical Association.Guideline for management of chronic myeloid leukemia (2013) [J]. Chinese Journal of Hematology, 2013, 34(5):464-470. (in Chinese) |
| [6] | BACCARANI M, SAGLIO G, GOLDMAN J, et al. Evolving concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf of the European Leukemia Net[J]. Blood, 2006, 108(6):1809-1820. |
| [7] | QIN Y Z, LIU Y R, ZHU H H, et al. Different kinetic patterns of BCR-ABL transcript levels in imatinib-treated chronic myeloid leukemia patients after achieving complete cytogenetic response[J]. Int J Lab Hematol, 2008, 30(4):317-323. |
| [8] | KANTARJIAN H M, CORTES J E, OBRIEN S, et al.Imatinib mesylate therapy in newly diagnosed patients with Philadelphia chromosome-positive chronic myelogenous leukemia: high incidence of early complete and major cytogenetic responses[J]. Blood, 2003, 101(1):97-100. |
| [9] | MAHON F X, ETIENNE G. Deep molecular response in chronic myeloid leukemia: the new goal of therapy? [J]. Clin Cancer Res, 2014, 20(2):310-322. |
| [10] | KANTARJIAN H M, GILES F, QUINTAS-CARDAMA A, et al.Important therapeutic targets in chronic myelogenous leukemia[J]. Clin Cancer Res, 2007, 13(4):1089-1097. |
| [11] | TONG Y, LIU Y Y, YOU L S, et al. Perifosine induces cytoprotective autophagy and upregulation of ATG5 in human chronic myelogenous leukemia cells[J]. Acta Pharmacol Sin, 2012, 33(4):542-550. |
| [12] | VILLUENDAS R, STEEGMANN J L, POLLAN M,et al. Identification of genes involved in imatinib resistance in CML: a gene-expression profiling approach[J]. Leukemia, 2006, 20(6):1047-1054. |
| [13] | PALANDRI F, IACOBUCCI I, QUARANTELLI F, et al. Long-term molecular responses to imatinib in patients with chronic myeloid leukemia: comparison between complete cytogenetic responders treated in early and in late chronic phase[J]. Haematologica, 2007, 92(11):1579-1580. |
| [14] | ZONDER J A, PEMBERTON P, BRANDT H, et al. The effect of dose increase of imatinib mesylate in patients with chronic or accelerated phase chronic myelogenous leukemia with inadequate hematologic or cytogenetic response to initial treatment [J]. Clin Cancer Res, 2003, 9(6):2092-2097. |



