2. 嘉兴市第二医院血液科, 浙江 嘉兴 314000
2.Department of Hematology, Jiaxing Second Peoples Hospital, Jiaxing 314000, China
急性髓系白血病( acute myeloid leukemia,AML)是成人急性白血病最常见的一种类型,在分子生物学特点、临床治疗反应等方面具有明显的异质性。联合化疗、造血干细胞移植和支持治疗等手段极大改善了AML患者的预后,但仍存在治疗相关毒副作用大、治疗效果不理想和复发率高等诸多问题,促使研究者致力于探索更具靶向性的治疗方法。
细胞周期蛋白依赖激酶(cyclin-dependent kinases,CDKs)是一组丝氨酸/苏氨酸蛋白激酶,按其功能主要分成两大类:调控细胞周期的CDK和调控RNA转录的CDK,后者包括CDK7和CDK9,这两者参与调控RNA聚合酶Ⅱ羧基末端结构域磷酸化,而RNA聚合酶Ⅱ则是参与调节microRNA(miR)基因转录的主要因子[1, 2, 3, 4]。近年来研究发现,抑制CDK不仅抑制肿瘤细胞增殖,还能诱导细胞凋亡。Walsby等[5]报道选择性CDK抑制剂SNS-032对AML细胞有明显杀伤作用,但其机制仍不明确。本研究通过流式细胞术、microRNA芯片技术、蛋白质印迹法等观察SNS-032对人AML HL-60细胞凋亡的作用、microRNA表达谱的改变和Janus激酶2/信号转导和转录激活因子3(Janus kinase 2/signal transducer and activator of transcription 3,JAK2/STAT3)通路的影响,并用JAK2/STAT3通路激活剂白细胞介素6(IL-6)进行干预,进一步对可能的分子机制进行初步探讨。
1 材料与方法 1.1 材料人AML细胞株HL-60由浙江大学血液病研究所保存。10%胎牛血清和RPMI 1640培养基购自美国Gibco公司;SNS-032购自美国Selleck化学有限公司; Trizol试剂盒购自美国Invitrogen公司;miRNeasyMini Kit购自美国QIAGEN公司;β-Actin单克隆抗体购自美国Sigma公司。JAK2、磷酸化STAT3(p-STAT3)、 STAT3、C-MYC和MCL-1单克隆抗体购于美国Cell Signaling公司;ECL Western-blotting luminal试剂盒购于以色列Biological Industries公司; BCA蛋白定量试剂盒购于上海生工生物工程技术服务有限公司;辣根标记山羊抗兔IgG( H+L )和辣根标记山羊抗鼠IgG( H+L )购于杭州联科生物有限公司;显影粉、定影粉购自中美华东医药股份有限公司。
1.2 细胞培养及分组HL-60细胞悬浮生长于含10%胎牛血清的RPMI 1640培养液中,于37℃、5%二氧化碳培养箱中培养,2~3天换液传代一次。取对数生长期的细胞为实验对象。实验细胞分为对照组、终浓度为100 nmol/L的 SNS-032组、终浓度为20 ng/mL的 IL-6组和上述浓度的SNS-032+IL-6联合组。
1.3 流式细胞术检测细胞凋亡HL-60细胞以2×105/mL接种于24孔板,分别加入不同浓度的SNS-032(0、100 nmol/L和200 nmol/L)孵育24h后收集细胞,用冷磷酸盐缓冲液洗涤2次,4℃ 300×g离心7min,弃上清液。将细胞重悬于1mL 1×结合缓冲液,取100 μL细胞置于试管中,加5μL Annexin V-FITC和5μL碘化丙碇(PI),轻轻混匀,室温避光反应15min,加入300μL 1×结合缓冲液,立即用流式细胞仪检测,Cellquest 1.2软件分析结果。
1.4 MTT法检测细胞存活率取对数生长期细胞,新鲜培养液洗涤后,重悬于含10%胎牛血清的RPMI 1640培养液中,以2~5×105个细胞/mL的终浓度接种于96孔板,分别加入1.2所述浓度的SNS-032、IL-6、或联合加入SNS-032和IL-6,对照组用无血清RPMI 1640,每孔总体系0.2mL,处理24h,加MTT工作液20 μL/孔(终浓度0.5mg/mL),置37℃、5%二氧化碳培养箱中孵育4h,300 ×g离心,小心吸弃上清液,加入二甲亚砜0.2mL/孔,吹打,使紫蓝色甲臜沉淀充分溶解。在酶标仪570nm波长处读取吸光度值,计算细胞存活率。细胞存活率=(实验组吸光度值-空白组吸光度值)/(对照组吸光度值-空白组吸光度值)×100%。实验重复3次,每次设复孔3个,取平均值为最终结果。
1.5 芯片技术分析microRNA表达谱的变化按照Trizol试剂盒和miRNeasy试剂盒说明书,分别提取各组HL-60细胞的总RNA。利用Nanodrop于波长为 230nm、 260nm与280nm 处测定上述RNA吸光度值,对总RNA进行定量测定,通过计算260nm和280nm处的吸光度比值以及甲醛变性凝胶电泳,分析RNA质量,用于microRNA芯片检测。芯片实验和分析委托上海康成生物工程有限公司完成。采用丹麦Exiqon公司第六代microRNA芯片检测microRNA表达谱。各组实验均重复3次。与对照组相比,SNS-032作用后microRNA表达上调1.2倍或下调超过20%为差异表达。
1.6 蛋白质印迹法检测JAK2/STAT3相关蛋白表达收集药物处理后HL-60细胞5×106个,离心,弃上清液,用预冷磷酸盐缓冲液洗涤2次,加细胞裂解液120-160μL,反复吹打,置冰上,用超声波细胞粉碎机处理(160w,持续3s,间隔5s,共3次),至溶液不再黏稠,4℃ 700×g离心10 min,取上清液,BCA蛋白定量试剂盒测蛋白质浓度后备用。制胶后,每孔加入30μg总蛋白进行SDS-PAGE电泳,电泳结束后按半干法将电泳产物转印到PVDF膜上。5%脱脂牛奶室温封闭2h,加一抗(1∶1000稀释),4℃过夜,TBST洗膜3次,每次10min,加二抗(1∶5000稀释),室温孵育2h,TBST洗膜10min×3次后,加ECL试剂在室温反应1 min 后,曝光到 X线胶片上,在暗室中一次性完成显影、定影。
1.7 统计学分析采用Prism 4软件进行统计。计量资料以均数±标准差(±s)表示。两两比较采用Dunnett-t检验。以P<0.05为差异有统计学意义。
2 结 果 2.1 SNS-032对HL-60细胞凋亡的影响流式细胞术检测结果显示,加入SNS-032干预后HL-60细胞凋亡率增加。对照组、100nmol/L和200nmol/L SNS-032干预组细胞凋亡率分别为(5.9±1.7)%、(12.1±3.1)%和(59.4±3.6)%。
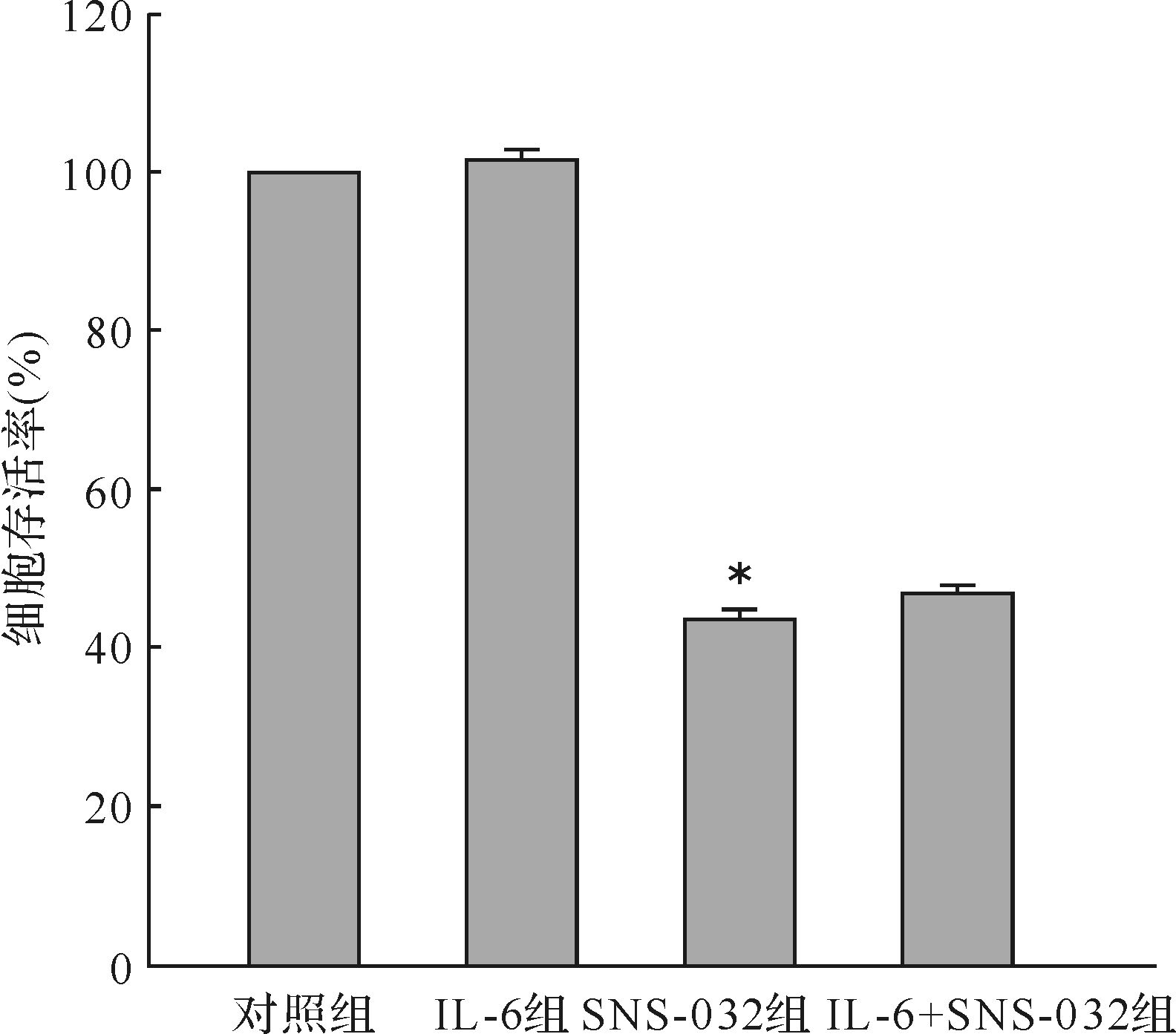
2.2 SNS-032对HL-60细胞存活率的影响100 nmol SNS-032作用HL-60细胞24 h后,HL-60细胞存活率明显下降(P<0.05);联合IL-6后不能逆转SNS-032对细胞存活率的抑制作用(P>0.05)。见图1。
|
| SNS-032组与对照组比较,*P<0.05. 图1 各组HL-60细胞存活率的比较 Fig.1 Comparison of the cell viability of HL-60 cells in different groups |
microRNA芯片分析结果显示:SNS-032下调HL-60细胞miR-30a、miR-183、miR-20b、miR-26b、miR-20a、miR-589、miR-107、miR-181a、miR-106a、miR-17和miR-378c的表达,上调miR-320a和miR-H7*的表达。
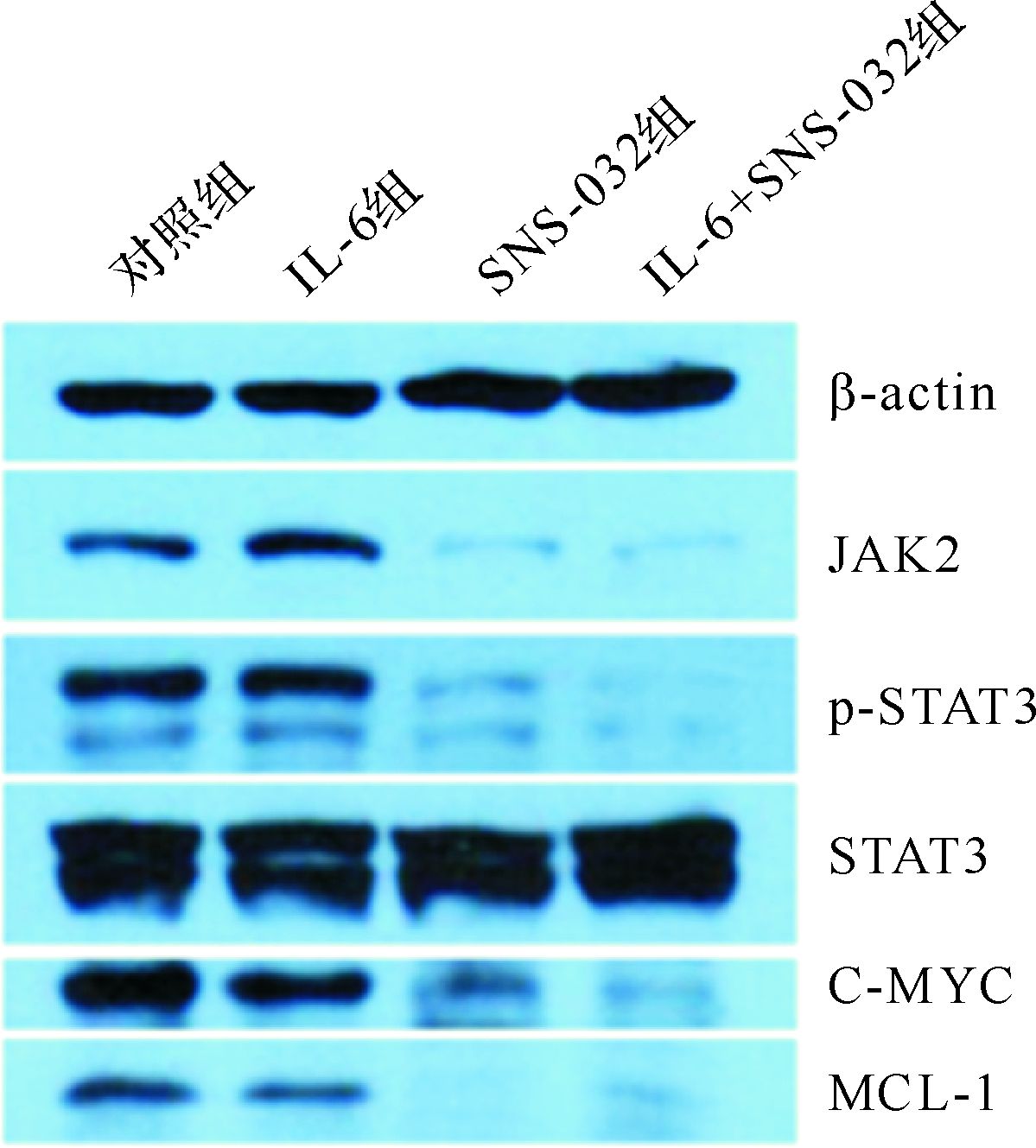
2.4 SNS-032对JAK2/STAT3通路相关因子的作用miR-20a和miR-17属于miR-17-92基因簇,而miR-17-92与JAK2/STAT3调控密切相关。从上述结果可知,SNS-032下调miR-20a和miR-17的表达,进一步采用蛋白质印迹法检测,结果SNS-032显著抑制JAK2蛋白的表达和其下游STAT3的磷酸化水平,IL-6并不能逆转SNS-032对HL-60细胞JAK2和磷酸化STAT3的抑制作用;同时,SNS-032对MCL-1和C-MYC蛋白也有抑制作用,见图2。
|
| 图2 各组细胞JAK2/STAT3通路相关蛋白表达 Fig.2 The protein expressions of JAK2/STAT3 pathway in different groups |
SNS-032是一种新型选择性CDK抑制剂,能抑制调控RNA转录的CDK,包括CDK7和CDK9的活性。2011年,Walsby 等[5]报道SNS-032能有效诱导HL-60、NB4细胞株及原代AML细胞凋亡,其机制是下调CDK2、CDK7和CDK9,进而抑制RNA聚合酶Ⅱ羧基末端结构域第二位和第五位丝氨酸磷酸化,导致Caspase-3激活和细胞凋亡。我们的实验结果证实了SNS-032显著诱导HL-60细胞凋亡。由于CDK7和CDK9参与调节microRNA基因的转录[6, 7],因此,我们研究了SNS-032干预HL-60细胞后microRNA表达谱的变化。结果表明,SNS-032显著下调HL-60细胞的11种microRNA,其中miR-20a和miR-17等与AML密切相关,而miR-20a和miR-17属于miR-17-92基因簇,该基因簇位于染色体13q31区,含有6个microRNA(miR-17、 miR-18a、 miR-19a、 miR-20a、 miR-19b和miR-92)。近年来研究表明miR-17-92是肿瘤治疗的新靶点,在混合型白血病基因重排中高表达[8, 9],文献报道其高表达的原因有:①基因扩增;②MYC和/或STAT3介导其转录增加[10, 11]。基于上述理由,我们研究了SNS-032调控miR-17-92的可能机制。本研究结果显示,SNS-032作用于HL-60细胞株后抑制JAK2蛋白表达和下游STAT3的磷酸化,还抑制MCL-1和C-MYC蛋白的表达。
IL-6在JAK/STAT3通路的激活中起着非常重要的作用[12]。本实验结果还发现,IL-6不能逆转SNS-032对HL-60细胞的杀伤,也不能逆转其对JAK2蛋白和磷酸化STAT3的抑制作用。Walsby 等[5]分析了SNS-032对87例AML患者原代白血病细胞的抑制作用,发现SNS-032的杀伤效应不受FAB分型、既往治疗、FLT3突变状态和核仁磷酸蛋白1(NPM1)突变状态的影响。这些结果提示SNS-032能克服AML的高危因素。
综上所述,SNS-032作为一种新型选择性CDK抑制剂能显著诱导HL-60细胞凋亡,其机制可能与抑制JAK2和STAT3磷酸化、抑制MCL-1和C-MYC及与之相关的miR-17-92基因簇表达水平有关,但其具体机制还有待于进一步深入的研究。
| [1] | ASGHAR U, WITKIEWICZ A K, TURNER N C, et al. The history and future of targeting cyclin-dependent kinases in cancer therapy [J]. Nat Rev Drug Discov, 2015, 14(2):130-146. |
| [2] | KUMAR S K, LAPLANT B, CHNG W J, et al. Dinaciclib, a novel CDK inhibitor, demonstrates encouraging single-agent activity in patients with relapsed multiple myeloma [J]. Blood, 2015, 125(3):443-448. |
| [3] | DICKSON M A. Molecular pathways: CDK4 inhibitors for cancer therapy [J]. Clin Cancer Res, 2014, 20(13):3379-3383. |
| [4] | CHEN R, WIERDA W G, CHUBB S, et al. Mechanism of action of SNS-032, a novel cyclin-dependent kinase inhibitor, in chronic lymphocytic leukemia [J]. Blood, 2009, 113(19): 4637-4645. |
| [5] | WALSBY E, LAZENBY M, PEPPER C, et al. The cyclin-dependent kinase inhibitor SNS-032 has single agent activity in AML cells and is highly synergistic with cytarabine [J]. Leukemia, 2011, 25(3): 411-419. |
| [6] | LEE Y, AHN C, HAN J, et al. The nuclear RNase III Drosha initiates microRNA processing [J]. Nature, 2003, 425(6956): 415-419. |
| [7] | DENLI A M, TOPS B B, PLASTERK R H, et al. Processing of primary microRNAs by the Microprocessor complex [J]. Nature, 2004, 432(7014): 231-235. |
| [8] | LI Z, LU J, SUN M, et al. Distinct microRNA expression profiles in acute myeloid leukemia with common translocations [J]. Proc Natl Acad Sci USA, 2008, 105(40): 15535-15540. |
| [9] | DIXON-MCIVER A, EAST P, MEIN C A, et al. Distinctive patterns of microRNA expression associated with karyotype in acute myeloid leukaemia [J]. PLoS One, 2008, 3(5): e2141. |
| [10] | JIN H Y, LAI M, XIAO C. microRNA-17~92 is a powerful cancer driver and a therapeutic target [J]. Cell Cycle, 2014, 13(4):495-496. |
| [11] | XIANG J, WU J. Feud or friend? The role of the miR-17-92 cluster in tumorigenesis [J]. Curr Genomics, 2010, 11(2): 129-135. |
| [12] | CHANG Q, BOURNAZOU E, SANSONE P, et al. The IL-6/JAK/STAT3 feed-forward loop drives tumorigenesis and metastasis [J]. Neoplasia, 2013, 15(7): 848-862. |



