| 柚果面枝孢菌斑点病病原鉴定 |
2. 梅州市农业科学院,广东 梅州 514021
2. Institute of Agricultural Sciences of Meizhou, Meizhou 514021, Guangdong, China
枝孢属(Cladosporium Link)真菌广泛分布于全球, 几乎在任何环境中都可以发现这类真菌[1-3]。许多枝孢属真菌是腐生菌, 可经常从土壤和腐烂的植物材料上分离得到, 然而一些枝孢属真菌是植物的重要病原物, 主要侵染叶片, 也可以侵染植物枝条和果实, 造成植物产量降低, 品质变劣, 带来严重的经济损失[1]。此外, 还有一些枝孢属真菌可以侵染动物甚至人类, 引起疾病[4-6]。
枝孢属真菌的形态特征变化范围大, 不同种类的形态特征重叠较大, 种类鉴定比较困难[3-7]。因此, 一些常见的种类被认为是复合种, 如枝状枝孢(C. cladosporioides)、多主枝孢(C. herbarum/sphaerospermum)等[7]。应用多基因片段的系统学分析表明, 许多形态相似的种类(复合种)可以分为多个系统学种。目前, 已经超过170个形态学种通过分子生物学方法进行了研究, 结合形态特征, 被重新检查定义。采用形态学与分子生物学相结合的方法, 对来源于不同基质、不同环境中的枝孢属真菌的多样性进行研究是目前此类真菌的研究热点之一, 并不断有新种被发现[1, 3-4]。
芸香科植物中的柑橘是世界上最重要的果树之一。据报道, 从芸香科植物上分离到的枝孢属真菌种类已经有10个, 其中有3个是植物病原菌。一般认为, 拟芸香枝孢霉(C. haplophylli)是寄生拟芸香属(Haplophyllum)植物的专性寄生菌, 芸香枝孢霉(C. rutae)是寄生芸香属(Ruta)植物的专性寄生菌, 皱面枝孢霉(C. corrugatum)是柑橘属的专性寄生菌。而多米尼加枝孢(C. dominicanum)、耐盐枝孢霉(C. halotolerans)、多主枝孢(C. herbarum)、伊朗枝孢霉(C. iranicum)、尖孢枝孢(C. oxysporum)、球孢枝孢(C. sphaerospermum)和极细枝孢(C. tenuissimum)以腐生为主, 但经常作为次生侵染物, 在植物组织老化或受伤情况下, 入侵死亡的细胞和组织。而有关我国柑橘上的枝孢属真菌的研究很少。
柚[Citrus grandis Osbeck, Syn. C. maxima (Burm.) Merr.]是我国重要的柑橘类水果(包括宽皮类柑橘、橙、柚、柠檬、金橘和佛手)之一, 产品以鲜销为主, 果实的外观品质对果品的价格影响很大。已知柚果实果面主要病害有黑点病(Diaporthe citri, 也称砂皮病)、黑斑病(Phyllosticta citriasiana)和脂斑病(Zasmidium spp.)[8-9], 然而我们在走访果园和进行市场调查时, 还时常可发现一种不同于上述3种病害的斑点病, 因此, 我们对这类斑点病的病斑菌进行了分离培养, 采用形态学和分子生物学相结合的方法, 对获得的20株疑似枝孢菌菌株进行了鉴定。
1 材料与方法 1.1 标本来源与分离培养在2015年11月-2016年2月间, 从我国广东、广西、福建等省(自治区)的沙田柚和琯溪蜜柚上采集具有典型病斑的果实共计60个, 带回实验室进行病菌分离培养。分离所使用的培养基为常规马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基和合成低营养琼脂(synthetic low-nutrient agar, SNA)培养基, 其中SNA培养基的配方为KH2PO4 1 g, KNO3 1 g, MgSO4·7H2O 0.5 g, KCl 0.5 g, 葡萄糖0.2 g, 蔗糖0.2 g, 琼脂15 g, 加水定容至1 000 mL, 高温灭菌, 备用。
由于大部分病斑上都没有明显的子实体, 病菌的分离采取组织分离法:将果面用清水洗净, 吸水纸擦干, 用75%乙醇棉球反复擦洗病斑, 待乙醇挥发后, 用灭菌的手术刀从病斑的边缘取小块组织(0.2 cm×0.2 cm), 置于含有质量浓度各为0.1 mg/ mL的氨苄青霉素和硫酸链霉素的PDA平板中央, 培养7 d, 待有菌落长出后, 挑取菌落边缘菌丝进行培养, 待其产孢后进行单孢分离纯化。将获得的纯化菌株编号并保存在PDA斜面试管中, 在4℃冰箱中贮藏, 待用。
1.2 菌株的形态特征和培养特性观察从斜面中挑取菌株接种到PDA平板上, 于24℃培养箱内培养14 d后, 从菌落边缘取直径为5 mm的菌饼, 移至直径为9 cm的PDA、SNA培养基平板上, 于24℃培养箱内培养14 d后, 观察菌落的颜色、形状, 用十字交叉法测量菌落直径, 计算菌丝生长速率。各菌株产孢结构和形态显微观测按照BENSCH等[3]的方法进行, 利用光学显微镜观察分生孢子梗和分生孢子形态特征, 测量其大小并进行显微拍摄[1, 7]。
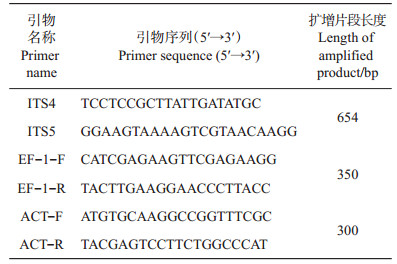
1.3 DNA提取与序列分析从培养7 d的PDA平板上用灭菌手术刀刮取足量的菌丝, 置于离心管内, 采用改进的CTAB法提取DNA, 贮藏于-20℃冰箱中, 待用[8]。采用真菌核糖体rDNA通用引物ITS4/ITS5、真菌转录延长因子基因通用引物EF-1-F/EF-1-R和微丝蛋白基因通用引物ACT-F/ACT-R对分离得到的菌落进行相应的序列扩增; 引物由擎科生物公司合成, 序列见表 1。PCR反应体系:DNA模板1 μL, 上下游引物各0.5 μL, 2 × MasterMix 12.5 μL, 补充无菌水至25 μL。PCR反应程序:94℃预变性5 min; 94℃变性30 s, 退火30 s(退火温度:ITS 58℃, EF 55℃, ACT 61℃), 72℃延伸30 s, 循环35次; 72℃延伸10 min, 4℃保存。PCR产物送至擎科生物公司进行测序, 测序结果用DNAman软件进行初步编辑和对比, 后提交至GenBank与相关序列进行同源性比较, 构建系统发育树。
| 表1 研究中所用的引物 Table 1 Primers used in this research |
 |
| 点击放大 |
将测序获得的3种序列经Bioedit校正后联合排列, 采用ClustalX[10]和Bioedit[11]软件进行分析。采用PAUP 4.0b10[12]软件的非加权简约法进行系统进化树的构建。系统树分支的稳定性采用重复1 000次的自举法(bootstrap)进行评估[13]。
1.5 致病性测定供试的极细枝孢(C. tenuissimum)菌株为GDMZ9和GDMZ29, 散黄枝孢霉(C. xantochromaticum)菌株为GX23和GDMZ32, 在PDA平板上培养7 d, 接种对象为健康无病的琯溪蜜柚。首先用体积分数为2%的洗洁精浸泡果实5 min, 清水充分冲洗, 擦干, 再用75%乙醇对全果进行表面擦拭消毒, 置于超净工作台上, 待乙醇挥发完后, 用灭菌的接种针刺3~5个深度约2 mm的伤口, 然后将直径为5 mm的菌饼的菌丝面朝下贴至伤口处, 对照组贴上相同直径的PDA培养基。将接种后的果实罩上干净的保鲜袋, 在25℃条件下光暗交替保湿培养, 15 d后观察症状出现情况, 并从接种的发病病斑上再次分离病原。每组3次重复, 整个接种试验重复2次。
2 结果与分析 2.1 柚果面枝孢菌斑点病的症状病斑多出现在已转色的果实上, 病斑初始为芝麻粒大小, 近圆形或不规则形, 红褐色小点, 病斑稍凹陷, 后期病斑中央逐渐变为黑褐色, 凹陷更明显(图 1)。在潮湿环境下病斑上可见少量的黑色霉层。病斑仅限于果皮, 不深入白皮层和囊瓣而造成腐烂, 因此, 仅影响果实的外观品质和商品性。
 |
| A:田间整果症状; (B~C):田间症状放大图; D:接种极细枝孢症状图; E:接种散黄枝孢霉症状图; F:空白琼脂块接种结果(框中为刺伤处)。 A:Field symptoms of fruit spot disease; B and C:Enlarged figures of field symptoms; D:Symptoms of fruit spot disease caused by C. tenuissimum; E:Symptoms of fruit spot disease caused by C. xantochromaticum; F:Control inoculated by blank agar (Black spot in square frame indicates the puncture site). 图1 柚果田间症状和菌株致病性接种症状 Fig. 1 Symptoms of fruit spot disease on C. grandis and the pathogenicity of the pathogen on fruits |
从60个带病果实的发病部位共分离到93个菌株。根据菌落形态, 结合标本来源分布, 选择21株代表性菌株进行进一步研究。基于分生孢子形态特征的初步镜检结果, 确定20个菌株为枝孢属(Cladosporium)真菌(表 2)。
| 表2 本研究的菌株来源和序列信息 Table 2 Source of fungal strains and sequence information used in this research |
 |
| 点击放大 |
用极细枝孢(C. tenuissimum)和散黄枝孢霉(C. xantochromaticum)这2个菌株分别接种琯溪蜜柚果实后, 均可引起发病, 接种点的发病率为100%。接种7 d后即可见刺伤处出现红褐色、略凹陷的病斑, 到接种15 d后, 病斑有所扩展, 颜色有所加深, 凹陷更为明显。病斑仅限于果皮, 不深入白皮层和囊瓣, 症状与田间观察到的(图 1)基本一致。从接种发病的部位可分离获得与接种相一致的真菌, 完成了柯赫氏法则验证。
2.4 柚果枝孢斑点病病原菌的形态特征对分离到的20个枝孢属真菌菌株的形态进行研究发现, 可以将其分为2个组。第1组包括18个菌株, 在PDA培养基、25℃条件下培养2周后的菌落直径达8.2~8.7 cm, 呈橄榄色至深褐色, 表面呈绒毛状。在显微镜下观察发现, 其形态特征(图 2)与极细枝孢(C. tenuissimum)[1]相同:菌丝直径1~5 μm, 分支, 浅褐色, 光滑; 分生孢子梗竖立, 中间有粗节, 隔膜, 单生或2~3根簇生, 稍有分支, 长可达400 μm, 宽2.5~4.0 μm; 产孢细胞有限生长, 圆柱状, 膝状弯曲, 大小为(10~44)μm×(3~4)μm; 枝孢无隔, 短圆柱状或圆柱状, 大小为(22~41)μm×(3~5)μm, 浅褐色; 分生孢子链生, 分支, 浅绿褐色, 末端分生孢子大小为(2~5)μm×(2~3)μm, 中间分生孢子大小为(4~12)μm×(2~4)μm。
 |
| 标尺=10 μm。 Bar=10 μm. 图2 从柚果面枝孢菌斑点上分离到的极细枝孢的形态特征 Fig. 2 Morphological characteristics of C. tenuissimum from Cladosporium spot of C. grandis |
第2组包括2个菌株, GX23和GDMZ32, 在PDA培养基、25℃条件下培养2周后的菌落直径为6.2~6.5 cm, 呈橄榄色至深褐色, 表面呈绒毛状。在显微镜下观察发现, 其形态特征(图 3)与散黄枝孢霉(C. xantochromaticum)[5]相同:菌丝直径1.5~3.0 μm, 浅褐色, 光滑; 分生孢子梗竖立, 微弯, 无节, 有隔膜, 单生, 稍有分支, 长可达210 μm, 宽2~4 μm; 产孢细胞有限生长, 圆柱状, 膝状弯曲, 大小为(12~32)μm×(3~4)μm; 枝孢无隔, 短圆柱状或圆柱状, 大小为(18~36)μm×(2.0~3.5) μm, 浅褐色; 分生孢子链生, 分支, 浅绿褐色, 末端分生孢子大小为(4~5)μm×(2.0~2.5)μm, 中间分生孢子大小为(5~7)μm×(2.5~3.5)μm。这个种在2016年才建立, 本研究是首次从植物材料上分离到此种真菌。
 |
| 标尺=10 μm。 Bar=10 μm. 图3 从柚果面枝孢菌斑点上分离到的散黄枝孢霉的形态特征 Fig. 3 Morphological characteristics of C. xantochromaticum from Cladosporium spot of C. grandis |
对21个分离物的核糖体基因的内转录间隔(ITS)区、转录延长因子(TEF)基因区段和微丝肌动蛋白(ACT)基因区段进行扩增并测序, 将得到的3个区段的核苷酸序列合并, 并从GeneBank中下载已经报道的枝孢属真菌在柑橘上分离到的种及其相似种, 与分离物同时进行系统学分析, 最终形成了总计1 004个特征符的数据阵, 其中进行简约法聚类的特征符是342个。聚类结果(图 4)表明, 与形态学研究结果相符, 其中18个菌株与极细枝孢(C. tenuissimum)聚成一类, 2个菌株与散黄枝孢霉(C. xantochromaticum)聚成一类, 这2个聚类分支结果得到了自举(boostrap)检验的支持。而GDMZ23自成一个与枝孢属真菌分离的分支, 经形态鉴定表明, 此菌株与HUANG等[9]对果实平脐疣孢菌(Zasmidium fructigenum)的形态描述一致, DNA序列分析结果与形态分析结果相符。
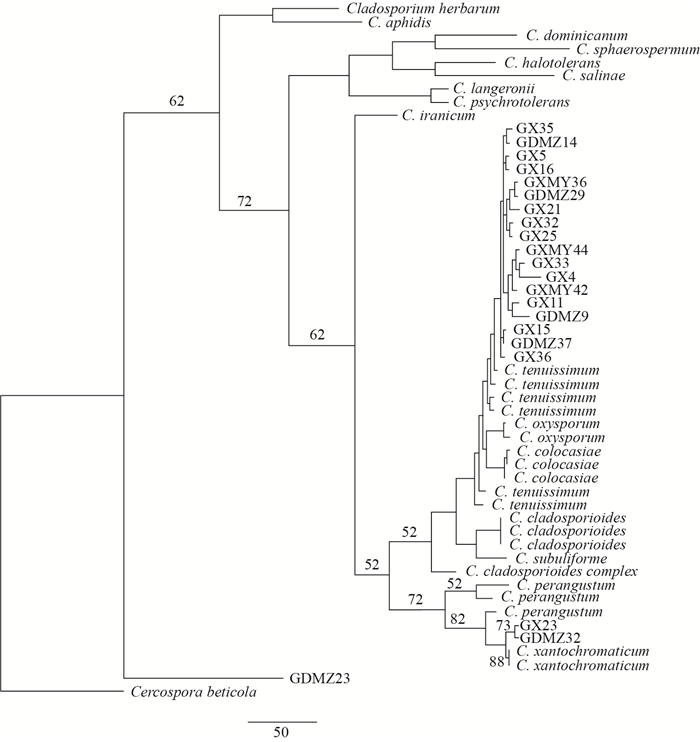 |
| 图4 柚果面枝孢菌斑点病病原分离物的系统发育分析 Fig. 4 Phylogenic analysis of isolates from Cladosporium spot of C. grandis |
枝孢属真菌是自然界广泛存在的一类真菌, 甚至在一些极端环境中也有这类菌的存在[1, 7]。大多数枝孢属真菌是腐生菌, 少数可以在植物和动物, 甚至人类上寄生[5]。植物的枝孢属真菌病原物一般危害叶片, 在许多植物叶片上形成病斑[1]。我国在许多植物叶片上均发现了枝孢属病原真菌, 但在柑橘果实上的枝孢属真菌鲜见报道。柚是柑橘属的重要种类, 经济价值很高, 但对其果实病害的研究很少。本研究发现, 枝孢属病原真菌至少有2个种可以侵染沙田柚和琯溪蜜柚果实, 在果实表面形成病斑, 严重影响柚果商品性, 需要引起高度重视。
本研究表明, 极细枝孢(C. tenuissimum)是柑橘果斑病的主要病原菌。在分类上, 极细枝孢菌是一种常见的枝孢属真菌, 在全世界许多地方都有分布, 主要是腐生菌, 少数是寄生性较弱的次生寄生菌[1, 3, 7]。BENSCH等[2-3]认为极细枝孢是一个复合种, 包含遗传背景不同的种群, 许多特征重叠在一起, 在形态上难以明确区分; 但是通过分子系统学分析表明, 这个种内部分化比较明显, 可以根据DNA序列划分成不同的组群。本研究发现, 在我国柚果实表面分离到的枝孢霉分离物绝大部分属于极细枝孢(C. tenuissimum), 是优势种。而且从聚类结果可以看出, 来自不同地方的菌株聚类在一起, 但其致病性是否与其他组群不同, 值得进一步研究。田间调查发现, 柚果的果面病只有当果实即将成熟或者已经成熟时才形成病斑, 病害不会在幼果上发生。从这个侵染特点推测该病菌是弱寄生菌。
散黄枝孢霉(C. xantochromaticum)是SANDOVAL-DENIS等[6]根据从临床样本中分离得到的菌株的特征建立的一个新种:对这个种的形态特征分析表明, 它属于枝状枝孢(C. cladosporioides)复合种; 对其分子序列特征分析表明, 它与同属于枝状枝孢(C. cladosporioides)复合种中的细孢枝孢(C. perangustum)亲缘关系很近, 并认为细孢枝孢(C. perangustum)不同菌株间具有相当大的遗传变异。本研究的系统学分析也得到了相似的结果, 散黄枝孢霉(C. xantochromaticum)和细孢枝孢(C. perangustum)的亲缘关系很近。且本研究从沙田柚果实上分离到的2株菌与散黄枝孢霉(C. xantochromaticum)的菌株明显地聚类在一起, 形态上也与SANDOVAL-DENIS等[6]对散黄枝孢霉的描述相一致。这是首次从植物上分离到的散黄枝孢霉(C. xantochromaticum)。但从植物上分离到的散黄枝孢霉与从临床样本中分离到的散黄枝孢霉菌株在生理生化和致病性方面的区别还值得进一步研究。
本研究结果表明, 柚果实上的枝孢果斑病主要由极细枝孢(C. tenuissimum)和散黄枝孢霉(C. xantochromaticum)引起, 其中极细枝孢(C. tenuissimum)是优势种, 而散黄枝孢霉(C. xantochromaticum)是从柚果上分离到的我国的新记录种。这2个种在侵染循环过程中的异同及侵染过程中是否有协同作用, 需要进一步研究, 从而为制定科学的防治措施提供理论指导。
| [1] |
BENSCH K, BRAUN U, GROENEWALD J Z, et al. The genus Cladosporium. Studies in Mycology, 2012, 72(1): 1-401. |
| [2] |
BENSCH K, GROENEWALD J Z, BRAUN U, et al. Common but different: The expanding realm of Cladosporium. Studies in Mycology, 2015, 82: 23-74. DOI:10.1016/j.simyco.2015.10.001 |
| [3] |
BENSCH K, GROENEWALD J Z, DIJKSTERHUIS J, et al. Species and ecological diversity within the Cladosporium cladosporioides complex (Davidiellaceae, Capnodiales). Studies in Mycology, 2010, 67: 1-94. DOI:10.3114/sim.2010.67.01 |
| [4] |
MA R, CHEN Q, FAN Y L, et al. Six new soil-inhabiting Cladosporium species from plateaus in China. Mycologia, 2017, 109(2): 244-260. DOI:10.1080/00275514.2017.1302254 |
| [5] |
SANDOVAL-DENIS M, GENÉ J, SUTTON D A, et al. New species of Cladosporium associated with human and animal infections. Persoonia, 2016, 36: 281-298. DOI:10.3767/003158516X691951 |
| [6] |
SANDOVAL-DENIS M, SUTTON D A, MARTIN-VICENTE A, et al. Cladosporium species recovered from clinical samples in the United States. Journal of Clinical Microbiology, 2015, 53(9): 2990-3000. DOI:10.1128/JCM.01482-15 |
| [7] |
SCHUBERT K, GROENEWALD J Z, BRAUN U, et al. Biodiversity in the Cladosporium herbarum, complex (Davidiellaceae, Capnodiales), with standardisation of methods for Cladosporium, taxonomy and diagnostics. Studies in Mycology, 2007, 58: 105-156. DOI:10.3114/sim.2007.58.05 |
| [8] |
WANG X H, CHEN G Q, HUANG F, et al. Phyllosticta species associated with citrus diseases in China. Fungal Diversity, 2012, 52(1): 209-224. DOI:10.1007/s13225-011-0140-y |
| [9] |
HUANG F, GROENEWALD J Z, ZHU L, et al. Cercosporoid diseases of Citrus. Mycologia, 2015, 107(6): 1151-1171. DOI:10.3852/15-059 |
| [10] |
THOMPSON J D, GIBSON T J, PLEWNIAK F, et al. The CLUSTAL X windows interface: Flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research, 1997, 25(24): 4876-4882. DOI:10.1093/nar/25.24.4876 |
| [11] |
SWOFFORD D L. PAUP*: Phylogenetic Analysis Using Parsimony (and Other Methods), version 4.0b10. Sunderland, US: Sinauer Assoc Inc., 2003.
|
| [12] |
HALL T A. BioEdit: A user-friendly biological sequence alignment editor and analysis program for Windows 95/98/ NT. Nucleic Acids Symposium Series, 1999(41): 95-98. |
| [13] |
HILLIS D M, BULL J J. An empirical test of bootstrapping as a method for assessing confidence in phylogenetic analysis. Systematic Biology, 1993, 42(2): 182-192. DOI:10.1093/sysbio/42.2.182 |
 2018, Vol. 44
2018, Vol. 44


