| 牛磺酸缓解镉诱导的鸡胚睾丸细胞氧化损伤的核转录因子E2相关因子2/血红素加氧酶-1途径 |
镉(cadmium, Cd)是工业制造中广泛使用的一种重金属,通过废水、废气和废渣的形式释放到环境中,引起水、空气和土壤的污染[1]。镉作为人体的非必需元素,可以通过职业性接触、呼吸和食用被镉污染的食物进入人体,通过血液循环到达机体各器官,危害人体健康。日本“痛痛病”和湖南“镉大米”事件使人们聚焦于镉引起的环境污染问题。镉已经被世界卫生组织(World Health Organization, WHO)列为重点研究的食品污染物,同时被国际癌症研究机构(International Agency for Research on Cancer, IARC)认定为Ⅰ类致癌物[2-3]。慢性镉暴露可导致小鼠生殖系统出现镉积累,并对生殖系统的发育造成严重损伤[4];镉暴露也可引起曲细精管中生殖细胞的凋亡[5];另外还有研究发现,镉能够降低男性精液的质量,使生殖能力下降[6]。然而,关于镉作为毒物引起生殖系统损伤的机制仍不清楚。
牛磺酸(taurine, Tau)作为一种天然氨基酸,不参与蛋白质生物合成,主要存在于富含蛋白质的食物中。牛磺酸具有降血压、降血脂、维持渗透压平衡和抗氧化等生物学作用。在低温储藏的条件下,在牛精液中添加牛磺酸可显著增强精子的生存能力[7];清除过氧化氢产生的羟基自由基,从而保护精子免受氧化损伤[8]。然而,有关牛磺酸保护睾丸的作用机制报道很少。
活性氧(reactive oxygen species, ROS)水平是疾病发生的病理基础,可触发细胞内多种防御系统。核转录因子E2相关因子2(nuclear factorerythroid 2 related factor-2, Nrf2)是细胞防御机制中维持细胞稳态的主要调节物质之一。Nrf2在正常生理条件下呈现低水平表达,然而在非正常条件下,如在癌细胞中可呈现高水平表达[9],说明Nrf2的激活对人类疾病的预防意义重大。血红素加氧酶- 1(heme oxygenase-1, HO-1)是Nrf2调节的下游因子。机体受到氧化应激后,Nrf2从胞质入核与抗氧化反应元件ARE结合,从而激活Nrf2及其下游因子HO-1的表达。大量报道指出,镉可激活Nrf2信号通路[10-13],但牛磺酸对镉诱导的生殖系统氧化损伤的缓解作用与Nrf2/HO-1信号通路是否相关仍然未知。
本研究采用鸡胚睾丸生殖细胞-体细胞共培养模型,探究无机内分泌干扰物镉诱导的鸡胚睾丸细胞毒性,研究镉诱导的睾丸细胞氧化损伤与Nrf2/ HO-1信号的相关性,为合理开发抗氧化物质牛磺酸防治镉引起的生殖毒性提供理论依据。
1 材料与方法 1.1 材料氯化镉、牛磺酸,购自Aladdin公司;四唑盐(methyl thiazolyl tetrazolium, MTT),购自北京索莱宝科技有限公司;超氧化物歧化酶(superoxide dismutase, SOD)试剂盒、丙二醛(malonaldehyde, MDA)试剂盒、H2O2试剂盒,购自南京建成生物工程研究所;原位末端转移酶标记(TdT-mediated dUTP nick end labelling, TUNEL)细胞凋亡试剂盒、反转录试剂盒、荧光定量聚合酶链式反应(polymerase chain reaction, PCR)试剂盒,购自南京诺唯赞生物科技公司;RIPA裂解液(RIPA lysis buffer)、4’,6-二脒基-2-苯基吲哚(4’, 6-diamidino-2-phenylindole, DAPI)、Western一抗和二抗稀释液,购自上海碧云天生物技术公司;5-溴脱氧尿嘧啶核苷(5-bromo- 2-deoxyuridine, BrdU),购自Sigma公司;BrdU一抗G3G4,购自DSHB公司;兔抗CDK2,购自武汉博士德生物公司;鼠抗PCNA、β-actin,购自Abcam公司;TRIFC标记羊抗鼠二抗、TRIFC标记羊抗兔二抗,购自巴傲得生物科技有限公司;兔抗Nrf2、兔抗p-Nrf2,购自杭州华安生物技术有限公司;TRIzol试剂,购自Invitrogen公司;十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)上样缓冲液,购自北京康为世纪生物科技有限公司;二甲基亚砜(dimethyl sulfoxide, DMSO)和常规化学试剂(均为分析纯),购自国药集团化学试剂有限公司;海兰鸡受精种蛋,购自杭州市蛋鸡试验场。
1.2 睾丸细胞的处理受精种蛋在温度38.5 ℃和湿度60%的孵化箱中孵化至18日,参照MI等[14]的研究方法将睾丸分散成单个细胞,分别按每孔5×104、2×105、1×106个的细胞密度接种到96、24和6孔细胞培养板中。牛磺酸和镉用磷酸盐缓冲溶液(phosphate buffer saline, PBS)配制成贮备液,并将培养液稀释至所需浓度。用镉(1.25、2.50、5.00 μmol/L)和牛磺酸(10、100、1 000 μmol/L)分别或者联合处理睾丸细胞。
1.3 睾丸生殖细胞的形态学观察不同处理组的睾丸细胞培养48 h后,于显微镜下观察细胞贴壁及生长状态,采用显微数字成像系统拍照,每孔选4个视野,通过图像分析软件对生殖细胞数目进行统计。
1.4 细胞活力检测不同处理组的睾丸细胞在96孔板培养48 h后,加入20 μL MTT溶液,在37 ℃培养箱中培养4 h。吸去培养液,加入150 μL DMSO,在摇床上低速振荡5 min,然后用酶标仪在波长490 nm处测量其吸光度。细胞存活率=(测定组吸光度值-空白组吸光度值)/(对照组吸光度值-空白组吸光度值)。
1.5 生化指标测定不同处理组的睾丸细胞在24孔板中培养48 h后,收集细胞用于生化分析。按照试剂盒说明书分别测定SOD、MDA、H2O2和ROS。SOD、MDA和H2O2在酶标仪中检测。ROS在荧光酶标仪上检测:测定前设置空白对照组,ROS水平等于测定的细胞荧光强度与对照组荧光强度的比值。
1.6 BrdU掺入及检测将BrdU掺入细胞,使用免疫荧光技术检测不同处理组的睾丸细胞增殖情况。不同处理组的睾丸细胞在96孔板中培养44 h后掺入BrdU,在38.5 ℃条件下继续培养4 h。随后,细胞用4%多聚甲醛固定20 min,用含吐温-20的磷酸盐缓冲液(phosphate buffered saline with Tween-20, PBST)洗3次,在2 mol/L HCl、37 ℃条件下变性30 min。加入0.1 mol/L四硼酸钠中和5 min,PBST洗3次后,用即用型山羊血清常温封闭20 min。添加BrdU一抗G3G4(1:200)4 ℃孵育过夜,用PBST洗3次,加入TRIFC标记的羊抗鼠二抗(1:500)在37 ℃条件下孵育1 h,用PBST洗3次。最后,加入DAPI常温孵育30 min,PBST洗3次。在IX70荧光显微镜下观察,通过BrdU标记的睾丸细胞核与DAPI染色的睾丸细胞核比值计算BrdU掺入指数。
1.7 TUNEL染色依据TUNEL试剂盒操作方法检测不同处理组的睾丸细胞凋亡情况,在IX70荧光显微镜下观察、拍照。通过TUNEL阳性标记的睾丸细胞核与DAPI染色的睾丸细胞核比值计算TUNEL阳性标记率。
1.8 免疫荧光染色不同处理组的睾丸细胞在96孔板中培养48 h,用4%多聚甲醛固定20 min。然后用PBST通透细胞,用山羊血清封闭。添加兔抗Nrf2抗体(1:100)和兔抗p-Nrf2抗体(1:100)4 ℃孵化过夜。将TRIFC标记羊抗兔二抗(1:500)作为二抗。最后用DAPI常温孵育10 min,在激光共聚焦显微镜下观察、拍照。
1.9 蛋白质印迹(Western blotting)法不同处理组的睾丸细胞在6孔板中培养48 h,用1 mL RIPA(含1 mmol/L苯甲基磺酰氟)进行裂解。根据二喹啉甲酸(BCA)试剂盒中的操作步骤测定不同处理组的总蛋白量。在保持蛋白上样量一致情况下,经10% SDS-PAGE电泳后,将蛋白转移到聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜上。用5%脱脂牛奶封闭后,加入兔抗CDK2,鼠抗PCNA,兔抗Nrf2和兔抗p-Nrf2抗体4 ℃孵育过夜。采用辣根过氧化物酶(horseradish peroxidase, HRP)标记的二抗室温孵育1 h。回收二抗后洗膜3遍,用ECL曝光拍照。以β-actin(1:1 000)为内参蛋白,采用Image J软件对蛋白进行定量分析。
1.10 RNA提取、cDNA合成及荧光定量PCR实时荧光定量PCR(quantitative real-time fluorescent PCR, qRT-PCR)用于检测基因mRNA的表达。用TRIzol试剂提取总RNA,用Nano Drop仪测定RNA浓度。根据反转录试剂盒的操作步骤,将不同处理组的RNA统一反转录成2 μg的cDNA,在定量PCR仪中进行实时荧光定量检测。总体系(20 µL)为:2 µL cDNA模板,0.4 µL Rox参比染料Ⅱ,400 nmol/L特异性引物(表 1)和10 µL SYBR Premix Ex Taq。以β-actin为内参,采用相对定量(2-ΔΔCT)法计算基因mRNA的相对表达量。
| 表1 实时荧光定量PCR引物 Table 1 Primers for quantitative real-time fluorescent PCR |
 |
| 点击放大 |
结果采用“平均值±标准误”表示,用SPSS 23.0软件对所得数据进行单因素方差分析、最小显著差数法(least-significant difference, LSD)和邓肯(Duncan)多重比较,P < 0.05为差异有统计学意义。
2 结果与分析 2.1 牛磺酸缓解镉引起的鸡胚睾丸细胞形态学变化在生殖细胞-体细胞共培养48 h后,不同浓度的镉均对生殖细胞呈现出毒性作用。在对照组中,生殖细胞呈圆形并且附着于体细胞之上(图 1A-a)。在2.50 μmol/L镉处理组中,生殖细胞呈现胞质空泡化(图 1A-c);添加5.00 μmol/L镉后,许多生殖细胞凋亡成细胞碎片(图 1A-d)。牛磺酸处理组(100 μmol/L)的生殖细胞生长良好,体细胞呈梭状铺满培养板,生殖细胞呈圆形贴于体细胞上(图 1A-e);牛磺酸和镉联合处理组的生殖细胞形态良好(图 1A-f)。
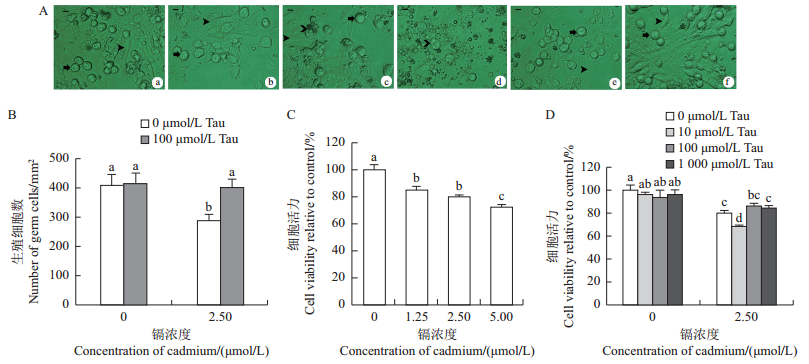 |
A:牛磺酸和镉对睾丸生殖细胞形态学的影响。a:对照组;(b~d):1.25、2.50、5.00 μmol/L镉处理组;e:100 μmol/L牛磺酸处理组;f:2.50 μmol/L镉+100 μmol/L牛磺酸联合处理组。 :体细胞; :体细胞; :正常的生殖细胞; :正常的生殖细胞; :损伤的生殖细胞。标尺:10 μm。短栅上的不同小写字母表示在P < 0.05水平差异有统计学意义。
A: Effects of taurine and cadmium on morphological changes in testicular germ cells of embryonic chicken. a-f indicate the testicular cells of the control, 1.25, 2.50, 5.00 μmol/L cadmium, 100 μmol/L taurine, 2.50 μmol/L cadmium + 100 μmol/L taurine-treated groups, respectively. :损伤的生殖细胞。标尺:10 μm。短栅上的不同小写字母表示在P < 0.05水平差异有统计学意义。
A: Effects of taurine and cadmium on morphological changes in testicular germ cells of embryonic chicken. a-f indicate the testicular cells of the control, 1.25, 2.50, 5.00 μmol/L cadmium, 100 μmol/L taurine, 2.50 μmol/L cadmium + 100 μmol/L taurine-treated groups, respectively.  :Somatic cells; :Somatic cells;  :Normal germ cells; :Normal germ cells;  :Germ cells that appeared cell vacuolation. Scale bar: 10 μm. Different lowercase letters above bars indicate statistically significant difference at the 0.05 probability level.
图1
牛磺酸(Tau)和镉对鸡胚睾丸细胞的影响
Fig. 1
Effects of taurine (Tau) and cadmium on testicular cells in embryonic chicken :Germ cells that appeared cell vacuolation. Scale bar: 10 μm. Different lowercase letters above bars indicate statistically significant difference at the 0.05 probability level.
图1
牛磺酸(Tau)和镉对鸡胚睾丸细胞的影响
Fig. 1
Effects of taurine (Tau) and cadmium on testicular cells in embryonic chicken
|
镉处理鸡胚睾丸细胞48 h后,睾丸生殖细胞数目显著降低(P < 0.05),然而牛磺酸和镉联合处理组生殖细胞数显著高于镉处理组(P < 0.05),损伤水平显著降低(图 1B)。1.25、2.50、5.00 μmol/L镉处理组的细胞活力分别为85.4%、80.1%和72.6%(图 1C),均显著低于对照组(P < 0.05),表明鸡胚睾丸细胞活性随着镉浓度增加而依赖性降低,细胞损伤加重,此时的细胞活性主要来自于体细胞。用牛磺酸(10、100、1 000 μmol/L)与镉(2.50 μmol/L)进行联合处理后,MTT检测结果(图 1D)表明,100 μmol/ L牛磺酸将2.50 μmol/L镉诱导的睾丸细胞活力由80.1%提升至86.05%,表明100 μmol/L牛磺酸可缓解2.50 μmol/L镉诱导的睾丸细胞毒性。
2.2 牛磺酸和镉对睾丸细胞氧化损伤的影响用牛磺酸(100 μmol/L)和镉(2.50 μmol/L)单独或联合处理的睾丸细胞培养48 h后,测定其MDA含量、H2O2水平和SOD活性,以揭示睾丸细胞氧化损伤情况。由图 2可知:在牛磺酸处理组中,H2O2水平和SOD活性与对照组相比无显著性差异(P > 0.05),但MDA含量显著减少(P < 0.05);在镉处理组中,MDA含量和H2O2水平与对照组相比显著增加,SOD活性显著降低(P < 0.05);牛磺酸和镉联合处理组与镉处理组相比,其MDA含量降低,SOD活性增加。
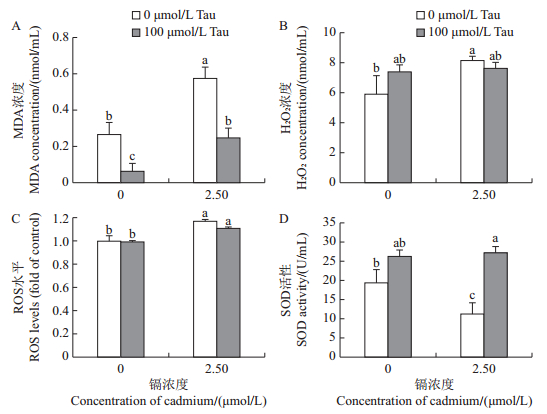 |
| 短栅上的不同小写字母表示在P<0.05水平差异有统计学意义。 Different lowercase letters above bars indicate statistically significant difference at the 0.05 probability level. 图2 牛磺酸和镉对睾丸细胞氧化和抗氧化系统的影响 Fig. 2 Effects of taurine and cadmium on oxidation and antioxidant system in testicular cells of embryonic chicken |
采用荧光探针DCFH-DA对睾丸细胞进行ROS检测,结果(图 2C)表明:与对照组相比,牛磺酸处理组中ROS生成量无显著性差异,镉处理组的ROS生成量显著增加(P < 0.05);牛磺酸和镉联合处理组的ROS生成量低于镉处理组,但差异不显著。
2.3 牛磺酸和镉对睾丸细胞增殖的影响通过BrdU掺入试验检测不同处理组睾丸细胞增殖状况,结果(图 3A、C)表明:对照组中约18.7%的睾丸细胞被BrdU标记,然而镉处理组睾丸细胞标记率低至8.8%;与对照组相比,镉处理组中BrdU标记率显著降低(P < 0.05),而牛磺酸和镉联合处理组与对照组无显著差异。通过免疫印迹法检测增殖相关蛋白的表达(图 3B),结果表明,与对照组相比,增殖相关蛋白CDK2(图 3D)和PCNA(图 3E)在镉处理组中显著减少(P < 0.05),然而在牛磺酸和镉联合处理组中却与对照组无显著差异。
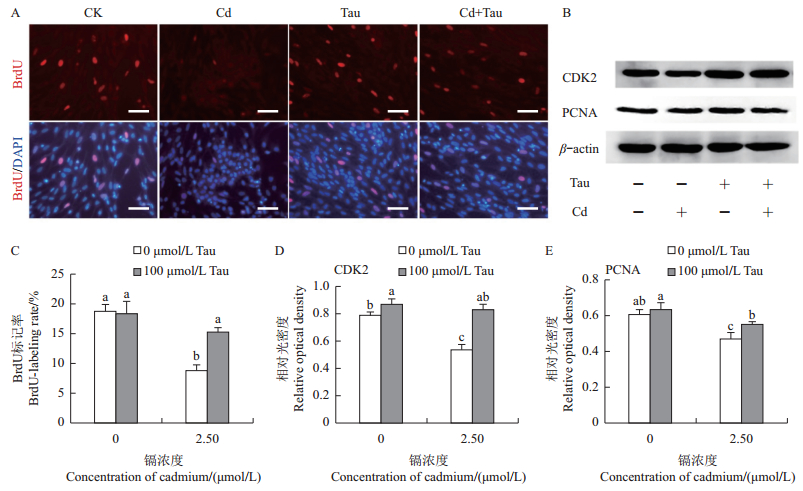 |
| A:BrdU免疫荧光染色结果。CK、Cd、Tau、Cd+Tau分别表示对照组、镉处理组(2.50 μmol/L)、牛磺酸处理组(100 μmol/L)、镉(2.50 μmol/L)和牛磺酸(100 μmol/L)联合处理组。标尺:50 μm。B:CDK2和PCNA免疫印迹结果;C:BrdU免疫荧光增殖细胞标记率;D:CDK2的灰度分析结果;E:PCNA的灰度分析结果。短栅上的不同小写字母表示在P < 0.05水平差异有统计学意义。 A: Results of BrdU immunofluorescence staining. CK, Cd, Tau and Cd+Tau indicate testicular cells of the control, cadmium (2.50 μmol/L), taurine (100 μmol/L), cadmium (2.50 μmol/L)+taurine (100 μmol/L)-treated groups, respectively. Scale bar: 50 μm. B: Western blotting of CDK2 and PCNA; C: Labeling rate of proliferative cells by BrdU immunofluorescence; D: Grey analysis of CDK2; E: Grey analysis of PCNA. Different lowercase letters above bars indicate statistically significant difference at the 0.05 probability level. 图3 牛磺酸(Tau)和镉(Cd)对睾丸细胞增殖的影响 Fig. 3 Effects of taurine (Tau) and cadmium (Cd) on testicular cell proliferation in embryonic chicken |
通过TUNEL免疫荧光染色检测睾丸细胞的凋亡情况,结果(图 4A~B)表明:牛磺酸处理组和对照组中TUNEL阳性细胞很少,与对照组相比,镉处理组中细胞凋亡率显著增加到22.07%;牛磺酸和镉联合处理组细胞凋亡率为9.99%,显著低于镉处理组。采用荧光定量PCR检测内质网应激和凋亡相关基因的表达,结果表明:镉处理组内质网应激相关基因(GRP78和XBP-1)显著高于对照组(P < 0.05),牛磺酸和镉联合处理组GRP78和XBP-1低于镉处理组(图 4C~D);镉处理组凋亡相关基因(Cyt C、caspase 9和p53)显著高于对照组(P < 0.05),牛磺酸和镉联合处理组Cyt C、caspase 9和p53低于镉处理组(图 4E~G)。
 |
| 短栅上的不同小写字母表示在P<0.05水平差异有统计学意义。 Different lowercase letters above bars indicate statistically significant difference at the 0.05 probability level. 图4 牛磺酸(Tau)和镉(Cd)对鸡胚睾丸细胞内质网应激和凋亡的影响 Fig. 4 Effects of taurine (Tau) and cadmium (Cd) on endoplasmic reticulum stress and apoptosis in testicular cells of embryonic chicken |
免疫荧光染色检测结果表明,Nrf2定位于细胞核与细胞质中,p-Nrf2主要表达在细胞核中。从图 5A中可以看出:Nrf2和p-Nrf2在对照组中微弱表达;与对照组相比,Nrf2和p-Nrf2在镉处理组中呈现强阳性表达;在牛磺酸和镉联合处理组中,Nrf2和p-Nrf2与对照组相比无显著性变化。采用免疫印迹法对Nrf2和p-Nrf2的蛋白表达进行定量分析,结果(图 5B)显示,对照组中Nrf2和p-Nrf2呈现低表达。与对照组相比,Nrf2(图 5C)和p-Nrf2(图 5D)在镉处理组中的表达显著高于对照组(P < 0.05);与镉处理组相比,牛磺酸和镉联合处理组Nrf2和p-Nrf2蛋白表达显著降低(P < 0.05)。荧光定量PCR检测结果(图 5E)显示,与对照组相比,HO-1 mRNA的表达水平在镉处理组中显著升高(P < 0.05),而牛磺酸和镉联合处理组HO-1 mRNA的表达水平显著低于镉处理组(P < 0.05)。
 |
| A:Nrf2和p-Nrf2免疫荧光染色结果。CK、Cd、Tau、Cd+Tau表示的含义详见图 3注。标尺:20 μm。B:Nrf2和p-Nrf2免疫印迹结果;C:Nrf2灰度分析结果;D:p-Nrf2灰度分析结果;E:HO-1 mRNA表达结果。短栅上的不同小写字母表示在P < 0.05水平差异有统计学意义。 A: Fluorescence immunohistochemistry of Nrf2 and p-Nrf2. Please see the footnote of Fig. 3 for the details of CK, Cd, Tau and Cd+ Tau. Scale bar: 20 μm. B: Western blotting of Nrf2 and p-Nrf2; C: Grey analysis of Nrf2; D: Grey analysis of p-Nrf2; E: Expression level of HO-1 mRNA. Different lowercase letters above bars indicate statistically significant difference at the 0.05 probability level. 图5 牛磺酸(Tau)和镉(Cd)对睾丸细胞Nrf2的影响 Fig. 5 Nrf2 changes of taurine (Tau) and cadmium (Cd) on testicular cell |
重金属镉是广泛存在于环境中的污染物,由于其在人体中的半衰期长,使得镉容易蓄积于人体,引起机体重要器官严重损伤,其中对生殖系统损害尤为严重[15-17]。但是目前关于镉对雄性生殖系统损伤作用机制的报道较少。我们采用生殖细胞-体细胞共培养模型进行研究,该模型已经被证实在评价环境内分泌干扰物中有效[18]。镉作为内分泌干扰物可调节雄激素受体活性[19],引起内分泌紊乱[20]。镉能进入机体并积累在睾丸中,进而损伤睾丸,使其形态异常,从而影响生殖系统[21]。高浓度的镉可影响精子质量[22],由于生殖细胞对镉暴露高度敏感,仅1 μmol/L镉即可显著降低生殖细胞数[23]。在本研究中,生殖细胞在镉暴露后出现核固缩和胞质空泡化等现象,表明镉诱导能使生殖细胞形态异常。形态观察法和MTT检测结果均表明,牛磺酸(100 μmol/L)对镉(2.50 μmol/L)的生殖毒性具有保护作用。
在正常情况下机体的氧化状态和抗氧化状态维持着动态平衡,但这种平衡随着年龄的增加而逐渐被打破[24]。睾丸因具有丰富的脉管系统而容易被镉攻击[25],产生的氧化损伤可导致睾丸微循环的变化[26]。氧化应激在半数不育男性中是比较常见的病理状态[27],镉可以结合在氨基酸的巯基上,引起氧化应激[28]。为了应对氧化应激,镉暴露使抗氧化酶SOD降低[29]。本研究结果表明,镉会引起SOD活性降低,MDA和H2O2水平升高,ROS积累,而添加牛磺酸可降低ROS,恢复机体抗氧化水平,说明抗氧化剂牛磺酸能缓解镉引起的氧化应激反应。
在乳腺癌细胞中,一定浓度的镉可促进细胞增殖[30],其中低浓度镉能显著促进细胞增殖,而高浓度镉则显著抑制细胞生长[31]。镉还能诱导细胞周期阻滞,降低CDK2的表达[32]。在本研究中,镉降低了CDK2和PCNA蛋白的表达。内质网应激在机体氧化应激过程中发挥着重要的调节作用。线粒体产生的ROS过量,则自由基攻击膜磷脂及线粒体膜去极化,若线粒体膜孔打开,则Cyt C从线粒体进入胞质,参与半胱氨酸天冬氨酸蛋白酶信号通路的激活,激活凋亡小体的半胱氨酸天冬氨酸蛋白酶9活性。有研究表明,内质网应激信号通路能调控镉诱导的氧化应激过程[33-34]。镉参与线粒体介导的信号通路[35-36],所以,镉诱导的线粒体凋亡与ROS生成及半胱氨酸天冬氨酸蛋白酶9的激活有关。而且镉可诱导很多类型的细胞发生凋亡[37-38]。在本研究中,镉处理诱导睾丸细胞内质网应激相关基因(GRP78和XBP-1)和凋亡相关基因(Cyt C、caspase 9和p53)的表达显著上调,TUNEL阳性细胞率显著增加,但是牛磺酸和镉联合处理后,睾丸细胞内质网应激得到了改善,细胞凋亡减少。说明牛磺酸可通过抑制细胞凋亡和恢复细胞增殖能力来缓解镉的毒性作用。
镉作为主要的环境和职业性污染物很难被消除,所以探究镉的毒性机制,研发抗氧化治疗剂尤为重要。而食源性牛磺酸对镉缓解作用的调节机制目前尚不清楚。近年来,有研究报道Nrf2是镉诱导器官毒性损伤的潜在机制[10-13]。也有报道显示,镉能显著增加ROS的产生量,介导Nrf2表达上调,硒能缓解镉诱导的器官毒性作用,与Nrf2调节的抗氧化信号通路无关[13]。本研究结果表明,镉暴露使睾丸细胞发生氧化损伤,导致ROS积累,介导Nrf2和p-Nrf2蛋白表达上调,引起抗氧化基因HO-1的表达上调。而添加牛磺酸可降低ROS水平,缓解氧化应激状态,进而使Nrf2和p-Nrf2的蛋白水平趋于正常。
4 结论随着镉浓度(1.25~5.00 μmol/L)的增加,镉对生殖细胞的毒性作用增强,生殖细胞形态和功能损伤严重。5.00 μmol/L镉能诱导睾丸细胞产生严重的毒性作用而导致细胞崩解。镉引起睾丸细胞氧化损伤,降低睾丸细胞增殖和增加睾丸细胞凋亡。镉暴露使睾丸细胞中ROS积累,Nrf2蛋白表达上调,其下游基因HO-1表达也上调。抗氧化剂牛磺酸能缓解镉诱导的氧化损伤,进而使Nrf2和p-Nrf2的蛋白水平趋于正常。牛磺酸一方面通过恢复氧化与抗氧化平衡,另一方面通过抑制睾丸细胞凋亡和恢复细胞增殖来缓解镉诱导的生殖毒性。
致谢
浙江大学动物科学学院实验教学中心曾卫东老师对本试验给予了大力帮助,谨致谢意!
| [1] |
MORROW H. Cadmium and Cadmium Alloys. Hoboken, USA: John Wiley & Sons, Inc., 2010.
|
| [2] |
BERTIN G, AVERBECK D. Cadmium: Cellular effects, modifications of biomolecules, modulation of DNA repair and genotoxic consequences (a review). Biochimie, 2006, 88(11): 1549-1559. DOI:10.1016/j.biochi.2006.10.001 |
| [3] |
JOSEPH P. Mechanisms of cadmium carcinogenesis. Toxicology and Applied Pharmacology, 2009, 238(3): 272-279. DOI:10.1016/j.taap.2009.01.011 |
| [4] |
IZAGUIRRY A P, SOARES M B, VARGAS L M, et al. Blueberry (Vaccinium ashei Reade) extract ameliorates ovarian damage induced by subchronic cadmium exposure in mice: Potential delta-ALA-D involvement. Environmental Toxicology, 2017, 32(1): 188-196. |
| [5] |
NIKNAFS B, SALEHNIA M, KAMKAR M. Induction and determination of apoptotic and necrotic cell death by cadmium chloride in testis tissue of mouse. Journal of Reproduction & Infertility, 2015, 16(1): 24-29. |
| [6] |
PANT N, KUMAR G, UPADHYAY A D, et al. Correlation between lead and cadmium concentration and semen quality. Andrologia, 2015, 47(8): 887-891. |
| [7] |
BUCAK M N, TEKIN N. Protective effect of taurine, glutathione and trehalose on the liquid storage of ram semen. Small Ruminant Research, 2007, 73(1/2/3): 103-108. |
| [8] |
SARIÖZKAN S, BUCAK M N, TUNCER P B, et al. The influence of cysteine and taurine on microscopic-oxidative stress parameters and fertilizing ability of bull semen following cryopreservation. Cryobiology, 2009, 58(2): 134-138. DOI:10.1016/j.cryobiol.2008.11.006 |
| [9] |
ZHANG D D. The Nrf2-Keap1-ARE signaling pathway: The regulation and dual function of Nrf2 in cancer. Antioxidants & Redox Signaling, 2010, 13(11): 1623-1626. |
| [10] |
CHEN J, SHAIKH Z A. Activation of Nrf2 by cadmium and its role in protection against cadmium-induced apoptosis in rat kidney cells. Toxicology and Applied Pharmacology, 2009, 241(1): 81-89. DOI:10.1016/j.taap.2009.07.038 |
| [11] |
WU K C, LIU J J, KLAASSEN C D. Nrf2 activation prevents cadmium-induced acute liver injury. Toxicology and Applied Pharmacology, 2012, 263(1): 14-20. DOI:10.1016/j.taap.2012.05.017 |
| [12] |
HE X, CHEN M G, MA Q. Activation of Nrf2 in defense against cadmium-induced oxidative stress. Chemical Research in Toxicology, 2008, 21(7): 1375-1383. DOI:10.1021/tx800019a |
| [13] |
CHEN M H, LI X J, FAN R F, et al. Selenium antagonizes cadmium-induced apoptosis in chicken spleen but not involving Nrf2-regulated antioxidant response. Ecotoxicology and Environmental Safety, 2017, 145: 503-510. DOI:10.1016/j.ecoenv.2017.08.001 |
| [14] |
MI Y L, ZHANG C Q, XIE M N, et al. Effects of folliclestimulating hormone and androgen on proliferation of cultured testicular germ cells of embryonic chickens. General and Comparative Endocrinology, 2004, 138(3): 237-246. DOI:10.1016/j.ygcen.2004.06.012 |
| [15] |
BU T L, MI Y L, ZENG W D, et al. Protective effect of quercetin on cadmium-induced oxidative toxicity on germ cells in male mice. The Anatomical Record, 2011, 294(3): 520-526. DOI:10.1002/ar.v294.3 |
| [16] |
GUO P, PI H F, XU S C, et al. Melatonin improves mitochondrial function by promoting MT1/SIRT1/PGC-1 alpha-dependent mitochondrial biogenesis in cadmiuminduced hepatotoxicity in vitro. Toxicological Sciences, 2014, 142(1): 182-195. DOI:10.1093/toxsci/kfu164 |
| [17] |
HOU F Y, XIAO M, LI J, et al. Ameliorative effect of grape seed proanthocyanidin extract on cadmium-induced meiosis inhibition during oogenesis in chicken embryos. The Anatomical Record, 2016, 299(4): 450-460. DOI:10.1002/ar.v299.4 |
| [18] |
MI Y L, ZHANG C Q, ZENG W D, et al. Establishment of a germ-somatic cell coculture model for toxicity assessment of environmental endocrine disrupters. Journal of Environmental Science and Health Part A-Toxic/Hazardous Substances & Environmental Engineering, 2005, 40(10): 1917-1928. |
| [19] |
WU R Q, CUI Y X, YUAN X Y, et al. SUMO-specific protease 1 modulates cadmium-augmented transcriptional activity of androgen receptor (AR) by reversing AR SUMOylation. Toxicology Letters, 2014, 229(2): 405-413. DOI:10.1016/j.toxlet.2014.07.003 |
| [20] |
WANG H J, LIU Z P, JIA X D, et al. Endocrine disruption of cadmium in rats using the OECD enhanced TG 407 test system. Biomedical and Environmental Sciences, 2014, 27(12): 950-959. |
| [21] |
WANG Y J, YAN J, YIN F, et al. Role of autophagy in cadmium-induced testicular injury. Human & Experimental Toxicology, 2017, 36(10): 1039-1048. |
| [22] |
LI Y Y, WU J Q, ZHOU W J, et al. Association between environmental exposure to cadmium and human semen quality. International Journal of Environmental Research, 2016, 26(2): 175-186. |
| [23] |
ANGENARD G, MUCZYNSKI V, COFFIGNY H, et al. Cadmium increases human fetal germ cell apoptosis. Environmental Health Perspectives, 2010, 118(3): 331-337. DOI:10.1289/ehp.0900975 |
| [24] |
LIU X T, LIN X, MI Y L, et al. Age-related changes of yolk precursor formation in the liver of laying hens. Journal of Zhejiang University: Science B, 2018, 19(5): 390-399. DOI:10.1631/jzus.B1700054 |
| [25] |
PROZIALECK W C, EDWARDS J R, NEBERT D W, et al. The vascular system as a target of metal toxicity. Toxicological Sciences, 2007, 102(2): 207-218. |
| [26] |
TURNER T T, LYSIAK J J. Oxidative stress: A common factor in testicular dysfunction. Journal of Andrology, 2008, 29(5): 488-498. DOI:10.2164/jandrol.108.005132 |
| [27] |
TREMELLEN K. Oxidative stress and male infertility: A clinical perspective. Human Reproduction Update, 2008, 14(3): 243-258. DOI:10.1093/humupd/dmn004 |
| [28] |
VALKO M, MORRIS H, CRONIN M T D. Metals, toxicity and oxidative stress. Current Medicinal Chemistry, 2005, 12(10): 1161-1208. DOI:10.2174/0929867053764635 |
| [29] |
GUPTA R S, GUPTA E S, DHAKAL B K, et al. Vitamin C and vitamin E protect the rat testes from cadmium-induced reactive oxygen species. Molecules and Cells, 2004, 17(1): 132-139. |
| [30] |
SIEWIT C L, GENGLER B, VEGAS E, et al. Cadmium promotes breast cancer cell proliferation by potentiating the interaction between ERalpha and c-Jun. Molecular Endocrinology, 2010, 24(5): 981-992. DOI:10.1210/me.2009-0410 |
| [31] |
JIANG G F, DUAN W X, XU L, et al. Biphasic effect of cadmium on cell proliferation in human embryo lung fibroblast cells and its molecular mechanism. Toxicology in Vitro, 2009, 23(6): 973-978. DOI:10.1016/j.tiv.2009.06.029 |
| [32] |
XIE J X, SHAIKH Z A. Cadmium induces cell cycle arrest in rat kidney epithelial cells in G2/M phase. Toxicology, 2006, 224(1/2): 56-65. |
| [33] |
KITAMURA M, HIRAMATSU N. The oxidative stress: Endoplasmic reticulum stress axis in cadmium toxicity. BioMetals, 2010, 23(5): 941-950. DOI:10.1007/s10534-010-9296-2 |
| [34] |
JI Y L, WANG H, ZHANG C, et al. N-acetylcysteine protects against cadmium-induced germ cell apoptosis by inhibiting endoplasmic reticulum stress in testes. Asian Journal of Andrology, 2013, 15(2): 290-296. DOI:10.1038/aja.2012.129 |
| [35] |
EICHLER T, MA Q, KELLY C, et al. Single and combination toxic metal exposures induce apoptosis in cultured murine podocytes exclusively via the extrinsic caspase 8 pathway. Toxicological Sciences, 2006, 90(2): 392-399. DOI:10.1093/toxsci/kfj106 |
| [36] |
FAN T J, HAN L H, CONG R S, et al. Caspase family proteases and apoptosis. Acta Biochimica et Biophysica Sinica, 2005, 37(11): 719-727. DOI:10.1111/abbs.2005.37.issue-11 |
| [37] |
YU X Z, HONG S W, FAUSTMAN E M. Cadmiuminduced activation of stress signaling pathways, disruption of ubiquitin-dependent protein degradation and apoptosis in primary rat Sertoli cell-gonocyte cocultures. Toxicological Sciences, 2008, 104(2): 385-396. DOI:10.1093/toxsci/kfn087 |
| [38] |
WÄTJEN W, HAASE H, BIAGIOLI M, et al. Induction of apoptosis in mammalian cells by cadmium and zinc. Environmental Health Perspectives, 2002, 110(Suppl. 5): 865-867. |
 2018, Vol. 44
2018, Vol. 44


