| 土壤盐梯度下根际因子对植物邻体效应的影响 |
植物间相互作用是影响植物群落结构、功能和物种多样性的重要因素,并在退化环境的植被恢复和土地重建中具有重要的实践意义[1-2]。植物间相互作用包括相邻个体地上部分相互作用和地下部分相互作用,两者共同影响植物相互作用的结果(竞争抑或互惠)[3-4]。当相邻植物个体发生相互作用时,竞争和互惠通常同时存在,且邻体效应最终表现为二者的净作用[5]。环境因子如干旱、盐分、土壤氮素含量等均对植物相互作用产生影响[6-8]。胁迫梯度假说(stress gradient hypothesis, SGH)认为,随着环境因子(如水分、养分、温度等)胁迫程度的增加,植物间相互作用会发生竞争减弱或互惠增强的变化[5, 9]。同时,生物因子如植食者、寄生物、土壤微生物等也会对植物间相互作用的性质和强度产生影响[10-12]。
植物地上部分相互作用是指植物冠层间的互惠和竞争,冠层可以通过改善微环境(如降低光照辐射、减少蒸发量、调节温湿度等)和为邻体植物提供避难所等方式来促进植物互惠,同时相邻植物冠层之间也会对光照、空间等资源展开非对称竞争[13-15]。植物地下部分相互作用除了根的直接作用外,还包括植物对根际环境(如根际土壤、根际微生物)的改变间接影响相邻植物生长[16]。根际(rhizosphere)是植物根系-土壤界面微域内,根、微生物、土壤溶液与土壤相互作用形成的复杂的、有别于土壤本体理化性质的、动态变化的微域环境[17-18]。植物可以通过改变根际土壤溶液(包含水分、可溶性矿质元素、根分泌物等)来影响植物相互作用。例如,苜蓿根际土壤浸提液抑制糜子、苜蓿种子的萌发,促进莜麦幼苗的生长[19]。同时,土壤微生物在调节植物相互作用方面扮演着重要角色,丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)是重要的土壤微生物类群,能够与80%以上的陆生植物形成菌根共生体——丛枝菌根(arbuscular mycorrhiza, AM)[20]。研究表明,AMF通过影响宿主植物的生长和生殖,进而影响植物间相互作用[21-22]。在胁迫环境下,能够减弱植物间竞争或增强互惠。例如,随着水分梯度由充足到干旱,AMF使紫花苜蓿(Medicago sativa L.)之间的竞争逐渐减弱[23];在酸胁迫下,AMF提高了土壤有机质含量,进而引发邻体植物对目标植物生长的促进作用[24]。但是,也有研究发现,在群落低密度条件下,AMF会加剧禾草类植物和豆科植物的种内竞争[25]。
盐渍化土壤是全球急需改良的退化土壤类型之一。土壤盐胁迫会引起植物生理干旱,影响植物吸收营养,从而对植物生长尤其苗期生长造成危害。研究发现,在土壤盐胁迫下,植物间地下部分相互作用的强度和性质对总邻体效应的影响大于植物间地上部分的相互作用[26],但是,各根际因子在植物间地下相互作用中的地位尚不明确。因此,本研究试图通过受控试验,分析在不同土壤盐水平下各根际因子(根、菌丝、根际土壤溶液)对植物幼苗侵染率、生物量及邻体效应的影响。
1 材料与方法 1.1 供试材料本研究以柽柳(Tamarix chinensis Lour.)和紫花苜蓿(Medicago sativa L.)为植物材料构建植物种间相互作用系统,开展邻体效应研究,其中柽柳为邻体植物,紫花苜蓿为目标植物。柽柳是多年生灌木或小乔木,具有较强的耐盐性,能在中重度盐碱地上正常生长,是典型的菌根植物,常作为改造盐碱地的优良树种[27]。紫花苜蓿是较耐盐的豆科作物,作为牧草种植在轻度盐碱地上,也是菌根的模式植物之一[28]。在盐碱地修复中,柽柳常常作为抚幼植物,对耐盐性较低的一年生紫花苜蓿有较好的抚幼效应。为此,本研究以柽柳和紫花苜蓿为模式系统研究其邻体效应。
紫花苜蓿种子(由浙江省林业科学院提供)用5%次氯酸钠表面消毒后于灭菌土中育苗。柽柳幼苗采自浙江省慈溪市杭州湾沿海滩涂(30.18° N,121.93° E)。
供试土壤来自浙江省慈溪市杭州湾湿地公园(30.18° N,121.93° E),性质如下:pH 7.59,有机质4.80 g/kg,有效磷22.32 mg/kg,总氮0.82 g/kg,总磷0.62 g/kg,有效钾225.20 mg/kg,土壤含盐量从0.01%到1.00%不等。
1.2 试验方法采用微宇宙(microcosm)分室系统(25 cm×28 cm×30 cm),试验为双因素(相互作用方式和土壤盐水平)完全随机设计,每个处理设置8个重复。相互作用方式设置5个水平(图 1):1)无邻体无分隔,目标植物无邻体相互作用(图 1A);2)有邻体,根际完全分隔,根、AMF菌丝和土壤溶液都不能相互通过(图 1B);3)有邻体,用孔径为0.45 μm的尼龙网将2种植物根际分隔开,根和AMF菌丝都不能相互通过,但土壤溶液可以相互扩散(图 1C);4)有邻体,用孔径为20 μm的尼龙网将2种植物根际分隔开,根不能通过,但AMF菌丝可以相互通过,土壤溶液可以相互扩散(图 1D);5)有邻体无分隔,根际完全相互作用(图 1E)。盐含量设置3个水平:低盐水平,含盐量0.05%;中盐水平,含盐量0.2%;高盐水平,含盐量0.5%。通过添加海盐调节土壤盐浓度。有邻体的处理中选择株高(约5 cm)、冠幅相同的紫花苜蓿幼苗移入微宇宙一侧,另一侧移入株高(约10 cm)、冠幅相同的柽柳幼苗,每个微宇宙中目标植物和邻体植物各移栽1棵,无邻体的处理中则无需移栽柽柳幼苗。每个微宇宙装入供试土壤6 kg。
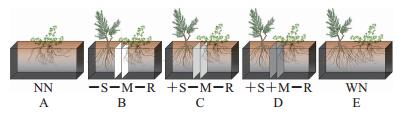 |
| A: NN代表无邻体相互作用;B:-S-M-R代表无根际相互作用(有机玻璃板隔开);C:+S-M-R代表根际仅土壤溶液可通过(用0.45 μm孔径尼龙膜隔开);D: +S+M-R代表根际菌丝和土壤溶液均可通过(用20 μm孔径尼龙膜隔开);E: WN代表植物间完全相互作用(无隔板)。 A: NN stands for no neighbor; B:-S-M-R stands for without connection; C: +S-M-R stands for only with soil solution connection; D: +S+M-R stands for soil solution and mycorrhiza connection; E: WN stands for with neighbor. 图1 盐胁迫条件下紫花苜蓿和柽柳地下部分相互作用试验模式 Fig. 1 Test mode of interspecific interactions between M. sativa and T. chinensis under salt stress |
试验在浙江大学生命科学学院网室中进行,网室通风透光良好,试验阶段(从2015年至2017年间每年的4—8月)的平均气温为18 ℃~30 ℃。将网室微宇宙系统进行完全随机排列,在自然光照和温度条件下培养,每天浇水供给植物需求,试验过程中无额外养分添加。
1.3 试验测定 1.3.1 土壤含盐量测定采用5:1水浸提法测定土壤盐分含量,即称取50 g风干土(过20目筛)于500 mL锥形瓶中,加250 mL蒸馏水,振荡混匀5 min,收集土壤浸提液备用。利用质量差法计算土壤中水溶性盐的含量[29]。
1.3.2 植物生物量的测定植物经历5个月生长后于试验期间的每年8月底进行取样。取样后将植物地下部分和地上部分分开,地下部分用自来水洗净,自然晾干后称取其鲜质量。取部分细根用于菌根侵染率测定,剩余部分的根称量鲜质量。将剩余部分的根和地上部分分别装入纸袋于105 ℃烘箱中处理20 min,然后在65 ℃条件下烘干至恒量,取出并称量地上部分干质量和剩余根干质量,同时根据剩余部分根鲜质量/干质量比及总鲜质量计算出总根干质量。
1.3.3 丛枝菌根真菌侵染率的测定首先采用酸性品红染色法对菌根进行染色[30],即将植物根经10% KOH透明、3% HCl酸化后置于酸性品红乳酸甘油染色液中染色至少30 min。菌根侵染率的测定采用网格交叉法(gridline intersection method)[31]进行,其计算公式为:菌根侵染率=交叉点上的菌根数/根段与方格线总交叉点数×100%。
1.3.4 植物相对邻体效应指数的计算相对邻体效应指数(relative interaction index, RII)表示邻体效应的性质和强度[32],RII=(BW-BC)/(BW+BC),其中BW表示邻体存在时目标植物的生物量,BC表示无邻体存在时目标植物的生物量。RII值为正时表示植物间为正相互作用,为负时表示植物间为负相互作用。
在总根际效应(belowground effect, BE)中,Bw为无隔有邻体时目标植物的生物量,BC为全隔有邻体时目标植物的生物量。
在根效应(root effect, RE)中,BW为无隔有邻体时目标植物的生物量,BC为菌丝、土壤溶液可通过时目标植物的生物量。
在菌根效应(mycorrhizal effect, ME)中,BW为菌丝、土壤溶液可通过时目标植物的生物量,BC为仅土壤溶液可通过时目标植物的生物量。
在土壤溶液效应(soil solution effect, SSE)中,BW为仅土壤溶液可通过时目标植物的生物量,BC为完全分隔时目标植物的生物量[23]。
1.4 统计分析采用双因素方差分析(two-way ANOVA)对盐分水平处理和相互作用处理进行分析,分析指标包括菌根侵染率、地上部分生物量、地下部分生物量、总生物量。使用单因素方差分析(one-way ANOVA)对不同盐分水平下邻体效应指数(RII)进行分析。使用最小显著差数法(least significant difference, LSD)多重比较分析各因素在不同水平下的差异,置信区间为95%。统计分析使用SPSS 18.0完成。
2 结果与分析 2.1 邻体植物和目标植物的AMF侵染率盐分水平处理(F2, 84=170.649,P<0.05)、相互作用处理(F3, 84=986.879,P<0.05)、盐分处理×相互作用处理的交互作用(F6, 84=95.878,P<0.05)显著地影响邻体植物柽柳的侵染率(图 2)。随盐分水平升高,柽柳AMF侵染率呈逐渐下降趋势;在相同盐水平下,无隔有邻体处理(WN)时柽柳的AMF侵染率显著高于其他处理(P<0.05)。有隔处理之间,在高盐水平下仅土壤溶液可通过的处理(+S-M-R)的AMF侵染率显著高于菌丝、土壤溶液均可通过的处理(+S+M-R)(P<0.05)和无根际相互作用处理(-S-M-R)(P<0.05)。
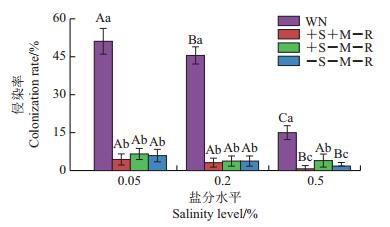 |
| 柱状图上的不同大写字母表示不同盐分水平处理组间在P<0.05水平差异有统计学意义,不同小写字母表示不同相互作用处理间在P<0.05水平差异有统计学意义。 Different capital letters above the bars show statistically significant differences among different soil salinity levels at the 0.05 probability level; different lowercase letters above the bars show statistically significant differences among different rhizosphere factors at the 0.05 probability level. 图2 不同处理条件下柽柳的AMF侵染率 Fig. 2 AMF colonization rates of neighbor plant T. chinensis under various treatments |
盐分水平处理对紫花苜蓿的AMF侵染率影响不显著(F2, 105=2.634,P>0.05),但是相互作用处理(F4, 105= 11.972,P<0.05)、盐分处理×相互作用处理的交互作用(F8, 105=4.974,P<0.05)对紫花苜蓿的侵染率影响显著(图 3)。在低盐和高盐水平下,在菌丝、土壤溶液均通过的处理(+S+M-R)中,紫花苜蓿的侵染率显著低于根际完全相互作用处理(WN)(P<0.05)。
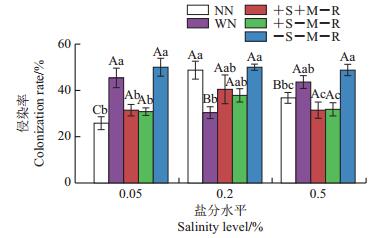 |
| 柱状图上的不同大写字母表示不同盐分水平处理组间在P<0.05水平差异有统计学意义,不同小写字母表示不同相互作用处理间在P<0.05水平差异有统计学意义。 Different capital letters above the bars show statistically significant differences among different soil salinity levels at the 0.05 probability level; different lowercase letters above the bars show statistically significant differences among different rhizosphere factors at the 0.05 probability level. 图3 不同处理条件下紫花苜蓿的AMF侵染率 Fig. 3 AMF colonization rates of target plant M. sativa under various treatments |
盐分水平处理(F2,84=7.145,P<0.05)、相互作用处理(F3, 84=86.713,P<0.05)及2个处理的交互作用(F6, 84=6.062,P<0.05)均对邻体植物柽柳的总生物量有显著影响,且相互作用处理(F3, 84=66.837,P<0.05)对柽柳地下生物量有显著影响(图 4)。在中盐和高盐水平处理下,无隔有邻体处理(WN)的柽柳生物量显著高于低盐水平处理(P<0.05)。在各盐分水平下,无隔有邻体相互作用处理(WN)的柽柳生物量显著高于其他处理(P<0.05)。在中盐和高盐水平下,无隔有邻体处理(WN)的柽柳地下部分生物量显著高于低盐水平处理(P<0.05)。其他处理的柽柳的地下部分生物量在各盐分水平下差异不显著。
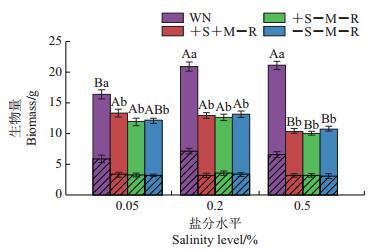 |
| 柱状图上的不同大写字母表示总生物量在不同盐分水平处理组间在P<0.05水平差异有统计学意义,不同小写字母表示总生物量在不同相互作用处理间在P<0.05水平差异有统计学意义。无斜线部分表示地上生物量,有斜线部分表示地下生物量。 Different capital letters above the bars show statistically significant differences among different soil salinity levels for the total biomass at the 0.05 probability level; different lowercase letters above the bars show statistically significant differences among different rhizosphere factors for the total biomass at the 0.05 probability level. Parts in column without slash represent the aboveground biomass, while the parts in column with slash represent the belowground biomass. 图4 不同处理条件下柽柳的生物量 Fig. 4 Total biomass of T. chinensis under various treatments |
盐分水平处理(F2, 105=250.784,P<0.05)、相互作用处理(F4, 105 =60.184,P<0.05)及2个处理的交互作用(F8, 105=10.645,P<0.05)对目标植物紫花苜蓿总生物量的影响显著(图 5)。随盐分水平升高,紫花苜蓿总生物量显著降低。在低盐和中盐水平下,植物间完全相互作用(WN)时紫花苜蓿生物量显著高于其他根际有隔处理(+S+M-R、+S-M-R、-S-M-R)(P<0.05)。在中盐水平下,菌丝、土壤溶液均可通过的处理(+S+M-R)的紫花苜蓿总生物量显著低于其他2组有隔处理(+S-M-R、-S-MR)(P<0.05)。
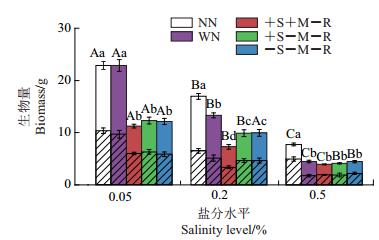 |
| 柱状图上的不同大写字母表示总生物量在不同盐分水平处理组间在P<0.05水平差异有统计学意义,不同小写字母表示总生物量在不同相互作用处理间在P<0.05水平差异有统计学意义。无斜线部分表示地上生物量,有斜线部分表示地下生物量。 Different capital letters above the bars show statistically significant differences among different soil salinity levels for the total biomass at the 0.05 probability level; different lowercase letters above the bars show statistically significant differences among different rhizosphere factors for the total biomass at the 0.05 probability level. Parts in column without slash represent the aboveground biomass, while the parts in column with slash represent the belowground biomass. 图5 不同处理条件下紫花苜蓿的总生物量 Fig. 5 Total biomass of M. sativa under various treatments |
盐分水平(F2, 105=168.639,P<0.05)对目标植物紫花苜蓿地上生物量的影响显著。随盐分水平升高,紫花苜蓿地上部分生物量显著降低。
2.3 相对邻体效应指数(RII)由图 6可知:盐水平对总根际效应有显著影响(F2, 23=9.230,P<0.05)。在低盐水平下,植物相对邻体效应指数(RII)为0.240 0,显著大于0(t=8.055,P<0.05),即总根际效应为正效应;在中盐和高盐水平下,植物相对邻体效应指数(RII)分别为0.040 0、-0.110 0,均与0无显著差异,即总根际效应为中性效应。
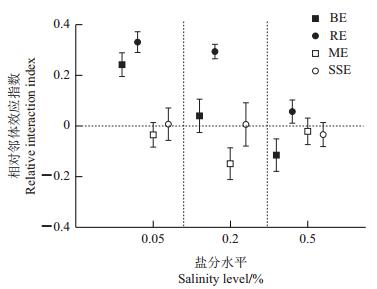 |
| BE:总根际效应;RE:根效应;ME:菌丝效应;SSE:土壤溶液效应。 BE: Belowground effect; RE: Root effect; ME: Mycorrhizal effect; SSE: Soil solution effect. 图6 不同处理条件下紫花苜蓿与柽柳间相对邻体效应指数(RII) Fig. 6 Relative interaction index(RII) between M. Sativa and T. chinensis under different treatments |
盐水平对根效应有显著影响(F2, 23=14.423,P<0.05)。在低盐和中盐水平下,植物相对邻体效应指数(RII)分别为0.330 3、0.294 4,显著大于0(t=8.005,P<0.05;t=10.467,P<0.05),即根际效应为正效应;在高盐水平下,植物相对邻体效应指数(RII)为0.057 2,与0无显著差异,即根际效应为中性效应。
虽然统计分析表明盐水平对菌丝效应强度的影响不显著(F2, 23=1.597,P<0.05),但是,菌丝效应在各盐分水平下性质不同。在中盐水平下,植物相对邻体效应指数(RII)为-0.150 0,显著低于0(P<0.05),即菌丝效应为负效应;在低盐和高盐水平下,植物相对邻体效应指数(RII)分别为-0.040 0、-0.020 0,均与0差异不显著,即菌丝效应为中性效应。
盐水平对土壤溶液效应的影响不显著(F2, 23= 0.115,P>0.05)。在各盐水平下,植物间仅土壤溶液相互作用时的相对邻体效应指数(RII)分别为0.006 0、0.006 0、-0.034 0,均与0无显著差异,即根际土壤溶液效应均为中性效应。
3 讨论本文以紫花苜蓿幼苗和柽柳幼苗为材料,研究土壤盐梯度下植物间地下部分相互作用,分析各根际因子对植物生长和邻体效应的影响。研究发现,不同根际因子对植物生长和邻体效应的调节不同,且调节作用受盐水平影响。随土壤盐水平升高,柽柳和紫花苜蓿幼苗间的根效应逐渐由正效应转变为中性效应,菌丝效应逐渐由中性效应转变为负效应再转变为中性效应,而土壤溶液效应表现为中性效应不变。
本试验发现,在低盐和中盐水平下,植物间完全相互作用(WN)时紫花苜蓿生物量显著高于其他根际有隔处理(+S+M-R、+S-M-R、-S-M-R)(P<0.05),这说明根际相互作用在低盐和中盐水平下促进了目标植物紫花苜蓿的生长;而在高盐水平下,邻体的根际促进作用则不显著。这个结果并不符合经典的胁迫梯度假说(stress gradient hypothesis, SGH)——随着胁迫梯度的增加,植物间相互作用会发生竞争减弱或互惠增强的变化。但是,以往也有研究发现,在适度胁迫下,植物间互惠效应更强,即沿胁迫梯度,植物相互作用强度呈现倒“U”趋势[33-34]。有研究表明,邻体为成体植株时能够促进胁迫环境中幼苗的生长,植物间相互作用表现为互惠;而邻体为幼苗时,植物间相互作用表现为中性[35]。本试验供试植物均为幼苗,随盐水平增加植物幼苗间地下互惠减弱,这可能是由于相邻幼苗对所需土壤资源的竞争逐渐加强,对环境的改善能力逐渐减弱。盐分含量低时,土壤中水分和矿质等养分丰富,能够满足植物生长,并使植物发挥其个体优势,从而相互作用表现为互惠。随着盐水平升高,紫花苜蓿生长受到盐分胁迫,其生物量显著降低,柽柳生物量随盐水平升高而有所增加,导致紫花苜蓿与柽柳植株大小产生差异。研究发现,紫花苜蓿适宜生长在盐水平较低的土壤中,而柽柳的耐盐极限较高,更适合在较高含盐量(>0.6%)的盐碱土中生长[36-37]。在高盐水平下较大的柽柳根生物量大、伸展范围广,吸收土壤中营养元素多,进而限制紫花苜蓿的生长。随着植物的生长,大小植物个体间对盐胁迫土壤中有限资源的竞争能力会扩大[38],当邻体幼苗对资源的竞争大于其自身对环境的改善时,幼苗之间的互惠就会减弱甚至转变为竞争。综合以上分析,本试验结果中柽柳和紫花苜蓿幼苗间的总根际效应随着盐胁迫梯度的变化比较符合倒“U”趋势是合理的。
相对邻体效应指数(RII)的结果分析进一步表明,各根际因子对邻体效应的影响有所不同。随着盐水平的升高,柽柳和紫花苜蓿幼苗间的根效应逐渐由正效应转变为中性效应,菌丝效应逐渐由中性效应转变为负效应再转变为中性效应,而土壤溶液效应表现为中性效应不变。有学者发现,对于根的互惠,一方面,根能够通过空间错位躲避邻近根,从而达到资源利用上的互补,并改善营养空间和生长环境[39];另一方面,深根植物可提取深层土壤的水分,与相邻植物共享,促进邻体植物生长[40]。本研究中供试植物柽柳属于深根性树种,与紫花苜蓿根系存在空间结构的差异,在低盐和中盐水平下,柽柳根系充分利用下层土壤的养分和水分,改善土壤理化性质,为紫花苜蓿创造良好的上层营养空间,发挥其正效应。然而,根的正效应并非一成不变,本研究结果显示,随盐水平增加,根的正效应减弱为中性效应。这可能是之前提到的在高盐水平下紫花苜蓿与柽柳生长异速,导致植株大小产生差异;也可能是土壤资源改变了根系间的相互作用[41],随盐水平增加,土壤愈加贫瘠,相邻植物根发生聚集,从而导致互惠作用减弱。
AMF对不同宿主植物的同时侵染,以及菌丝网络对不同植物个体之间养分、水分等资源的再分配,能够对植物生长和种间相互作用产生影响[21]。本试验显示,邻体的存在改变了盐分对目标植物AMF侵染率的影响,与无邻体相比,有邻体存在时,高盐水平下的紫花苜蓿的菌根侵染率升高(P<0.05)。这可能是邻体植物降低了土壤盐浓度,有利于目标植物丛枝菌根的形成和生长。对于菌丝对邻体效应的影响,研究显示,在中盐水平下,菌丝效应表现为负效应,这说明菌丝加剧了植物邻体间的竞争。菌丝加剧植物种间竞争的原因可能是增大了相邻宿主植物在土壤资源中吸收范围的重叠程度[42]。同时,菌丝也会影响植物的异速生长,促进更多能量和物质(N、P等)向植物地上部分转移,进而引起地上部分竞争加强[43]。本试验中,在中盐水平下,植物受到的盐胁迫较小,可以通过根吸收水分和营养物质来满足自身的绝大部分需求。在这种情况下,丛枝菌根真菌为促进宿主植物的生长和繁殖,一方面增加宿主植物地下部分对土壤中有限资源的竞争[44],另一方面分配更多的能量和资源给地上部分[42],从而加剧植物地上部分对光照和空间的争夺,使得相邻植物之间的竞争作用增强。然而,随着盐水平升高,植物根生长受到抑制,吸收的水分和养分有限,此时植物通过菌丝网络共享水分和养分等物质[45-46],使得邻体间的竞争作用减弱。与以往研究不同的是,在本试验中土壤溶液在各盐水平下均对植物邻体效应无显著影响,原因可能是供试植物为幼苗且生长期较短,使得根际土壤溶液中根分泌物、矿质养分等没有足够的积累,从而对植物的生长没有产生显著影响。
4 结论随着土壤盐水平的升高,柽柳幼苗的存在加剧了紫花苜蓿幼苗生物量对盐胁迫的负效应,但是柽柳幼苗的存在缓解了高盐胁迫对紫花苜蓿幼苗菌根侵染的抑制。相对邻体效应指数(RII)分析结果进一步表明,不同根际因子对植物间相互作用的调节不同,且调节作用受盐水平影响。土壤盐水平升高,柽柳和紫花苜蓿幼苗间的根效应逐渐由正效应转变为中性效应,菌丝效应逐渐由中性效应转变为负效应再转变为中性效应,而土壤溶液效应表现为中性效应不变。幼苗的存活和生长是胁迫环境下植物修复的重要环节,本研究结果有利于加深对植物幼苗地下相互作用的认识,为盐碱地植被选择和恢复提供理论依据。
| [1] |
BUTTERFIELD B J. Effects of facilitation on community stability and dynamics: Synthesis and future directions. Journal of Ecology, 2009, 97(6): 1192-1201. DOI:10.1111/jec.2009.97.issue-6 |
| [2] |
GOMEZ-APARICIO L. The role of plant interactions in the restoration of degraded ecosystems: A meta-analysis across life-forms and ecosystems. Journal of Ecology, 2009, 97(6): 1202-1214. DOI:10.1111/jec.2009.97.issue-6 |
| [3] |
DENYER J L, HARTLEY S E, JOHN E A. Both bottom-up and top-down processes contribute to plant diversity maintenance in an edaphically heterogeneous ecosystem. Journal of Ecology, 2010, 98(2): 498-508. DOI:10.1111/jec.2010.98.issue-2 |
| [4] |
MONTGOMERY R A, REICH P B, PALIK B J. Untangling positive and negative biotic interactions: Views from above and below ground in a forest ecosystem. Ecology, 2010, 91(12): 3641-3655. DOI:10.1890/09-1663.1 |
| [5] |
CALLAWAY R M, BROOKER R W, CHOLER P, et al. Positive interactions among alpine plants increase with stress. Nature, 2002, 417(6891): 844-848. DOI:10.1038/nature00812 |
| [6] |
DENG J M, WANG G X, MORRIS E C, et al. Plant massdensity relationship along a moisture gradient in north-west China. Journal of Ecology, 2006, 94(5): 953-958. DOI:10.1111/jec.2006.94.issue-5 |
| [7] |
ZHANG H, WANG G X, ZHENG K F, et al. Mass-density relationship changes along salinity gradient in Suaeda salsa L. Acta Physiologiae Plantarum, 2010, 32(6): 1031-1037. DOI:10.1007/s11738-010-0493-y |
| [8] |
JOHNSON N C, ROWLAND D L, CORKIDI L, et al. Nitrogen enrichment alters mycorrhizal allocation at five mesic to semiarid grasslands. Ecology, 2003, 84(7): 1895-1908. DOI:10.1890/0012-9658(2003)084[1895:NEAMAA]2.0.CO;2 |
| [9] |
HE Q, BERTNESS M D, ALTIERI A H. Global shifts towards positive species interactions with increasing environmental stress. Ecology Letters, 2013, 16(5): 695-706. DOI:10.1111/ele.2013.16.issue-5 |
| [10] |
MAESYRE F T, CALLAWAY R M, VALLADARES F. Refining the stress-gradient hypothesis for competition and facilitation in plant communities. Journal of Ecology, 2009, 97(2): 199-205. DOI:10.1111/jec.2009.97.issue-2 |
| [11] |
SMIT C, RIETKERK M, WASSEN M J. Inclusion of biotic stress (consumer pressure) alters predictions from the stress gradient hypothesis. Journal of Ecology, 2009, 97(6): 1215-1219. DOI:10.1111/jec.2009.97.issue-6 |
| [12] |
VAN DER HEIJDEN M G A, HORTON T R. Socialism in soil? The importance of mycorrhizal fungal networks for facilitation in natural ecosystems. Journal of Ecology, 2009, 97(6): 1139-1150. DOI:10.1111/jec.2009.97.issue-6 |
| [13] |
STHULTZ C M, GEHRING C A, WHITHAM T G. Shifts from competition to facilitation between a foundation tree and a pioneer shrub across spatial and temporal scales in a semiarid woodland. New Phytologist, 2007, 173(1): 135-145. DOI:10.1111/j.1469-8137.2006.01915.x |
| [14] |
VALLADARES F, ZARAGOZA-CASTELLS J, SANCHEZGOMEZ D, et al. Is shade beneficial for Mediterranean shrubs experiencing periods of extreme drought and late-winter frosts?. Annals of Botany, 2008, 102(6): 923-933. DOI:10.1093/aob/mcn182 |
| [15] |
王平, 王天慧, 周道玮, 等. 植物地上竞争与地下竞争研究进展. 生态学报, 2007, 27(8): 3489-3499. WANG P, WANG T H, ZHOU D W, et al. A literature review on the above-and below-ground competition. Acta Ecologica Sinica, 2007, 27(8): 3489-3499. (in Chinese with English abstract) DOI:10.3321/j.issn:1000-0933.2007.08.048 |
| [16] |
GOMEZ-APARICIO L, VALLADARES F, ZAMORA R, et al. Response of tree seedlings to the abiotic heterogeneity generated by nurse shrubs: An experimental approach at different scales. Ecography, 2005, 28(6): 757-768. DOI:10.1111/eco.2005.28.issue-6 |
| [17] |
LYNCH J M, WHIPPS J M. Substrate flow in the rhizosphere. Plant and Soil, 1990, 129(1): 1-10. DOI:10.1007/BF00011685 |
| [18] |
刘丹丹, 李敏, 刘润进. 我国植物根围促生细菌研究进展. 生态学杂志, 2016, 35(3): 815-824. LIU D D, LI M, LIU R J. Recent advances in the study of plant growth-promoting rhizobacteria in China. Chinese Journal of Ecology, 2016, 35(3): 815-824. (in Chinese with English abstract) |
| [19] |
邹亚丽, 王廷璞, 刘艳梅, 等. 苜蓿根系土壤浸提液对3种植物种子萌发和幼苗生长的影响. 安徽农业科学, 2009, 37(26): 12487-12489, 12505. ZOU Y L, WANG T P, LIU Y M, et al. Effect of the extract from the soil around the Alfalfa roots on three species of plant seed germination and seedling growth. Journal of Anhui Agricultural Sciences, 2009, 37(26): 12487-12489, 12505. (in Chinese with English abstract) DOI:10.3969/j.issn.0517-6611.2009.26.055 |
| [20] |
刘润进, 焦惠, 李岩, 等. 丛枝菌根真菌物种多样性研究进展. 应用生态学报, 2009, 20(9): 2301-2307. LIU R J, JIAO H, LI Y, et al. Research advances in species diversity of arbuscular mycorrhizal fungi. Chinese Journal of Applied Ecology, 2009, 20(9): 2301-2307. (in Chinese with English abstract) |
| [21] |
VAN DER HEIJDEN M G A, WIEMKEN A, SANDERS I R. Different arbuscular mycorrhizal fungi alter coexistence and resource distribution between co-occurring plant. New Phytologist, 2003, 157(3): 569-578. DOI:10.1046/j.1469-8137.2003.00688.x |
| [22] |
VAN DER HEIJDEN M G A. Arbuscular mycorrhizal fungi as support systems for seedling establishment in grassland. Ecology Letters, 2004, 7(4): 293-303. DOI:10.1111/ele.2004.7.issue-4 |
| [23] |
YANG H S, YU Z X, ZHANG Q, et al. Plant neighbor effects mediated by rhizosphere factors along a simulated aridity gradient. Plant and Soil, 2013, 369(1/2): 165-176. |
| [24] |
HE L, CHENG L L, HU L L, et al. Deviation from niche optima affects the nature of plant-plant interactions along a soil acidity gradient. Biology Letters, 2016, 12(1): 20150925. DOI:10.1098/rsbl.2015.0925 |
| [25] |
张贵启, 王晓娟, 孙向伟, 等. AM真菌与植物种内竞争的互作效应. 草业科学, 2009, 26(7): 115-121. ZHANG G Q, WANG X J, SUN X W, et al. The interaction effect of AM fungi and plants intraspecific competition. Pratacultural Science, 2009, 26(7): 115-121. (in Chinese with English abstract) |
| [26] |
于振兴.主壤盐胁迫下植物之间的相互作用及根系和丛枝菌根的影响.杭州: 浙江大学, 2015: 30-39. YU Z X. Plant-plant interactions and the effects of root systems and arbuscular mycorrhizal under salt stress. Hangzhou: Zhejiang University, 2015: 30-39. (in Chinese with English abstract) http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2882559 |
| [27] |
朱金方, 夏江宝, 陆兆华, 等. 盐旱交叉胁迫对柽柳幼苗生长及生理生化特性的影响. 西北植物学报, 2012, 32(1): 124-130. ZHU J F, XIA J B, LU Z H, et al. Growth, physiological and biochemical characteristics of Tamarix chinensis seedlings under salt-drought intercross stress. Acta Botanica BorealiOccidentalia Sinica, 2012, 32(1): 124-130. (in Chinese with English abstract) DOI:10.3969/j.issn.1000-4025.2012.01.020 |
| [28] |
张鑫, 裴宗平, 孙干, 等. 紫花苜蓿根际丛枝菌根真菌与土壤理化性质的相关性研究. 北方园艺, 2016, 13: 172-177. ZHANG X, PEI Z P, SUN G, et al. Correlation between physicochemical properties of rhizosphere soil and arbuscular mycorrhizae fungi in Medicago sativa L. grassland. Northern Horticulture, 2016, 13: 172-177. (in Chinese with English abstract) |
| [29] |
林亚萍, 刘文桃, 钱晓晴. 临海方强农场土壤盐分含量及测定方法研究. 安徽农业科学, 2007, 35(32): 10395-10396. LIN Y P, LIU W T, QIAN X Q. Content status and analysis method of soil salts from Linhai Fangqiang Farm. Journal of Anhui Agricultural Sciences, 2007, 35(32): 10395-10396. (in Chinese with English abstract) DOI:10.3969/j.issn.0517-6611.2007.32.095 |
| [30] |
KORMANIK P P, BRYAN W C, SCHULTZ R C, et al. Procedures and equipment for staining large numbers of plant-root samples for endomycorrhizal assay. Canadian Journal of Microbiology, 1980, 26(4): 536-538. DOI:10.1139/m80-090 |
| [31] |
GIOVANNETTI M, MOSSE B. Evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots. New Phytologist, 1980, 84: 489-500. DOI:10.1111/j.1469-8137.1980.tb04556.x |
| [32] |
ARMA S C, ORDIALES R, PUGNAIRE F I. Measuring plant interactions: A new comparative index. Ecology, 2004, 85(10): 2682-2686. DOI:10.1890/03-0650 |
| [33] |
CAVIERES L A, BADANO E I. Do facilitative interactions increase species richness at the entire community level?. Journal of Ecology, 2009, 97(6): 1181-1191. DOI:10.1111/jec.2009.97.issue-6 |
| [34] |
HOLMGREN M, SCHEFFER M. Strong facilitation in mild environments: The stress gradient hypothesis revisited. Journal of Ecology, 2010, 98(6): 1269-1275. DOI:10.1111/jec.2010.98.issue-6 |
| [35] |
FAJARDO A, MCINTIRE E J B. Under strong niche overlap conspecifics do not compete but help each other to survive: Facilitation at the intraspecific level. Journal of Ecology, 2011, 99(2): 642-650. |
| [36] |
BERTNESS M D, COVERDALE T C. An invasive species facilitates the recovery of salt marsh ecosystems on Cape Cod. Ecology, 2013, 94(9): 1937-1943. DOI:10.1890/12-2150.1 |
| [37] |
张雪, 贺康, 宁史, 等. 盐胁迫对柽柳和白刺幼苗生长与生理特性的影响. 西北农林科技大学学报(自然科学版), 2017, 45(1): 105-111. ZHANG X, HE K, NING S, et al. Effects of salt stress on growth and physiological characteristics of Tamarix chinensis and Nitraria tangutorum seedlings. Journal of Northwest A & F University (Natural Science Edition), 2017, 45(1): 105-111. (in Chinese with English abstract) |
| [38] |
陈仁飞, 姬明飞, 关佳威, 等. 植物对称性竞争与非对称性竞争研究进展及展望. 植物生态学报, 2015, 39(5): 530-540. CHEN R F, JI M F, GUAN J W, et al. Advances and prospects in plant symmetric and asymmetric competition. Chinese Journal of Plant Ecology, 2015, 39(5): 530-540. (in Chinese with English abstract) |
| [39] |
FALIK O, REIDES P, GERSANI M, et al. Self/non-self discrimination in roots. Journal of Ecology, 2003, 91(4): 525-531. DOI:10.1046/j.1365-2745.2003.00795.x |
| [40] |
陈伟, 薛立. 根系间的相互作用:竞争与互利. 生态学报, 2004, 4(6): 1243-1251. CHEN W, XUE L. Root interactions: Competition and facilitation. Acta Ecologica Sinica, 2004, 4(6): 1243-1251. (in Chinese with English abstract) DOI:10.3321/j.issn:1000-0933.2004.06.023 |
| [41] |
CASOER B B, JACKSON R B. Plant competition underground. Annual Review of Ecology and Systematics, 1997, 28: 545-570. DOI:10.1146/annurev.ecolsys.28.1.545 |
| [42] |
KOIDE R T. Density dependent response to mycorrhizal infection in Abutilon theophrasti Medic. Oecologia, 1991, 85(3): 389-395. DOI:10.1007/BF00320615 |
| [43] |
ZHANG Q, ZHANG L, WEINER J, et al. Arbuscular mycorrhizal fungi alter plant allometry and biomass-density relationships. Annals of Botany, 2011, 107(3): 407-413. DOI:10.1093/aob/mcq249 |
| [44] |
SHUMWAY D L, KOIDE R T. Size and reproductive inequality in mycorrhizal and nonmycorrhizal populations of Abutilon theophrasti. Journal of Ecology, 1995, 83(4): 613-620. DOI:10.2307/2261629 |
| [45] |
MEDING S M, ZASOSKI R J. Hyphal-mediated transfer of nitrate, arsenic, cesium, rubidium, and strontium between arbuscular mycorrhizal forbs and grasses from a California oak woodland. Soil Biology & Biochemistry, 2008, 40(1): 126-134. |
| [46] |
MIKKELSEN B L, ROSENDAHL S, JAKOBSEN I. Underground resource allocation between individual networks of mycorrhizal fungi. New Phytologist, 2008, 180(4): 890-898. DOI:10.1111/nph.2008.180.issue-4 |
 2018, Vol. 44
2018, Vol. 44


