| 春榨菜细胞质雄性不育系09-05A的形态学和细胞学特征 |
榨菜(Brassica juncea var. tumida Tsen et Lee),学名茎瘤芥,因其茎在发育过程中膨大并呈瘤状凸起,在加工腌制成产品的过程中有压榨的工艺,所以通常被俗称为榨菜。榨菜是起源于我国的一个芥菜变种,属于十字花科芸薹属[1]。榨菜是我国重要的对外出口产品,平均每年出口约20万t,其营养丰富,加工后味道独特、脆嫩爽口,与日本酱菜、欧洲酸菜并称为世界三大名腌菜,深受消费者喜爱[2]。
植物雄性不育是指雄性生殖器官无法产生正常功能的花药、花粉或雄配子的一种遗传现象,在被子植物中普遍存在。细胞质雄性不育(cytoplasmic male sterility,CMS)受细胞核基因、细胞质基因和正常代谢的共同控制,具有相应的保持系和恢复系,在生产上应用价值巨大[3]。芸薹属作物拥有丰富的细胞质雄性不育类型,并在大白菜、甘蓝、油菜和芥菜等作物上得到了广泛应用。目前,已经公开报道的不育系主要有ogu CMS[4]、nap CMS[5]、tour CMS[6]、pol CMS[7]、hau CMS[8]、orf220 CMS[9-10]等。这些起源不同的细胞质雄性不育系在性状表现、不育机制等方面均存在较大差异,因此,从细胞生物学的角度系统研究不同类型胞质雄性不育系的不育机制,将为育种工作者更为有效利用这些胞质不育源提供重要的参考。
欧新A是史华清等[11]在芥菜型油菜中发现并选育成的雄性不育材料,不育株率达100%,不育性世代稳定。范永红等[12]将欧新A不育胞质转育到冬榨菜中,育成了多个榨菜胞质雄性不育系。目前,该雄性不育系的分子机制和不育机制尚不清楚。前期,我们以冬榨菜欧新A雄性不育系为不育源,育成了不育性状稳定、综合性状良好的春榨菜雄性不育系09-05A,并利用该不育系成功培育出了杂交品种。本研究通过对春榨菜雄性不育系09-05A不同发育时期的花药和花粉进行细胞学观察,探索花粉败育的发生时期和细胞学特征,为春榨菜雄性不育的杂种优势利用和雄性不育的发育机制研究提供理论依据。
1 材料与方法 1.1 材料榨菜细胞质雄性不育系09-05A及其保持系于2016年10月种植在浙江省宁波市农业科学研究院蔬菜研究所生产基地,在正常条件下进行栽培管理。次年4月,于盛花期取09-05A不育系和保持系的花序进行形态学观察和生活力测定。
1.2 花粉粒形态扫描电镜观察采集刚开放的花朵,抖动花药使花粉粒散落在贴有双面胶的金属载物台上,并用牙签轻轻地将花粉粒涂布均匀,在Eiko IB5离子喷射义中喷镀金粉4~5 min,之后在Hitachi Model TM-1000型扫描电镜下观察花粉粒形态。
1.3 花粉粒乙酸荧光素染色将2 mg乙酸荧光素(fluorescein diacetate, FDA)溶于1 mL丙酮中作为母液,储存在-20 ℃冰箱中备用。使用前,将FDA母液用0.5 mol/L蔗糖溶液稀释至0.01%。在载玻片上滴一滴FDA染色液,取刚开放的花朵,用镊子抖动花药,使花粉粒散落在染色液中,盖上盖玻片,赶走气泡,于室温、黑暗中放置30 min后,在短蓝光激发的显微镜(DMLB,徕卡,德国)下拍照观察。
1.4 花粉粒4’,6-二脒基-2-苯基吲哚染色在载玻片上滴1滴1 μg/L的4’,6-二脒基-2-苯基吲哚(4’, 6-diamidino-2-phenylindole, DAPI)染液,取刚开放的花朵,抖动花药使花粉粒散落在染色液中,盖上盖玻片,赶走气泡,于室温、黑暗中放置30 min后,于紫外灯激发的显微镜(DMLB,徕卡,德国)下拍照观察。
1.5 花药半薄切片观察参照王洁[13]的方法,将样品进行包埋处理,用半薄切片机(LKB 11800)切片,获得厚度为100 nm的树脂切片,在载玻片上滴1滴蒸馏水,将树脂切片放入水滴中,于85 ℃条件下在REICHERT-JUNG HK120展片机上展片。将切片用1%亚甲基蓝染色后在显微镜(DMLB,徕卡,德国)下观察拍照。
1.6 小孢子形态超薄透射电镜观察将包埋好的小孢子样品在Richard超薄切片机中切片,获得厚度为50 nm的树脂切片。用具有Fovara膜的铜镍载网捞片,然后用乙酸双氧铀和柠檬酸铅染色液各染色15 min,干燥后于Hitachi ModelH-7650型透射电镜下观察拍照。
2 结果 2.1 不育系09-05A花器官形态前期,我们首次将欧新A不育源转育到春榨菜中,经多代回交,成功培育了春榨菜雄性不育系09-05A,该不育系与冬榨菜欧新A不育系在叶片形状、株高、瘤状茎大小、营养生长期等方面存在明显差异(表 1)。
| 表1 雄性不育系09-05A与冬榨菜欧新A主要农艺性状比较 Table 1 Comparison of main agronomic traits between cytoplasmic male sterility system (CMS) 09-05A and oxa A transferred in winter stem mustard |
 |
| 点击放大 |
对不育系09-05A及其保持系(Ma)的花蕾和开放花的花器官形态进行观察(图 1)发现,不育系09-05A在蕾期(开花前5~7 d)表现出明显的花柱外露现象(图 1E、F),开放花花冠整体较小(图 1G),花药狭长干瘪(图 1H、J、K)等特点。分别将09-05A及其保持系的花柱和雄蕊进行剥离并比较其长度发现,09-05A与其保持系(Ma)相比花柱较长(图 1I),且雄蕊较短(图 1J、K)。
 |
| A、B、E、F:蕾期;C、D、G、H:花开放期;I:花柱;J:长雄蕊;K:短雄蕊。标尺=2 mm。 A, B, E, F: Flowers at the bud stage; C, D, G, H: Flowers at the blossom stage; I: Style; J: The longer stamen; K: The shorter stamen. Ma: Maintainer line; 09-05A: CMS line. Bar=2 mm. 图1 花器官形态学观察 Fig. 1 Morphological observation of flower organs |
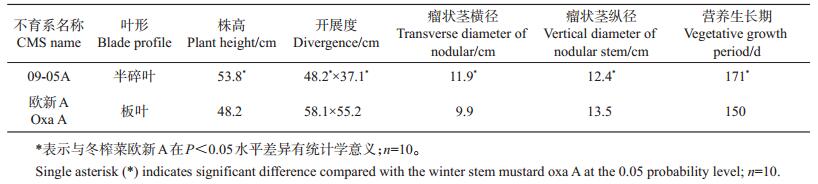
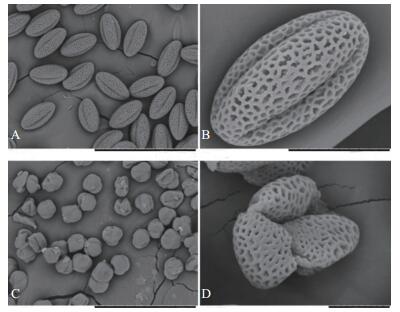
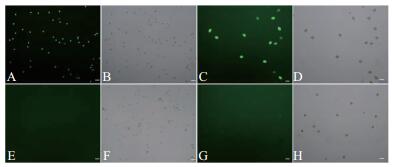
对不育系09-05A及其保持系成熟花粉粒进行扫描电镜观察(图 2)发现,不育系09-05A花粉粒形态异常,萌发沟塌陷。利用FDA对成熟花粉粒进行染色发现:保持系的花粉粒在蓝光激发下能够发出荧光(图 3A、C),花粉粒表现出具有生活力;而不育系09-05A的花粉粒在蓝光激发下未能检测到荧光信号(图 3E、G),花粉粒没有生活力。利用DAPI对成熟花粉粒进行染色,可以清楚地看到保持系成熟花粉粒细胞的3个细胞核(图 4A),而在不育系09-05A中未观察到花粉粒细胞核荧光信号(图 4C)。
 |
| A、B:保持系花粉粒;C、D:不育系花粉粒。A、C:标尺=100 μm;B:标尺=20 μm;D:标尺=10 μm。 A, B: Pollen grains of the maintainer line; C, D: Pollen grains of 09-05A CMS line. A, C: Bar=100 μm; B: Bar=20 μm; D: Bar= 10 μm. 图2 花粉粒扫描电镜观察 Fig. 2 Scanning electron microscopy (SEM) observation of pollen grains |
 |
| A~D:保持系花粉粒;E~H:不育系花粉粒。B、F、D、H分别为A、C、E、G的白场。标尺=50 μm。 A-D: Pollen grains of the maintainer line; E-H: Pollen grains of 09-05A CMS line. B, F, D, H are corresponding bright field images of A, C, E, G, respectively. Bar=50 μm. 图3 花粉粒生活力观察 Fig. 3 Observation on viability of pollen grains |
 |
| A~B:保持系花粉粒;C~D:不育系花粉粒。B、D分别为A、B的白场;箭头处为细胞核。标尺=25 μm。 A-B: Pollen grains of the maintainer line; C-D: Pollen grains of 09-05A CMS line. B and D are corresponding bright field images of A and B, respectively. The nuclei were marked with arrows. Bar= 25 μm. 图4 花粉粒细胞核DAPI染色观察 Fig. 4 DAPI staining observation of pollen grain nucleus |
为了进一步明确不育系09-05A花粉败育的发生时期,本研究参照拟南芥不同花药发育时期划分标准[14],观察了不同发育时期09-05A的花药横切半薄切片。结果表明:保持系和不育系都能正常形成四分体(图 5A、F);保持系小孢子从四分体中释放出来后,形成形状不规则、无细胞壁的单核细胞(图 5B);随着花粉发育进程的进行,保持系小孢子细胞内逐渐产生一些液泡,细胞壁开始形成,最终形成圆形、细胞核靠边、拥有大液泡的单核细胞(图 5C、D);类似REGAN等的研究[15],随后小孢子对液泡进行再吸收,紧接着进行第一次有丝分裂(图 5E);小孢子经过2次有丝分裂之后形成拥有3个细胞核的细胞(数据未显示)。不育系09-05A的小孢子同样能够从四分体中正常释放出来,形成形状不规则、无细胞壁的单核细胞(图 5G);然而,随着小孢子液泡化程度的进行,不育系09-05A的花药室内逐渐开始出现异常形态的小孢子,这些小孢子不能被二甲基蓝染料正常着色,细胞内的部分内含物丢失(图 5H、I);当小孢子发育至有丝分裂时期时,不育系09-05A花药室内异常形态的小孢子达到100%(图 5J)。
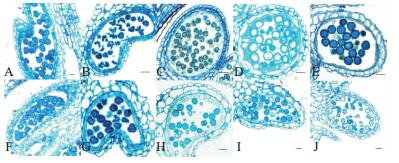 |
| A~E:保持系花药;F~J:不育系花药。A、F:四分体时期花药;B、G:小孢子释放时期花药;C、H:小孢子液泡化早期花药;D、I:小孢子液泡化时期花药;E、J:小孢子有丝分裂时期花药。标尺=50 μm。 A-E: Anthers of the maintainer line; F-J: Anthers of the 09-05A CMS line. A, F: Anthers at the tetrad stage; B, G: Anthers at the justreleased microspore stage; C, H: Anthers at the early-vacuolate microspore stage; D, I: Anthers at the vacuolate microspore stage; E, J: Anthers at the mitotic stage. Bar=50 μm. 图5 花药横切面观察 Fig. 5 Transverse section observation of anthers |
进一步利用超薄透射电镜对小孢子横切面进行超微结构观察发现:在小孢子液泡化早期,保持系小孢子细胞核及各类细胞器清晰可见,液泡开始出现并散落在细胞质内,细胞壁和表面覆盖物已形成(图 6A);随着小孢子进入液泡化时期,液泡数量变少,体积变大,一个大液泡明显清晰地分布在细胞质中,细胞核被液泡挤至细胞边缘(图 6C);随后,小孢子进入有丝分裂时期,大液泡消失(图 6E)。不育系09-05A的小孢子在液泡化早期细胞壁和表面覆盖物发育完全,萌发沟正常,但细胞质逐渐开始出现异常,表现为液泡体积不断增大,细胞核、细胞器等细胞内含物逐渐降解(图 6B、D);当小孢子发育进入有丝分裂时期,小孢子细胞内细胞质、细胞核、细胞器等内含物基本完全降解,只剩下残留的碎片,细胞壁覆盖物脱落,萌发沟处发生不正常内陷和折叠,细胞成空瘪、畸形状态(图 6F)。
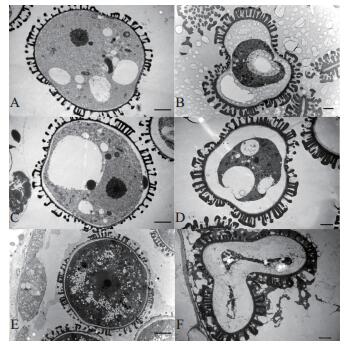 |
| A、C、E:保持系小孢子;B、D、F:不育系小孢子。A~B:小孢子液泡化早期;C~D:小孢子液泡化时期;E~F:小孢子有丝分裂时期。A、B、C、D、F:标尺=2 μm;E:标尺=5 μm。 A, C, E: Microspores of the maintainer line; B, F, D: Microspores of the 09-05A CMS line. A-B: Early-vacuolate microspores; C-D: Vacuolate microspores; E-F: Mitotic microspores. A, B, C, D, F: Bar=2 μm; E: Bar=5 μm. 图6 小孢子横切面观察 Fig. 6 Transverse section observation of microspores |
细胞质雄性不育是广泛存在于高等植物中的母性遗传现象,是核基因、细胞器基因和生长代谢等因素综合作用的结果。其中,核基因起主要作用,线粒体在腺苷三磷酸(ATP)供应、电子传递、蛋白质翻译等代谢过程中起着至关重要的作用[16]。研究表明,基于线粒体特异基因的分子标记是鉴定不同类型细胞质雄性不育系的一种有效手段[17]。HENG等[18]根据目前已报道的十字花科作物雄性不育系不育基因的保守序列设计线粒体特异基因分子标记,通过聚合酶链式反应(PCR)发现,在冬榨菜欧新A不育系及其保持系中未检测到这些细胞质特异性分子标记,表明欧新A不育系与其他报道的十字花科细胞质雄性不育系(包括ogu CMS、nap CMS、tour CMS、pol CMS、hau CMS、Moricandia arvensis CMS、orf220 CMS)不同,是一种新型的细胞质雄性不育类型。
花粉败育是细胞质雄性不育的主要表现型,不同类型的细胞质雄性不育系其花药发育的败育时期和特征也各不相同。研究发现,ogu CMS花粉败育发生在小孢子四分体至单核花粉期,不育系的绒毡层细胞畸形,表明其败育与绒毡层的不正常发育有关[19]。胡永敏等[20]对多种甘蓝型油菜细胞质雄性不育系进行细胞学观察发现,pol和nap CMS小孢子败育时期为孢原细胞时期,不能进行造孢细胞和壁细胞的分化。邹瑞昌等[21]将油菜hau CMS转育到叶用芥菜中研究发现:不育系花药发育部分受阻于孢原细胞分化期,不能正常行成花粉囊;部分受阻于花粉母细胞时期至单核小孢子时期,花粉母细胞虽能正常进行减数分裂,但发育到四分体时期或单核时期时细胞解体。HENG等[18]研究发现,将油菜欧新A雄性不育系转育至冬榨菜,不育系花粉败育发生在单核细胞晚期,小孢子呈现液泡化,至花粉成熟时期,导致花粉完全败育。以上研究表明,在不同遗传背景下不同CMS花药在发育过程中表现的败育时期和细胞学特点不同。
研究表明,相同不育源转育到不同物种中,CMS表现型会表现出差异[22]。本研究通过对春榨菜雄性不育系09-05A的花器官进行形态观察发现,该不育系表现出的柱头蕾期外露、雄蕊显著缩短等生物学性状与冬榨菜欧新A雄性不育系[18]基本相同。通过对不同发育时期的花药和小孢子横切面观察和进一步深入分析发现:春榨菜雄性不育系09-05A花粉发育从单核小孢子中期(即小孢子液泡化早期)开始出现紊乱,稍早于冬榨菜欧新A雄性不育系花粉败育时期(单核小孢子晚期);随着花粉发育的进行,不育系09-05A小孢子液泡化程度增加,同时细胞核、细胞器等物质逐渐降解,至小孢子有丝分裂时期,已表现出100%的畸形和空瘪,花粉败育持续时间略短于冬榨菜欧新A雄性不育系。以上差异可能与物种间不同生态类型差异有关。
4 结论本研究通过对春榨菜雄性不育系09-05A的花器官进行形态观察、花粉育性进行鉴定及不同发育时期的花药和小孢子横切面进行深入分析研究发现:不育系09-05A的花器官表现出结构性异常,主要表现为蕾期花柱外露,雄蕊缩短;花粉粒没有生活力,高度不育;花粉发育在小孢子液泡化早期开始出现紊乱,至花粉有丝分裂时期表现出100%败育,细胞呈现出畸形、空瘪、不完整等表现型。结合细胞学观察结果,推测小孢子细胞非正常液泡化是导致花粉败育的原因。与冬榨菜欧新A雄性不育系花药发育过程中表现的败育时期和细胞学特点进行比较分析发现,二者在花粉败育时期和过程等方面略有不同,说明同一不育源转育至不同生态类型品种的雄性不育系细胞学特性可能会产生一定的差异。本研究为深入进行榨菜雄性不育的发育机制研究和春榨菜细胞质雄性不育的杂种优势利用奠定了一定的基础,还有待进一步深入进行相关不育基因的鉴定和研究。
致谢
重庆市渝东南农业科学研究院提供了“榨菜欧新A”不育源,并对本科研工作予以了大力支持,谨致谢意!
| [1] |
SCHMIDT R, BANCROFT I. Genetics and Genomics of the Brassicaceae. New York, US: Springer, 2011.
|
| [2] |
FAN Y H, SHEN J J, DONG D W, et al. Development status and research prospect of mustard vegetables industry. Agricultural Science and Technology, 2017, 18(3): 556-564. |
| [3] |
CHEN L T, LIU Y G. Male sterility and fertility restoration in crops. Annual Review of Plant Biology, 2014, 65: 579-606. DOI:10.1146/annurev-arplant-050213-040119 |
| [4] |
OGURA H. Studies on the new male sterility in Japanese radish, with special reference to the utilization of this sterility towards the practical raising of hybrid seeds. Memoirs of the Faculty of Agriculture Kagoshima University, 1967, 6(3): 1446-1459. |
| [5] |
THOMPSON K F. Cytoplasmic male-sterility in oil-seed rape. Heredity, 1972, 29: 253-257. DOI:10.1038/hdy.1972.89 |
| [6] |
RAWAT D S, ANAND I J. Male sterility in Indian mustard. Indian Journal of Genetics & Plant Breeding, 1979, 39(3): 412-414. |
| [7] |
FU T D. Production and research of rapeseed in the People' s Republic of China. Eucarpia Cruciferae News, 1981, 6: 6-7. |
| [8] |
WAN Z J, JING B, TU J X, et al. Genetic characterization of a new cytoplasmic male sterility system (hau) in Brassica juncea and its transfer to B. napus. Theoretical & Applied Genetics, 2008, 116(3): 355-362. |
| [9] |
ZHANG M F, CHEN L P, WANG B L, et al. Characterization of atp A and orf 220 genes distinctively present in a cytoplasmic male-sterile line of tuber mustard. Journal of Pomology & Horticultural Science, 2003, 78(6): 837-841. |
| [10] |
YANG J H, LIU X Y, YANG X D, et al. Mitochondriallytargeted expression of a cytoplasmic male sterilityassociated orf220 gene causes male sterility in Brassica juncea. BMC Plant Biology, 2010, 10: 231. DOI:10.1186/1471-2229-10-231 |
| [11] |
史华清, 龚瑞芳, 庄丽莲, 等. 芥菜型油菜(Brassica Juncea)杂种优势利用的研究. 作物学报, 1991, 17(1): 32-41. SHI H Q, GONG R F, ZHUANG L L, et al. Studies on the utilization of heterosis in mustard (Brassica juncea). Acta Agronomica Sinica, 1991, 17(1): 32-41. (in Chinese with English abstract) DOI:10.3321/j.issn:0496-3490.1991.01.005 |
| [12] |
范永红, 周光凡, 陈材林. 茎瘤芥胞质雄性不育系的选育及其主要性状调查. 中国蔬菜, 2001(5): 4-7. FAN Y H, ZHOU G F, CHEN C L. Breeding of cytoplasm male sterility (CMS) lines of tuber mustard and investigation of their main characters. China Vegetables, 2001(5): 4-7. (in Chinese with English abstract) DOI:10.3969/j.issn.1000-6346.2001.05.002 |
| [13] |
王洁.植物MAPK级联途径基因家族的进化分析及番茄SlMPK13的功能鉴定.杭州: 浙江大学, 2015. WANG J. The evolutionary analysis of MAPK cascade gene families in plant and functional characterization of SlMPK13 in tomato. Hangzhou: Zhejiang University, 2015. (in Chinese with English abstract) http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2954709 |
| [14] |
SANDERS P M, BUI A Q, WETERINGS K, et al. Anther developmental defects in Arabidopsis thaliana male-sterile mutants. Sexual Plant Reproduction, 1999, 11(6): 297-322. DOI:10.1007/s004970050158 |
| [15] |
REGAN S M, MOFFATT B A. Cytochemical analysis of pollen development in wild-type arabidopsis and a malesterile mutant. Plant Cell, 1990, 2(9): 877-889. DOI:10.1105/tpc.2.9.877 |
| [16] |
胡琼, 李云昌. 体细胞杂交在油菜细胞质雄性不育创建和改良中的应用. 作物学报, 2006, 32(1): 138-143. HU Q, LI Y C. Induction and improvement of cytoplasmic male sterility in oilseed Brassica by somatic hybridization. Acta Agronomica Sinica, 2006, 32(1): 138-143. (in Chinese with English abstract) DOI:10.3321/j.issn:0496-3490.2006.01.023 |
| [17] |
LIU G, ZHAO Z K, XIAO M L, et al. Repetitive sequence characterization and development of SSR and CMS-genespecific markers in the Brassica mitochondrial genomes. Molecular Breeding, 2015, 35: 219. DOI:10.1007/s11032-015-0413-3 |
| [18] |
HENG S P, LIU S S, XIA C X, et al. Morphological and genetic characterization of a new cytoplasmic male sterility system (oxa CMS) in stem mustard (Brassica juncea). Theoretical & Applied Genetics, 2018, 131(1): 59-66. |
| [19] |
GONZALEZ-MELENDI P, UYTTEWAAL M, MORCILLO C N, et al. A light and electron microscopy analysis of the events leading to male sterility in Ogu-INRA CMS of rapeseed (Brassica napus). Journal of Experimental Botany, 2008, 59(4): 827-838. DOI:10.1093/jxb/erm365 |
| [20] |
胡永敏, 董军刚, 孟倩, 等. 5种甘蓝型油菜细胞质雄性不育系的细胞学观察. 西北农业学报, 2012, 21(7): 95-99, 106. HU Y M, DONG J G, MENG Q, et al. Cytological observation on anther development of five CMS lines in Brassica napus. Acta Agriculturae Boreali-Occidentalis Sinica, 2012, 21(7): 95-99, 106. (in Chinese with English abstract) DOI:10.3969/j.issn.1004-1389.2012.07.018 |
| [21] |
邹瑞昌, 万正杰, 徐跃进, 等. 新型叶用芥菜细胞质雄性不育系0912A的花药发育特征. 华中农业大学学报, 2012, 31(1): 44-49. ZOU R C, WAN Z J, XU Y J, et al. Anther development of 0912A as a novel cytoplasmic male sterile line of leaf mustard. Journal of Huazhong Agricultural University, 2012, 31(1): 44-49. (in Chinese with English abstract) DOI:10.3969/j.issn.1000-2421.2012.01.008 |
| [22] |
MEUR G, GAIKWAD K, BHAT S R, et al. Homeotic-like modification of stamens to petals is associated with aberrant mitochondrial gene expression in cytoplasmic male sterile Ogura Brassica juncea. Journal of Genetics, 2006, 85(2): 133-139. DOI:10.1007/BF02729019 |
 2018, Vol. 44
2018, Vol. 44


