| 不同贮藏时间对食用菌多糖含量及其抗氧化活性的影响 |
食用菌多糖不仅在抗氧化、抗肿瘤和抗病原体等方面有显著作用[1-2],还是一种很好的免疫调节增强剂[3]。近年来,食用菌多糖在抗氧化和抗肿瘤方面的研究越来越受到关注[4-8]。然而,随着贮藏时间的延长,食用菌多糖的含量和生物活性会发生变化。张佳欣[9]指出,茯砖茶中多糖的抗氧化能力随着贮藏年限的增加先升后降,并在第3年达到最佳。
HepG2细胞是广泛应用于癌症机制、遗传学和营养学等研究的一类细胞株,其分化程度高,具有相对正常肝实质细胞的表型,还能够行使正常肝细胞的代谢解毒功能,分泌正常肝细胞特征的蛋白[9-10]。此外,HepG2细胞増殖能力强,易于获得且多次传代后仍能保持原有的生理状态,可被用作替代肝细胞的理想细胞系[11]。过氧化氢(H2O2)是氧气的二电子还原产物,是一种氧化性很强的活性氧[12],可以穿透大部分细胞膜,增加细胞毒性,如乳酸脱氢酶(lactate dehydrogenase, LDH)渗漏显著,脂质过氧化,DNA损伤增加及还原型谷胱甘肽(glutathione reduced, GSH)水平降低[13],而且还有易于获得、性质比较稳定等特点;因此,H2O2氧化损伤模型已成为目前应用最广泛的一种细胞损伤模型[14]。
之前人们对于食用菌多糖的研究主要侧重于提取、纯化和分离[5-6, 15-17],而很少涉及不同贮藏时间对食用菌多糖提取率和多糖生物活性影响的研究。因此,本文以香菇、杏鲍菇和黑木耳为研究对象,初步研究不同贮藏时间对食用菌多糖提取率的影响,并建立H2O2诱导HepG2细胞氧化损伤模型对HepG2细胞预保护再损伤,从细胞学的角度探究不同贮藏时间对食用菌多糖抗氧化活性的影响,为合理确定不同食用菌贮藏年限提供理论依据。
1 材料与方法 1.1 材料 1.1.1 材料来源3种试验材料香菇808、黑木耳916和杏鲍菇kE015均由浙江百兴食品有限公司提供。
1.1.2 细胞与试剂人肝癌HepG2细胞系购自中国科学院上海细胞生物学研究所细胞库;DMEM培养液、胎牛血清、青霉素/链霉素双抗溶液、0.25%胰蛋白酶[含0.5%乙二胺四乙酸(ethylenediaminetetraacetic acid, EDTA)]及磷酸盐缓冲液(phosphate buffer solution, PBS)购自美国GIBICO公司;CCK-8试剂盒购自日本同仁研究所;超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)和乳酸脱氢酶(LDH)试剂盒购自碧云天生物技术研究所;其余药品、试剂均为国产,分析纯。
1.2 试验设计 1.2.1 食用菌多糖的提取设置3×4双因子试验,即3种食用菌材料(香菇808、杏鲍菇kE015、黑木耳916)、4种贮藏时间(1、2、3和4年),每组试验重复3次。食用菌多糖含量的提取采用超声辅助复合酶法[17]。
具体步骤为:称取3.00 g食用菌干粉,加入60 mL蒸馏水混合均匀,进行超声波细胞破碎(超声工作5 s,间隙5 s,超声波功率720 W,总工作时间20 min)后,置于50 ℃水浴0.5 h;称取果胶酶和纤维素酶,按料液比1:21.17、复合酶比1.96:1加入食用菌溶液中,反应1 h后抽滤,滤液于沸水中灭酶10 min,温度降至室温后,将酶提取液于5 000 r/min条件下离心5 min,取上清液,于75 ℃、0.09 Pa条件下浓缩到总上清液体积的2/5~1/2;加入3倍体积的95%乙醇溶液,置于4 ℃冰箱中静置24 h后,取出,以4 000 r/min离心20 min;将沉淀溶解、定容、稀释后,采用蒽酮-硫酸法测定多糖总量。
1.2.2 食用菌多糖对H2O2诱导的HepG2细胞存活率影响的测定[18-21]设置3×4×4三因子试验,即:3种食用菌材料(香菇808、杏鲍菇kE015和黑木耳916);4种贮藏时间(1、2、3和4年);给药组(4种食用菌多糖提取物终质量浓度为0.25、0.5、1和2 mg/mL的完全培养液);H2O2诱导的对照组(加入完全培养液)。每组设3个重复。
具体操作参照CCK-8试剂盒的说明书进行。将HepG2细胞以6×103个/孔的密度接种于96孔板上,培养24 h后,换成含有食用菌多糖提取物,继续培养24 h,经PBS洗涤2次后加入60 μmol/L H2O2培养液作用2 h;根据CCK-8法测定各组的细胞存活率。
1.2.3 食用菌多糖对H2O2氧化损伤的HepG2细胞中SOD、MDA、LDH水平影响的测定[19, 21-23]设置3×4×3三因子试验,即:3种食用菌材料(香菇808、杏鲍菇kE015和黑木耳916);4种贮藏时间(1、2、3和4年);正常对照组(加入完全培养液);模型组(H2O2诱导组,加入完全培养液);给药组(食用菌多糖质量浓度为0.5、1和2 mg/mL)。每组3个重复。
酶活性的测定参照SOD、MDA和LDH试剂盒的说明书进行,具体操作方法如下。将对数生长期的细胞按5×105个/孔的密度接种于6孔板上,按上述设置的试验分组培养24 h;将苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)加入细胞裂解液中,使裂解液中的PMSF最终浓度为1 mmol/L;将各组细胞消化收集到EP管中,2 000 r/min离心5 min,然后放入冰盒;弃上清液,再加入1 mL PBS,离心以去除胰酶;每管加入100 μL裂解液,涡旋混匀;于4 ℃、1×104 g条件下离心5 min,取上清液用于各类酶活性的测定。
1.3 数据统计采用单因素方差分析(one-way ANOVA)和因子方差分析(factorial ANOVA)对数据进行正态性和方差齐性分析,采用STATISTICA 8.0软件对数据进行统计分析。结果以“平均值±标准差”表示,显著性水平为P<0.05。
2 结果与分析 2.1 不同贮藏时间对食用菌多糖提取率的影响由图 1和表 1可知:香菇多糖的提取率最高[贮藏3年的提取率为(6.92±0.18)%],杏鲍菇多糖次之,黑木耳多糖的提取率最低,且不同食用菌类型的多糖提取率存在显著差异(P<0.05);不同贮藏时间对香菇、杏鲍菇多糖提取率的影响没有显著差异,但贮藏1年的黑木耳多糖提取率[(2.61±0.73)%]和贮藏3年的黑木耳多糖提取率[(1.72±0.09)%]之间差异达显著水平(P<0.05)。
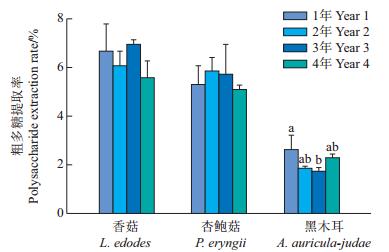 |
| 短栅上的不同小写字母表示在P<0.05水平差异有统计学意义,未标字母表示在P<0.05水平差异无统计学意义;n=3。 Different lowercase letters above bars represent statistically significant differences at the 0.05 probability level, and no lowercase letter represents no statistically significant difference; n=3. 图1 不同贮藏时间的食用菌粗多糖的提取率 Fig. 1 Extraction rate of polysaccharide from edible fungi at different storage time |
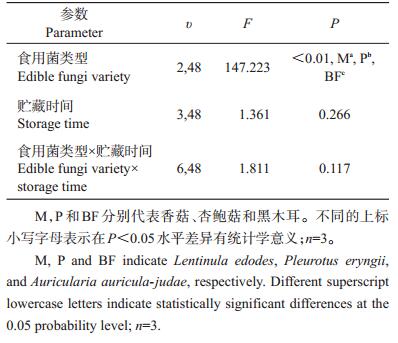
| 表1 食用菌类型、贮藏时间及两者的交互作用对食用菌多糖提取率的影响 Table 1 Effects of edible fungi variety, storage time and their interaction on extraction rate of polysaccharides from edible fungi |
 |
| 点击放大 |
由图 2A可知,随着质量浓度的增加,香菇多糖对HepG2细胞存活率的影响总体呈现增加的趋势。而杏鲍菇和黑木耳多糖对HepG2细胞存活率的影响总体呈现先上升后下降的趋势(图 2B和2C)。随着贮藏时间的延长,香菇多糖在0.25 mg/mL时对HepG2细胞存活率的影响呈现先增加后下降的趋势,但在高质量浓度范围内对HepG2细胞存活率的影响变化不大。贮藏时间为3年、4年的香菇多糖在质量浓度为0.25 mg/mL时,HepG2细胞存活率最低;贮藏时间为2年、3年的杏鲍菇多糖对HepG2细胞存活率的影响最为明显,均和对照存在显著差异(P<0.05),其中以贮藏时间为3年、多糖质量浓度为1 mg/mL处理组的HepG2细胞存活率最高,为(99.37 ± 8.23)%,是对照组HepG2细胞存活率[(51.98±7.10)%]的1.91倍,表明杏鲍菇多糖可以有效降低经H2O2诱导的HepG2细胞产生的氧化损伤作用。黑木耳多糖组的HepG2细胞存活率受贮藏时间变化的影响并不明显,但不同多糖质量浓度间存在显著差异(P<0.05)。贮藏时间为1年的黑木耳多糖处理组的HepG2细胞存活率较低,其中1 mg/mL多糖处理组的HepG2细胞存活率最低,仅为(35.43±12.8)%;随着贮藏年限的增加,HepG2细胞存活率有所增加,当贮藏时间为4年、黑木耳粗多糖质量浓度为1 mg/mL时,HepG2细胞的存活率最高,达(104.85±4.08)%,显著高于对照组(P<0.05)。
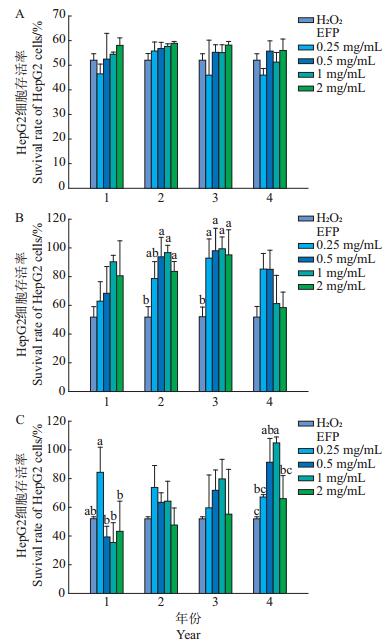 |
| A:香菇;B:杏鲍菇;C:黑木耳。短栅上的不同小写字母表示在P<0.05水平差异有统计学意义,未标字母表示在P<0.05水平差异无统计学意义;n=3。 A: Lentinula edodes; B: Pleurotus eryngii; C: Auricularia auricula-judae. Different lowercase letters above bars represent statistically significant differences at the 0.05 probability level, and no lowercase letter represents no statistically significant difference; n=3. 图2 不同贮藏时间的食用菌多糖(EFP)对HepG2细胞存活率的影响 Fig. 2 Effects of edible fungi polysaccharides (EFP) of different storage time on survival rate of HepG2 cells |
以上结果结合表 2可知,杏鲍菇多糖作用的HepG2细胞存活率最高,其次是黑木耳多糖,而香菇多糖组的HepG2细胞存活率最低,且三者之间存在显著差异(P<0.05)。不同贮藏时间的食用菌多糖处理对HepG2细胞氧化损伤的保护效果存在显著差异,其中以贮藏1年的食用菌多糖处理的HepG2细胞存活率最低,且与其他贮藏时间间差异显著(P<0.05)。不同的多糖质量浓度对HepG2细胞存活率的影响差异不显著。
| 表2 食用菌类型、贮藏时间、多糖质量浓度及其相互作用对HepG2细胞存活率的影响 Table 2 Effects of edible fungi variety, storage time, polysaccharide concentrations and their interactions on survival rate of HepG2 cells |
 |
| 点击放大 |
由图 3可知,不同贮藏时间的香菇多糖显著提高了SOD、MDA和LDH的水平,表现出良好的抗氧化活性(P<0.05)。贮藏时间为1年的香菇多糖对氧化损伤的保护能力优于2年、3年和4年,其中:贮藏时间为1年、香菇多糖质量浓度为1 mg/mL时,HepG2细胞中SOD活性最高,达(2.37±0.13)U/mg;在质量浓度为0.5 mg/mL时,HepG2细胞中MDA含量最接近空白对照组[(8.08±0.43)mmol/mg],为(8.19 ± 0.16)mmol/mg;在质量浓度为0.5 mg/mL时,HepG2细胞中LDH活性最接近对照组[(40.02± 3.19)U/mg],为(46.29±4.48)U/mg。贮藏时间为3年的杏鲍菇多糖对HepG2细胞的保护能力最佳,当质量浓度为2 mg/mL时,HepG2细胞的SOD活性最高,达(1.50±0.06)U/mg,明显高于模型组[(0.46± 0.01)U/mg];贮藏时间为3年、4年的杏鲍菇多糖组的MDA含量比1年、2年组高;但杏鲍菇多糖对LDH活性的影响不显著。在黑木耳组中,贮藏时间为4年的黑木耳多糖在质量浓度为1 mg/mL时,HepG2细胞的SOD活性达到最高[(0.93±0.10)U/mg],MDA含量为[(10.93 ± 0.30)mmol/mg],最接近对照组[(10.68 ± 0.88)mmol/mg],而LDH活性最低,为[(78.11±1.57)U/mg]。总体而言,贮藏时间为4年的黑木耳粗多糖对HepG2细胞的保护能力优于其他3个贮藏年限。
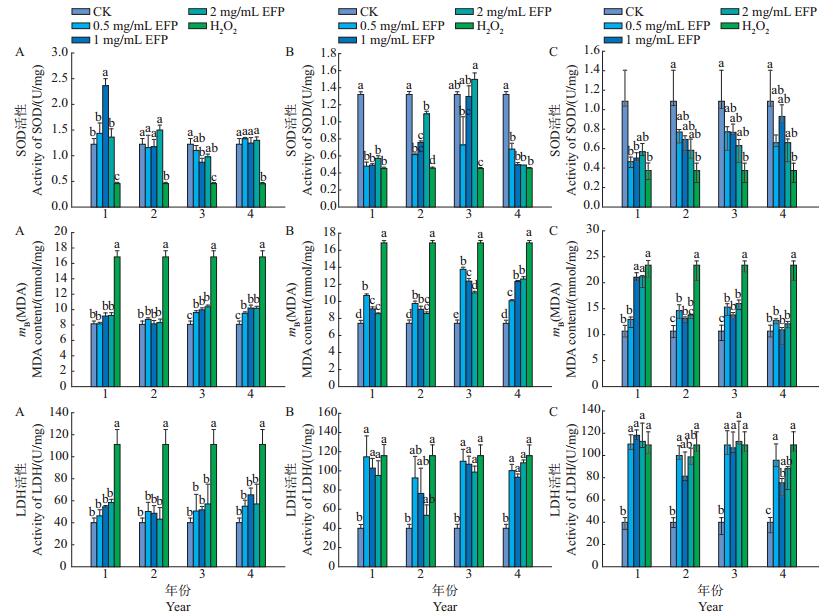 |
| (A~C):分别为香菇、杏鲍菇和黑木耳。CK:完全培养液。短栅上的不同小写字母表示在P<0.05水平差异有统计学意义;n=3。 (A-C): Lentinula edodess, Pleurotus eryngii, and Auricularia auricula-judae, respectively. CK: Complete medium. Different lowercase letters above bars represent statistically significant differences at the 0.05 probability level; n=3. 图3 不同贮藏时间的食用菌多糖(EFP)对HepG2细胞中SOD、MDA和LDH水平的影响 Fig. 3 Effect of edible fungi polysaccharides (EFP) of different storage time on SOD, MDA and LDH levels in HepG2 cells |
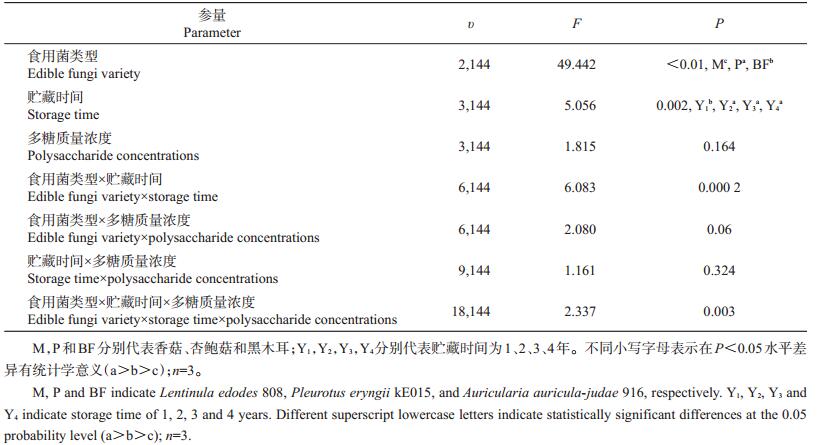
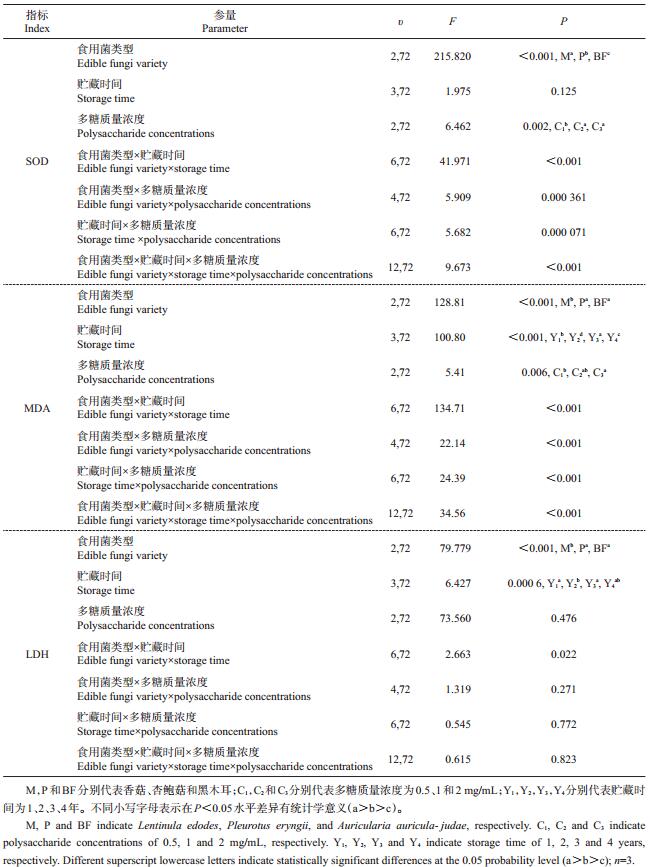
从表 3可知,食用菌类型、贮藏时间和多糖质量浓度均对HepG2细胞中SOD、MDA、LDH水平的影响具有显著差异(P<0.05)。香菇处理组的SOD活性显著高于杏鲍菇和黑木耳,但其MDA、LDH水平显著低于杏鲍菇和黑木耳(P<0.05),表明香菇多糖对H2O2氧化损伤作用的降低效果显著高于杏鲍菇多糖和黑木耳多糖。在不同贮藏时间的食用菌多糖组中,HepG2细胞的MDA含量存在显著差异(P<0.05),且以贮藏3年的最高。不同多糖质量浓度处理组的SOD活性和MDA含量存在显著差异(P<0.05),其中高质量浓度(1、2 mg/mL)多糖处理组的HepG2细胞的SOD活性显著高于低质量浓度处理组,表明高质量浓度多糖比低质量浓度多糖具有更佳的抗氧化效果。
| 表3 食用菌类型、贮藏时间、多糖质量浓度及其交互作用对HepG2细胞中SOD、MDA和LDH水平的影响 Table 3 Effects of edible fungi variety, storage time, polysaccharide concentrations and their interactions on SOD, MDA, and LDH levels in HepG2 cells |
 |
| 点击放大 |
多糖类物质在食用菌中普遍存在,其在生物活性方面的作用越来越受到人们的重视。近年来的研究发现,食用菌多糖不仅具有抗癌、抗感染、抗病毒、抗衰老等多方面的药理活性[24-26],而且具有较好的抗氧化活性,对物理、化学及生物来源的多种活性氧簇(reactive oxygen species, ROS)具有良好的清除作用。而抗氧化作用是一些多糖抗衰老、降血脂、降血糖的作用机制之一[27-28]。近年来,国内外已将抗氧化水平的检测用于抗衰老等保健食品的评价中。
本研究结果表明,在香菇、杏鲍菇和黑木耳3种食用菌中,香菇多糖的提取率显著高于其他2种,且贮藏3年的香菇多糖提取率最高,为(6.92 ± 0.18)%。杏鲍菇多糖降低H2O2诱导的HepG2细胞的氧化损伤作用最佳,且贮藏时间为2年和3年的杏鲍菇多糖的保护效果优于其他2个年限;不同质量浓度的杏鲍菇多糖处理对细胞的保护效果都显著高于对照,其中以贮藏时间3年、质量浓度为1 mg/mL的杏鲍菇多糖的抗氧化效果最佳,其HepG2细胞存活率为(99.37±8.23)%,是模型组的1.91倍,这与杏鲍菇多糖显著提高了SOD活性、降低了MDA含量的结果一致。在黑木耳组中,贮藏时间为1年的黑木耳多糖提取率最高[(2.61 ± 0.73)%],贮藏3年的最低[(1.72±0.09)%];在抗氧化活性方面,贮藏4年、质量浓度为1 mg/mL的黑木耳多糖对H2O2诱导的HepG2细胞保护作用显著高于对照组(P<0.05),此条件还显著提高了SOD活性、降低了MDA和LDH的水平,表现出最强的抗氧化作用。
张佳欣[9]在细胞抗氧化活性的研究中发现,茯砖茶多糖表现出陈化时间的规律,且陈化3年对PC12细胞的保护作用最强;本研究结果与其一致。说明食用菌多糖具有抗氧化活性,而且其活性随着贮藏时间的不同而变化。另外,与韩飞等[23] (100 μmol/L H2O2,4 h)、罗春丽等[21](400 μmol/L H2O2,2 h)构建的模型不同,本试验在建模时选取的是使HepG2细胞达到半抑制时的H2O2浓度(60 μmol/L,2 h),在此浓度下细胞处于氧化损伤而又未被完全杀死的状态,这时有损伤修复的可能性[19]。
然而,食用菌贮藏改变其多糖活性成分的形成机制尚未见有相关报道,推测可能与多糖的一级结构发生改变,从而影响有效多糖的比例,进而造成生物活性的差异有关。较早的研究表明:食药用真菌的多糖结构与功能存在一定的关系;此类多糖中活性成分的主链由β-(1-3)糖苷键相连接,侧链由β-(1-6)糖苷键相连接,且该类型的多糖具有抗菌、抗肿瘤和抗病毒功效[29]。此外,多糖分子的结构修饰可能对其生物学活性产生重要影响,如糖残基上的羟基、羧基、氨基等基团经磺化后可增加抗人类获得性免疫缺陷病毒(HIV)和抗肿瘤的效果[30]。
综上所述,食用菌多糖的提取率、抗氧化活性等会随着食用菌的种类及贮藏年限的不同而发生改变。对于不同的食用菌多糖,在贮藏过程中发生的物质变化及有效成分的生物活性机制还需进一步深入研究。本研究为香菇、杏鲍菇、黑木耳等食用菌在生产实践中优化贮藏时间及条件、获得良好的生产工艺提供了一定的参考,也为获得更大生产收益提供了理论支持。
| [1] |
耿建芳, 肖月升. 食用菌多糖抗肿瘤的免疫调节作用探讨. 时珍国医国药, 2006, 17(5): 855-856. GENG J F, XIAO Y S. To explore the immunomodulatory effect of polysaccharide from edible fungus on tumor. Lishizhen Medicine and Material Medica Research, 2006, 17(5): 855-856. (in Chinese with English abstract) |
| [2] |
张超, 操海群, 陈莉, 等. 食用菌多糖对植物病毒抑制作用的初步研究. 安徽农业大学学报, 2005, 32(1): 15-18. ZHANG C, CAO H Q, CHEN L, et al. Preliminary study on the inhibition of polysaccharide of edible fungi to plant virus. Journal of Anhui Agricultural University, 2005, 32(1): 15-18. (in Chinese with English abstract) |
| [3] |
李志涛, 赵娟娟, 王敏, 等. 复合食用菌多糖的免疫活性研究. 食品研究与开发, 2017, 38(5): 39-42. LI Z T, ZHAO J J, WANG M, et al. Study on the immune effects of edible fungus polysaccharides compounds. Food Research and Development, 2017, 38(5): 39-42. (in Chinese with English abstract) |
| [4] |
LONSENYT, 尹源明, 何国庆, 等. 复合食用菌多糖抗肿瘤作用的研究. 中国食品学报, 2005, 5(2): 90-93. LONSENY T, YIN Y M, HE G Q, et al. Study on the antitumor effects of edible fungus polysaccharides compounds. Journal of Chinese Institute of Food Science and Technology, 2005, 5(2): 90-93. (in Chinese with English abstract) |
| [5] |
李卫旗, 何国庆, 李志昂, 等. 金耳水溶性多糖JP-2的分离及化学结构的研究. 中国食品学报, 2003, 3(3): 13-17. LI W Q, HE G Q, LI Z A, et al. Study on separation and chemical structure of water soluble polysaccharides JP-2 in Tremella Aurantialba. Journal of Chinese Institute of Food Science and Technology, 2003, 3(3): 13-17. (in Chinese with English abstract) |
| [6] |
李元瑞, 袁静, 杜巍, 等. 灰树花菌丝体多糖G.F.-2的分离纯化及其理化特性的研究. 中国食品学报, 2003, 3(3): 7-12. LI Y R, YUAN J, DU W, et al. Study on isolation, purification and physicochemical characters of polysaccharide G.F.-2 Grifola frondosa mycelia. Journal of Chinese Institute of Food Science and Technology, 2003, 3(3): 7-12. (in Chinese with English abstract) |
| [7] |
唐庆九, 张劲松, 潘迎捷, 等. 几种药用真菌粗提物免疫调节和肿瘤抑制作用的筛选. 食用菌学报, 2003, 10(3): 1-6. TANG Q J, ZHANG J S, PANG Y J, et al. Immunostimulation and proliferation-inhibition for tumour cells by several crude extracts from medicinal fungi. Acta Edulis Fungi, 2003, 10(3): 1-6. (in Chinese with English abstract) |
| [8] |
李石军, 王凯平, 汪柳, 等. 香菇多糖LNT2的提取分离纯化、结构及体外抗肿瘤活性研究. 中草药, 2014, 45(9): 1232-1237. LI S J, WANG K P, WANG L, et al. Isolation, purification, structural elucidation, and antitumor activity in vitro of lentinan LNT2. Chinese Traditional and Herbal Drugs, 2014, 45(9): 1232-1237. (in Chinese with English abstract) DOI:10.7501/j.issn.0253-2670.2014.09.007 |
| [9] |
张佳欣. 不同贮存年限茯砖茶多糖的生物活性比较研究. 陕西, 杨凌: 西北农林科技大学, 2016. ZHANG J X. Comparison in bioactivity of polysaccharide fractions from Fuzhuan brick-tea at different storage periods. Yangling, Shaanxi: Northwest A and F University, 2016. (in Chinese with English abstract) |
| [10] |
王立峰, 陈静宜, 谢慧慧, 等. 薏米多酚细胞抗氧化及HepG2细胞毒性和抗增殖作用. 中国农业科学, 2013, 46(14): 2990-3002. WANG L F, CHEN J Y, XIE H H, et al. Cytotoxicity and antiproliferation effect on HepG2 cells and cellular antioxidant activity (CAA) of adlay polyphenols. Scientia Agricultura Sinica, 2013, 46(14): 2990-3002. (in Chinese with English abstract) DOI:10.3864/j.issn.0578-1752.2013.14.015 |
| [11] |
刘功让, 管培中, 宋淑亮, 等. 绞股蓝多糖对四氯化碳损伤HepG2细胞的保护作用. 山东医药, 2007, 47(31): 27-29. LIU G R, GUAN P Z, SONG S L, et al. Protective effect of Gynostemma pentaphylum Makino polysaccharide on HepG2 cells injured by CCl4. Shandong Medical Journal, 2007, 47(31): 27-29. (in Chinese with English abstract) DOI:10.3969/j.issn.1002-266X.2007.31.010 |
| [12] |
CHEN H H, HUANG Y C, HUANG J B, et al. Gigantol attenuates the proliferation of human liver cancer HepG2 cells through the PI3K/Akt/NF-κB signaling pathway. Oncology Reports, 2017, 37(2): 865-870. DOI:10.3892/or.2016.5299 |
| [13] |
源瀚祺, 黄庆华, 李娆玲, 等. 通过细胞模型体外评价抗氧化活性实验方法研究综述. 广东药学院学报, 2012, 28(2): 208-211. YUAN H Q, HUANG Q H, LI R L, et al. Review on cell models for in vitro evaluation of cellular antioxidant activity assay. Journal of Guangdong Pharmaceutical University, 2012, 28(2): 208-211. (in Chinese with English abstract) |
| [14] |
LIMA C F, FERNANDES-FERREIRA M, PEREIRAWILSON C, et al. Phenolic compounds protect HepG2 cells from oxidative damage: Relevance of glutathione levels. Life Sciences, 2006, 79(21): 2056-2068. DOI:10.1016/j.lfs.2006.06.042 |
| [15] |
杨娜, 王鸿飞, 郝艳佳, 等. 裂褶菌多糖提取工艺及抗氧化活性研究. 中国食品学报, 2014, 14(8): 92-98. YANG N, WANG H F, HAO Y J, et al. Study on extraction technology and antioxidant activity of schizophyllian polysaccharose. Journal of Chinese Institute of Food Science and Technology, 2014, 14(8): 92-98. (in Chinese with English abstract) |
| [16] |
于平, 陈幸鸽, 李鹏, 等. 茶树菇多糖提取工艺条件的优化. 中国食品学报, 2017, 17(3): 136-142. YU P, CHEN X G, LI P, et al. Optimization of the extraction process of polysaccharide from Agrocybe cylindracea. Journal of Chinese Institute of Food Science and Technology, 2017, 17(3): 136-142. (in Chinese with English abstract) |
| [17] |
陈巧玲, 郑艺梅, 王丽娟, 等. 超声波辅助复合酶法优化提取香菇多糖. 闽南师范大学学报(自然科学版), 2017, 30(2): 39-47. CHEN Q L, ZHENG Y M, WANG L J, et al. Optimum technology on extraction of lentinan by ultrasonic-assisted composite enzyme method. Journal of Minnan Normal University (Natural Science), 2017, 30(2): 39-47. (in Chinese with English abstract) |
| [18] |
赵行宇, 杨森, 周丽霞, 等. 胡桃醌对肝癌HepG2细胞的增殖抑制及诱导凋亡作用. 吉林大学学报(医学版), 2013, 39(2): 255-258. ZHAO X Y, YANG S, ZHOU L X, et al. Proliferation inhibition and apoptosis induction of juglone on human hepatoma HepG2 cells. Journal of Jilin University (Medicine Edition), 2013, 39(2): 255-258. (in Chinese with English abstract) |
| [19] |
王紫薇. 黑果枸杞提取物抗氧化性研究及对HepG2细胞氧化损伤的保护作用. 江苏, 扬州: 扬州大学, 2016.
|
| [20] |
王俊. 香菇多糖的结构与抗肿瘤活性的关系研究. 武汉: 华中科技大学, 2012. WANG J. Research of correlation between antitumor activity and structure of lentinan. Wuhan: Huazhong University of Science and Technology, 2012. (in Chinese with English abstract) http://www.doc88.com/p-5874114505526.html |
| [21] |
罗春丽, 王林, 李杏, 等. 紫薯花青素体外抗氧化及对H2O2诱导HepG2细胞氧化损伤的保护作用. 食品科学, 2015, 36(17): 225-230. LUO C L, WANG L, LI X, et al. Antioxidant activities and protective effect of anthocyanins from purple sweet potato on HepG2 cell injury induced by H2O2. Food Science, 2015, 36(17): 225-230. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201517042 |
| [22] |
王鹏. 老鹳草素对H2O2诱导HepG2细胞氧化应激损伤的保护作用研究. 哈尔滨: 东北林业大学, 2016. WANG P. Study on cytoprotective effect of geraniin against cellular oxidative stress-induced HepG2 cell damage. Harbin: Northeast Forestry Universty, 2016. (in Chinese with English abstract) http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y3150035 |
| [23] |
韩飞, 周孟良. 过氧化氢诱导HepG2细胞产生氧化应激细胞模型的建立. 食品科学, 2011, 32(5): 55-57. HAN F, ZHOU M L. An experimental HepG2 cell model of hydrogen peroxide induced DNA oxidative injury. Food Science, 2011, 32(5): 55-57. (in Chinese with English abstract) |
| [24] |
金茜, 朱彬, 罗宿星, 等. 食用菌多糖生物活性的研究进展. 遵义师范学院学报, 2010, 12(4): 75-78. JIN Q, ZHU B, LUO S X, et al. Recent advances in the studies on bio-activities of edible fungus polysaccharides. Journal of Zunyi Normal College, 2010, 12(4): 75-78. (in Chinese with English abstract) |
| [25] |
王斌, 连宾. 食药用真菌多糖的研究与应用. 食品与机械, 2005, 21(6): 96-100. WANG B, LIAN B. Progress on polysaccharides from edible and medicinal fungi. Food and Machinery, 2005, 21(6): 96-100. (in Chinese with English abstract) |
| [26] |
南征. 杏鲍菇多糖的化学修饰及体外生物活性研究. 西安: 陕西师范大学, 2014. NAN Z. Chemical modification and biological activity in vitro of Pleurotus eryngii polysaccharides. Xi'an: Shaanxi Normal University, 2014. (in Chinese with English abstract) http://cdmd.cnki.com.cn/Article/CDMD-10718-1014399840.htm |
| [27] |
张秀娟, 于慧茹, 耿丹, 等. 黑木耳多糖对荷瘤小鼠细胞免疫功能的影响研究. 中成药, 2005, 27(6): 691-693. ZHANG X J, YU H R, GENG D, et al. Effect of Auricularia auricula-judae polysaccharide on cell immunity of tumorbearing mice. Chinese Traditional Patent Medicine, 2005, 27(6): 691-693. (in Chinese with English abstract) |
| [28] |
常花蕾. 金针菇多糖的免疫调节作用、抗肿瘤作用及其机制研究. 广州: 南方医科大学, 2009. CHANG H L. Study of the immunomodulatory and antitumor effects of Flammulina velutipes polysaccharides and the underlying mechanisms. Guangzhou: Southern Medical University, 2009. (in Chinese with English abstract) http://www.cnki.com.cn/Article/CJFDTOTAL-BHON199605027.htm |
| [29] |
王淼, 丁萧霖. 葡聚糖生物活性与结构的关系. 无锡轻工大学学报, 1997, 16(2): 90-94. WANG M, DING X L. Relationship between glucan bioactivity and structure. Journal of Wuxi University of Light Industry, 1997, 16(2): 90-94. (in Chinese with English abstract) |
| [30] |
戴伟, 刘新义, 胡雄彬, 等. 香菇多糖的分子质量和结构与生物活性之间的关系. 中南药学, 2012, 10(6): 453-456. DAI W, LIU X Y, HU X B, et al. Relationship between molecular mass, structure and biological activity of lentinan. Central South Pharmacy, 2012, 10(6): 453-456. (in Chinese with English abstract) |
 2018, Vol. 44
2018, Vol. 44


