| 云烟87突变体新品系的特征特性及其DNA指纹图谱鉴定 |
2. 贵州省烟草公司铜仁市公司,贵州 铜仁 554300
2. Tongren Branch of Guizhou Tobacco Corporation, Tongren 554300, Guizhou, China
The field tests were performed to identify the botanic characters, agronomic characteristics, yield and quality of T24 and Aoyeyan in Tongren City of Guizhou Province from 2011 to 2013, using the leading flue-cured tobacco cultivars Yunyan87 and K326 as control varieties. Furthermore, simple sequence repeat (SSR) molecular marker technology was used to establish the DNA fingerprint maps of T24, Aoyeyan and their genetically related varieties Yunyan87, K326, Yunyan97 and four new mutant lines and strains (M97-1, Pianpianhuang, 09-1, Ketianyan), altogether nine accessions.
The results were as follows: 1) The botanic characteristics, plant shape and growth duration in field of T24 and Aoyeyan were similar with Yunyan87, but their effective leaf numbers, leaf length and width, stem circumference, plant height all exceeded Yunyan87. The yields of T24 and Aoyeyan were 2 247.38 and 2 195.62 kg/hm2, with production value of 53 657.56 and 52 586.47 Yuan RMB/hm2, and the rates of superior and middle grade leaves were 90.59% and 90.38%, respectively, which all exceeded control varieties。 The contents of reducing sugar, total sugar, starch, total plant nicotine of T24 and Aoyeyan were all up to the high quality standard of flue-cured tobacco leaves. The sensory taste score of T24 was 80.0, higher than Yunyan87 and K326, with scores of 76.3 and 77.7, respectively. The sensory taste score of Aoyeyan was 75.3. 2) Four SSR primers, i.e. PT20213, PT30028, PT30224 and PT30399 were selected from 14 core primers, which gave stable and polymorphic amplification profiles and had efficient identification ability to tobacco varieties. Eighteen polymorphic DNA fragments of all nine varieties including T24, Aoyeyan, Yunyan87, K326, Yunyan97, M97-1, Pianpianhuang, 09-1, Ketianyan were amplified, among which seven specific bands were selected to encode the fingerprint database. Fingerprint map of the nine varieties were drawn according to the fingerprint database. Each variety had a distinctive fingerprint map, therefore could be identified each other by at least three SSR primers, and the identification process of the nine varieties was established.
In conclusion, the yield and quality of T24 are higher than Yunyan87, so T24 has a great application potential. The distinctive fingerprint map of the tested varieties can provide basis for the variety identification and protection.
优良品种是烟叶产量和质量的基础,自然变异选择育种是烟草育种的有效方法。云烟87是以云烟二号为母本、K326为父本杂交选育而成的,2000年通过国家烟草品种审定,在全国推广10多年,目前仍是全国种植面积最大的烤烟品种,但是其产量和质量仍有待于进一步提高。本研究组从贵州省铜仁市烟农种植的云烟87烟田中选择变异单株,经纯系选择、品比试验、区域试验、生产试验,选育出了2个突变体新品系,分别命名为T24和凹叶烟。
不管是从品种保护的角度,还是从品种推广应用的角度,对品种的准确鉴定都非常重要。依据传统的形态学特征进行品种鉴定,容易受到环境与主观因素的影响,鉴定不稳定,可靠性低,不仅增加了鉴定的难度,而且容易错乱。以分子标记为基础的DNA指纹鉴定技术具有准确、简单快速、易于自动化的优点,通过构建DNA指纹图谱进行品种快速鉴定已成为一种发展趋势,在玉米[1]、水稻[2]、小麦[3]、番茄[4]、马铃薯[5]、甘薯[6]、棉花[7]等多种作物上都有应用,而关于烟草品种的DNA指纹图谱鉴定还不成熟[8, 9]。本研究以云烟87和另一个大面积生产种植品种K326作为对照,对突变体新品系T24和凹叶烟的农艺性状、产量和品质进行鉴定,并利用简单重复序列(simple sequence repeat,SSR)分子标记构建了T24、凹叶烟、云烟87、K326等9个品种的DNA指纹图谱,建立了这些品种的鉴别流程,旨在为新品种生产应用、鉴别和保护提供科学依据。
1 材料与方法 1.1 供试材料田间试验材料为从云烟87中选育的2个突变体新品系T24和凹叶烟,以我国南方主栽烤烟品种云烟87和K326作为对照。构建DNA指纹图谱的材料还包括K326的突变系片片黄、云烟97及其突变系M97-1、烤烟新品系09-1和客田烟。
1.2 农艺与品质性状鉴定方法 1.2.1 田间试验设计田间鉴定试验于2011—2013年连续3年在贵州省铜仁市松桃县大兴镇进行,试验地海拔730 m,土壤类型为黄泥土,土地平整,肥力均匀,pH 5.53,含有机质24.02 g/kg,铵态氮19.93 mg/kg,硝态氮20.61 mg/kg,速效磷11.22 mg/kg,速效钾45.12 mg/kg。试验采用随机区组设计,3次重复,行距1.2 m,株距 0.5 m,每小区6行,每行16株,小区面积57.6 m2。
1.2.2 性状调查鉴定方法1)农艺性状调查方法:根据《烟草农艺性状调查方法》(YC/T 142—2010),调查株高、茎围、节距、腰叶长、腰叶宽、有效叶数、大田生育期、株型、叶形、叶耳、叶面、叶尖、叶缘等植物学与农艺性状指标。
2)经济性状调查方法:按生产常规成熟采收标准和烘烤技术,分小区采收、烘烤,按中国烟草行业现行烤烟分级标准《烤烟》(GB 2635─1992)进行烟叶分级和称量,计算单位面积产量、产值、均价、上中等烟比例等经济指标。
3)烟叶品质鉴定方法:对打顶烟株从下往上数的第9~13位叶片进行挂牌标记,烘烤后的原烟送中国农业科学院烟草研究所农业部烟草产业产品质量监督检验测试中心进行烟叶外观和物理性状、化学成分、感官评吸品质鉴定。
化学成分测定指标包括还原糖、总糖、淀粉、总植物碱、总氮、钾、氯,用连续流动法测定,检测依据是《烟草及烟草制品水溶性糖的测定连续流动法》(YC/T 159—2002)、《烟草及烟草制品钾的测定连续流动法》(YC/T 217—2007)、《烟草及烟草制品总植物碱的测定连续流动法》(YC/T 160—2002)、《烟草及烟草制品氯的测定连续流动法》(YC/T 162—2011)、《烟草及烟草制品总氮的测定连续流动法》(YC/T 161—2002)、《烟草及烟草制品淀粉的测定连续流动法》(YC/T 216—2007)。
原烟外观和物理性状测定指标包括成熟度、身份(油分、厚度、叶片结构)、色泽(颜色、光泽)、单叶质量、含梗率(主脉比例)等,按照《烤烟》(GB 2635─1992)进行。成熟度是指调制后烟叶的成熟程度,包括田间和调制成熟程度,分为完熟(上部烟叶在田间达到高度的成熟,且调制后熟充分)、成熟(烟叶在田间及调制后熟均达到成熟程度)、尚熟(烟叶在田间刚达到成熟,生化变化尚不充分或调制失当后熟不够)、欠熟(烟叶在田间未达到成熟或调制失当)、假熟(泛指脚叶,外观似成熟,实质上未达到真正成熟)。烟叶身份指烟叶厚度、细胞密度或单位面积的质量的表现,常以厚度表示,采用《纸和纸板厚度的测定》(GB 451.3—2002)方法进行。烟叶油分是指烟叶组织细胞内含有的一种柔软的半液体或液体物质,在适宜的含水量情况下,使烟叶外观反映出的油润、丰满、枯燥的充实或贫乏程度,分为多(富油分,表观油润)、有(尚有油分,表观有油润感)、稍有(较少油分,表观尚有油润感)、少(缺乏油分,表观无油润感)4个档次。烟叶叶片结构指烟叶细胞排列的疏密程度,分为疏松、尚疏松、稍密、紧密4个档次。烟叶颜色分为柠檬黄色(烟叶表观全部呈现黄色,在习惯称呼的淡黄、正黄色色域内)、橘黄色(烟叶表观呈现橘黄色,在习惯称呼的金黄色、深黄色色域内)、红棕色(烟叶表观呈现红黄色或浅棕黄色,在习惯称呼的红黄、棕黄色色域内)。烟叶光泽是指烟叶表面颜色的洁净度或明暗度,根据颜色对视觉反映的强弱,分为强、较强、中等、弱4个档次。含梗率(主脉比例)指烟叶主脉质量占单叶质量的比值。
原烟感官品质评价指标包括香型、劲头、浓度、香气质、香气量、余味、杂气、刺激性、燃烧性、灰色,按照《烟草及烟草制品感官评价方法》(YC/T 138—1998)和《卷烟第4部分:感官技术要求》(GB 5606.4—2005)进行。第一步卷制样品烟支。先调节叶片样品含水率为16.0%左右,然后进行切丝,再调节烟丝样品含水率为(12.5±0.5)%,最后采用同一卷烟材料上机卷制评吸样品烟支。第二步评吸鉴定。评吸在评吸室内进行,室内环境通风,无异味,安静,无外界干扰,评吸员由9名对烟草及烟草制品感官评价具有丰富经验的专家级评吸员组成,采用整体循环评吸法评吸。对香气质、香气量、余味、杂气、刺激性、燃烧性、灰色进行定量打分评价,分值分别为15、20、25、18、12、5、5分,总分100分。用最大标度为3~9的等距标度检验方法打分,向评吸员提供标准样品、已编码的试样和表格,评吸员按照表格要求对各项指标进行评吸打分,最后将各评吸员的单项评吸结果加和,求其算术平均值,结果保留至1位小数。对香型、劲头、浓度进行定性评价。烤烟香气类型按照清香、清香偏中间型、中间偏清香、中间香、中间偏浓香、浓香偏中间香、浓香等7种类型进行分类。其中清香型是指具有突出的清香,吃味舒适,烟味浓度较淡,地方性杂气比较轻,劲头柔和至适中;浓香型是指烟叶有突出的浓香,烟味浓厚,吃味舒适,地方性杂气很轻至较重,劲头适中;中间香型是介于清香和浓香之间的一种特征香气类型,吃味干净,烟味浓度较淡至较浓,地方性杂气较重,劲头柔软至较大。劲头(又称为生理强度)是卷烟烟气(主要是烟碱)对人体产生的生理、心理的刺激程度,分为大、较大、中等、较小、小5个档次。烟味浓度是指烟气进入口腔后所感受的浓淡程度,分为大、较大、中等、较淡、淡5个档次。
应用SAS 9.3软件按混合模型进行方差分析;采用Tukey方法对不同品种间的差异显著性进行多重比较;利用Excel 2007对数据进行基本的统计分析,检测值以平均值±标准误表示。
1.3 DNA指纹图谱鉴定方法 1.3.1 DNA提取每个品种取7株典型植株的叶片,用改良的溴化十六烷三甲基铵(cetyltrimethyl ammonium bromide,CTAB)法,按单株分别提取基因组DNA。
1.3.2 SSR引物筛选在本实验室从278对烟草SSR引物[10]中筛选出的14对核心引物[11](表 1)的基础上,进一步筛选PCR扩增带型清晰、稳定性和重复性好、多态性好、品种鉴别能力强的引物,用于构建参试品种的DNA指纹图谱。
| 表1 SSR引物序列 Table 1 Sequences of primers for SSR markers |
 |
| 点击放大 |
聚合酶链反应(polymerase chain reaction,PCR)扩增总体系为10 μL,包括10×Easy Taq缓冲液(含MgCl2)1.67 μL,dNTPs(10 mmol/L)0.25 μL,Easy Taq DNA 聚合酶(5 U/μL)0.125 μL,正反引物(50 ng/μL)各0.365 μL,模板DNA(20 ng/μL)1 μL,加ddH2O至10 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,55~60 ℃退火30 s,72 ℃延伸30 s,35个循环;最后72 ℃延伸10 min,4 ℃保存。PCR扩增在System-9700型扩增仪上进行。
1.3.4 带型数据统计分析PCR扩增产物用聚丙烯酰胺凝胶电泳后进行银染、照相,读取记录各品种的特征带,在凝胶的某个相同迁移位点上,有带赋值为1,无带赋值为0。PCR扩增产物的片段大小参考刘新龙等[12]的方法进行估算。多态性信息含量(polymorphism information content,PIC)[13]是评价一个多态性基因座使用价值的一个量化概念。PIC=1-∑Pi2,其中,Pi为第i个等位基因的频率。
1.3.5 指纹图谱的构建参考蒋林峰等[14]的方法,根据各品种的特征带赋值制作该品种的指纹编码,并根据编码生成供试烟草品种的DNA指纹图谱。
2 结果与分析 2.1 表型性状特征鉴定T24和凹叶烟是分别从贵州省石阡县白龙乡大槽村、聚凤乡廖家坉村烟农种植的云烟87烟田中选出的优良变异单株,2011—2013年经贵州省烟草公司铜仁市公司分别于春秋季在贵州铜仁种植选择和海南陵水加代培育而成的烤烟新品系。云烟87和K326都是生产上大面积种植的主栽品种,以它们作为对照品种,对T24和凹叶烟的植物学特征、农艺性状和品质性状进行了鉴定。
2.1.1 植物学性状特征从植物学性状表现(表 2)可以看出:T24和凹叶烟与对照品种云烟87和K326在株型、叶形、叶耳、叶面、叶尖、叶缘等植物学性状方面基本一样,株型为筒形,叶形为长椭圆,叶耳大小为中等,叶面表面较皱,叶尖渐尖,叶片边缘为波浪状;但T24和凹叶烟的长势比云烟87和K326强,在叶片数、株高、茎围等性状上表现出差异。T24的有效叶片数为23.6,茎围为10.63 cm,节距为5.14 cm,在所有参试品种中排第一,与其他品种的差异都达到了显著水平;凹叶烟的打顶株高为110.7 cm,是所有参试品种中最高的,与其他品种的差异达到显著水平。T24和凹叶烟的叶片长宽都大于云烟87和K326。T24和凹叶烟的大田生育期与K326和云烟87相同,均为126 d。
| 表2 参试品种(系)的主要植物学性状 Table 2 Major botanic traits of tested varieties and strains |
 |
| 点击放大 |
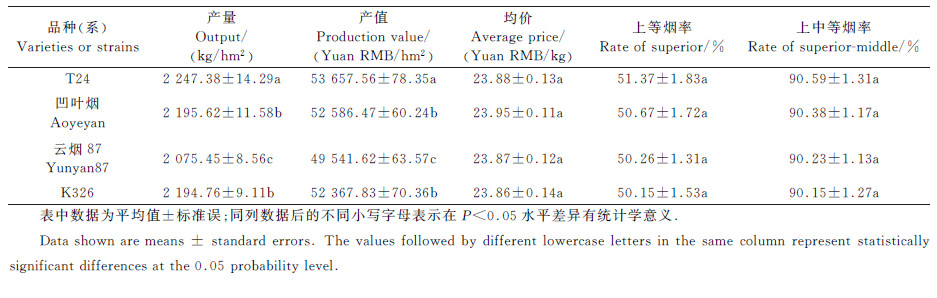
从参试品种的经济性状指标(表 3)可以看出:T24的产量为2 247.38 kg/hm2,产值为53 657.56元/hm2,均价为23.88元/kg,上中等烟率为90.59%,在参试品种中均排名第一,超过对照品种云烟87和K326;凹叶烟的产量为2 195.62 kg/hm2,产值为52 586.47元/hm2,各经济指标也均超过对照品种。对4个参试品种于2011—2013年田间试验的经济性状指标按混合模型进行方差分析,取显著水平α=0.05。结果表明,单位面积产量、单位面积产值的品种间差异均达到显著水平,均价、上等烟率、上中等烟率的品种间差异不显著,各指标的年度间差异均不显著。从多重比较结果(表 3)可以看出:T24的产量和产值与对照云烟87和K326相比增幅均达显著水平;凹叶烟的产量和产值与对照云烟87相比增幅均达显著水平,而与对照云烟K326的增幅未达显著水平。
| 表3 参试品种(系)的主要经济性状 Table 3 Main economic properties of tested varieties and strains |
 |
| 点击放大 |
从参试品种原烟的外观和物理特性指标(表 4)可以看出,T24和凹叶烟与对照品种云烟87和K326相比,主要在烟叶身份、色泽、单叶质量、主脉比例等方面有差异。T24的叶片厚度为0.47 μm,比云烟87厚,但差异在统计学上不显著;凹叶烟的叶片厚度为0.40 μm,比云烟87薄,差异达到显著水平;T24和凹叶烟都比K326薄,差异达到显著水平。T24和凹叶烟的油分与云烟87相同,都为“有”,即尚有油分,表观有油润感,好于K326的“稍有”,即较少油分,表观尚有油润感。 T24和凹叶烟的烟叶颜色均为橘黄色,与K326相同,而云烟87为柠檬黄色。T24和凹叶烟的光泽均为“强”,而云烟87为“较强”。T24和凹叶烟的单叶质量都低于云烟87和K326,含梗率(主脉比例)都高于云烟87而低于K326。
| 表4 参试品种(系)原烟的外观和物理特性 Table 4 Appearance quality and physical properties of tested raw tobacco varieties and strains |
 |
| 点击放大 |
从参试品种原烟的常规化学成分指标(表 5)可以看出:T24和凹叶烟的还原糖、总糖、淀粉、总植物碱、氯含量均处于优质烟叶的标准范围内[14];在表征化学成分协调性的糖碱比、氮碱比、钾氯比中T24和凹叶烟均优于对照品种云烟87,与K326接近。
| 表5 参试品种(系)原烟的化学成分 Table 5 Chemical composition of tested raw tobacco varieties and strains |
 |
| 点击放大 |
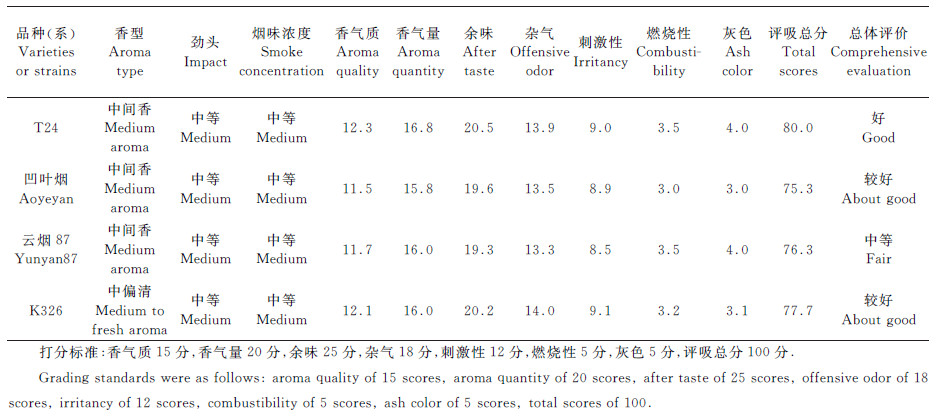
从参试品种感官评吸结果(表 6)可以看出:T24和凹叶烟的香型与云烟87相同,都为中间香型,而K326为中偏清;T24的香气质、香气量、余味评吸得分都高于对照品种云烟87和K326,杂气、刺激性评价得分高于云烟87而低于K326,燃烧性、灰色评价得分与云烟87相同而高于K326,评吸评价总分为80.0分,高于云烟87(76.3分)和K326(77.7分),在参试品种中居于第一位;凹叶烟的余味、杂气、刺激性评价得分高于云烟87,香气质、香气量、燃烧性、灰色评价得分低于云烟87,评吸评价总分为75.3分,低于云烟87和K326。
| 表6 参试品种(系)原烟的感官评吸结果 Table 6 Sensory evaluation result of tested raw tobacco varieties and strains |
 |
| 点击放大 |
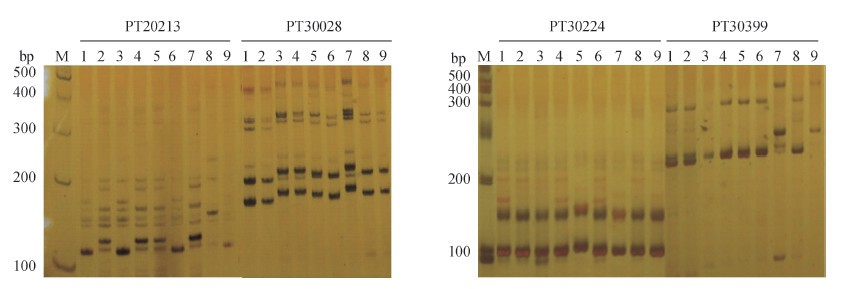
应用SSR分子标记,构建突变系T24和凹叶烟及其亲本品种云烟87、突变系片片黄及其亲本品种K326、突变系M97-1及其亲本品种云烟97以及烤烟新品系09-1和客田烟的DNA指纹图谱。从14条SSR引物(表 1)中进一步筛选出4条多态性好、稳定性强、重复性较高的引物PT20213、PT30028、PT30224、PT30399,在9个供试材料中共扩增出18条稳定的多态性条带,片段大小介于100~400 bp之间(图 1)。这4条引物检测到的位点多态性信息含量(PIC)值分别为0.71、0.83、0.61和0.67,平均值为0.70。BOTSTEIN等[15]提出,当PIC>0.5为高度多态性,0.25 < PIC < 0.5为中度多态性,PIC < 0.25为低度多态性。本文4条引物的PIC值均大于0.6,说明这4条引物表现出丰富而稳定的多态性,具有较好的区分度。
 |
|
M:DNA标志物;1:M97-1;2:云烟97;3:K326;4:云烟87;5:T24;6:片片黄;7:凹叶烟;8:客田烟;9:09-1。 M: DNA marker; 1: M97-1; 2: Yunyan97; 3: K326; 4: Yunyan87; 5: T24; 6: Pianpianhuang; 7: Aoyeyan; 8: Ketianyan; 9: 09-1. 图1 4对SSR引物扩增结果 Fig. 1 SSR amplified results of four specific primer pairs |
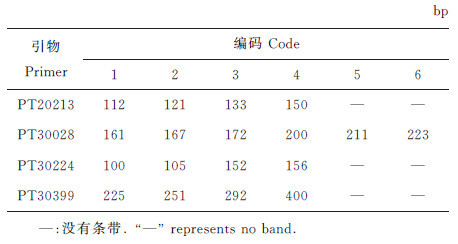
根据PT20213、PT30028、PT30224、PT30399这4对多态性引物分别扩增出的多态性条带及其分子质量的大小,从小到大依次赋值为有序整数,从1开始。4个引物共筛选出18个扩增多态性条带用于赋值。引物的扩增谱带选择和赋值结果见表 7。
| 表7 参试品种(系)特征谱带选择和条带赋值标准 Table 7 Specific band selection and encoded standard for tested varieties and strains bp |
 |
| 点击放大 |
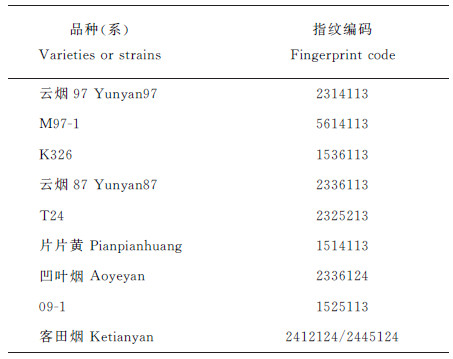
根据18个多态性条带在品种间的差异,确定用7个谱带来构建9个烟草品种的指纹数据库,即每个品种的DNA指纹数据确定为7位数字,代表 4个引物上的7个不同的谱带。其引物排列顺序依次为PT20213、PT30028、PT30224、PT30399,它们提供的特征谱带数目分别为2、2、1、2。指纹数据库编码信息中的数字1~6与扩增条带分子质量和引物的对应关系见表 7。9个烟草品种的指纹数据库编码结果(表 8)显示,在构建的烟草品种(品系)DNA指纹数据库中,每份烟草品种(品系)均具有特异的指纹编码。
| 表8 9个烟草品种(系)的指纹数据库编码 Table 8 Fingerprint database code of nine tested varieties and strains |
 |
| 点击放大 |
根据构建的烟草品种DNA 指纹数据库,绘制9个烟草品种的DNA 指纹图谱(图 2),灰色处代表有扩增条带出现。指纹图谱与指纹编码相对应,代表了9个烟草品种的身份信息。从图 2中可以看出,每个品种均具有不同的指纹图谱,可与其他品种相区分。
 |
| 图2 9个烟草品种(系)的DNA指纹图谱 Fig. 2 DNA fingerprint map of nine tested varieties and strains |
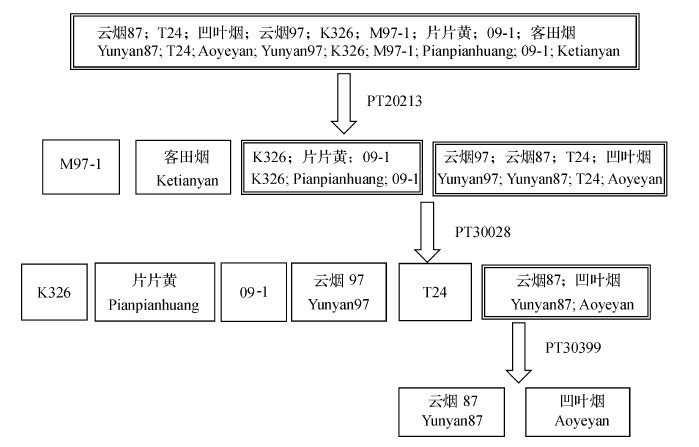
云烟87及其突变系T24和凹叶烟、K326及其突变系片片黄、云烟97及其突变系M97-1以及烤烟新品系09-1和客田烟共9个烤烟品种(系),用至少3对引物PT20213、PT30028、PT30399就可将它们完全鉴别开,其鉴别流程见图 3。
 |
|
同一方框内只有1个品种表示该品种已经与其他方框内的品种区分开;同一方框内有多个品种表示它们之间还没有彼此区分开。 Only one variety in a box means that this variety has been separated from other varieties in other boxes. Several varieties locating in one box means that these varieties in same box have not been separated each other. 图3 9个烟草品种(系)的鉴别流程 Fig. 3 Identification process of nine tested varieties and strains |
烤烟的生产利用过程复杂,既涉及田间种植和烟叶烘烤,还涉及卷烟加工利用,因此对烤烟品种的评价,既要进行农业评价,还要进行工业评价,选育出的品种必须使烟农、烟草商业公司和烟草工业公司3方都满意,从而导致烤烟品种选育难度较大。对现有推广品种中出现的自然变异进行单株选择和系统选育,可以在保持现有品种优良性状的基础上,进一步克服现有品种的缺点,是培育烤烟新品种的重要途径.目前已有很多成功的案例,如红花大金元、中烟103[16]、中烟104[17]、遵烟6号[18]、韭菜坪2号[19]、南江3号[20]、兴烟1号[21]、粤烟96[22]、豫烟8号[23]等诸多烟草品种都是采用系统育种途径育成的。本研究为进一步提高目前烤烟生产上种植面积最大的品种云烟87的抗病性、产量和品质,从贵州省铜仁市烟农种植的云烟87烟田中选择变异单株,以云烟87和另一个大面积生产种植品种K326作为对照,经纯系选择、品比试验、区域试验、生产试验,对突变体株系的产量和品质等性状进行鉴定,选育出了烘烤性能、烟叶产量和质量优于云烟87和K326的烤烟新品系T24和凹叶烟。
在烟叶生产和卷烟配料过程中对烟草品种进行鉴别,可以保证卷烟原料品种的准确性[9]。依据田间农艺性状、初烤烟叶外观等进行鉴别较难而且不准确,特别是对外观性状差异较小的品种,因此,利用分子标记技术建立准确、简单、快速和高效的DNA指纹图谱品种鉴别方法对促进烟叶和卷烟生产具有重要意义。构建植物品种指纹图谱的主要方法有单引物法[24, 25]、特征谱带法[26]和引物组合法[5, 27]。引物组合法可以大幅度提高对品种的鉴别能力,极有可能通过几个多态性高的引物组合就能完成大量品种的鉴定[28, 29]。以微卫星序列为基础的SSR标记在DNA指纹鉴定上显示出了独特的优越性:SSR标记数量丰富;覆盖整个基因组;揭示的多态性高;以孟德尔方式遗传且呈共显性。国际植物新品种保护联盟(International Union for the Protection of New Varieties of Plants,UPOV)在分子测试指南中,将构建DNA指纹数据库的标记方法确定为SSR和SNP(single nucleotide polymorphism,单核苷酸多态性),其中SSR标记因其技术比较成熟,成为当前各个作物建库的首选标记[30, 31]。本研究利用SSR分子标记组合法,对目前生产主栽品种云烟87、云烟97、K326以及从它们中选育出的突变体新品系共9个烟草品种(系)制作了DNA指纹图谱,并建立了其鉴别流程,可为品种鉴别和保护提供科学依据;但在实际应用中,常常涉及到大规模的品种鉴定,对引物的多态性以及引物组合的要求也相应提高,因此,进一步开发、筛选具有更多特征谱带、更高效的多态性引物对于鉴别烟草品种(系)非常重要。
| [1] |
王凤格, 赵久然, 戴景瑞, 等.玉米品种DNA 指纹数据库构建的标准化规范.分子植物育种, 2007, 5(1):128-132. WANG F G, ZHAO J R, DAI J R, et al. Criteria for the construction of maize DNA fingerprint database. Molecular Plant Breeding, 2007, 5(1):128-132. (in Chinese with English abstract) |
| [2] |
朱勇良, 谢裕林, 黄凌哲, 等.太湖稻区及国内部分香稻SSR指纹图谱构建及遗传多样性初析.植物遗传资源学报, 2012, 13(4):666-671. ZHU Y L, XIE Y L, HUANG L Z, et al. Establishment of SSR fingerprint map and preliminary analysis of genetic diversity among aromatic rice from Taihu and other areas in China. Journal of Plant Genetic Resources, 2012, 13(4):666-671. (in Chinese with English abstract) |
| [3] | RÖDER M S, WENDEHAKE K, KORZUN V, et al. Construction and analysis of a microsatellite-based database of European wheat varieties. Theoretical and Applied Genetics, 2002, 106:67-73. |
| [4] | BREDEMEIJER G, COOK R, GANAL M, et al. Construction and testing of microsatellite database containing more than 500 tomato varieties. Theoretical and Applied Genetics, 2002, 105:1019-1026. |
| [5] |
段艳凤, 刘杰, 卞春松, 等.中国88个马铃薯审定品种SSR指纹图谱构建与遗传多样性分析.作物学报, 2009, 35(8):1451-1457. DUAN Y F, LIU J, BIAN C S, et al. Construction of fingerprinting and analysis of genetic diversity with SSR markers for eighty-eight approved potato cultivars (Solanum tuberosum L.) in China. Acta Agronomica Sinica, 2009, 35(8):1451-1457. (in Chinese with English abstract) |
| [6] |
罗忠霞, 房伯平, 李茹, 等.基于EST-SSR 标记的甘薯种质资源DNA 指纹图谱构建.植物遗传资源学报, 2014, 15(4):810-814. LUO Z X, FANG B P, LI R, et al. Construction of DNA fingerprint database based on EST-SSR markers for sweet potato germplasm. Journal of Plant Genetic Resources, 2014, 15(4):810-814. (in Chinese with English abstract) |
| [7] |
匡猛, 杨伟华, 许红霞, 等.中国棉花主栽品种DNA 指纹图谱构建及SSR标记遗传多样性分析.中国农业科学, 2011, 44(1):20-27. KUANG M, YANG W H, XU H X, et al. Construction of DNA fingerprinting and analysis of genetic diversity with SSR markers for cotton major cultivars in China. Scientia Agricultura Sinica, 2011, 44(1):20-27. (in Chinese with English abstract) |
| [8] |
聂琼, 刘仁祥, 梁微, 等.用ISSR标记构建烟草核心种质的指纹图谱.西南农业学报, 2010, 23(2):335-339. NIE Q, LIU R X, LIANG W, et al. Fingerprint map construction of core tobacco germplasm by ISSR markers. Southwest China Journal of Agricultural Sciences, 2010, 23(2):335-339. (in Chinese with English abstract) |
| [9] |
马林, 罗昭标, 罗华元, 等.烟草品种的SCAR 标记鉴别.中国烟草学报, 2012, 18(5):79-84. MA L, LUO Z B, LUO H Y, et al. Using SCAR markers to identify tobacco varieties. Acta Tabacaria Sinica, 2012, 18(5):79-84. (in Chinese with English abstract) |
| [10] | BINDLER G, VAN DER HOEVEN R, GUNDUZ I, et al. A microsatellite marker based linkage map of tobacco. Theoretical and Applied Genetics, 2007, 114(2):341-349. |
| [11] |
尹国英, 杨小燕, 何其波, 等.鉴定烟草种质资源SSR核心引物筛选和验证.植物遗传资源学报, 2013, 14(5):205-211. YIN G Y, YANG X Y, HE Q B, et al. Screen and identification of SSR core primers for tobacco germplasm. Journal of Plant Genetic Resources, 2013, 14(5):205-211. (in Chinese with English abstract) |
| [12] |
刘新龙, 马丽, 陈学宽, 等.云南甘蔗自育品种DNA指纹身份证构建.作物学报, 2010, 36(2):202-210. LIU X L, MA L, CHEN X K, et al. Establishment of DNA fingerprint ID in sugarcane cultivars in Yunnan, China. Acta Agronomica Sinica, 2010, 36(2):202-210. (in Chinese with English abstract) |
| [13] |
沈童伟, 陆徐忠, 刘勋辉, 等.SSR标记鉴定玉米品种亲子关系的研究.安徽农业科学, 2009, 37(25):12347-12350. SHEN T W, LU X Z, LIU X H, et al. Studies on identification the parentage of corn variety by using SSR markers. Journal of Anhui Agricultural Sciences, 2009, 37(25):12347-12350. (in Chinese with English abstract) |
| [14] |
蒋林峰, 张新全, 黄琳凯, 等.中国鸭茅主栽品种DNA 指纹图谱构建.植物遗传资源学报, 2014, 15(3):604-614. JIANG L F, ZHANG X Q, HUANG L K, et al. Construction of DNA fingerprinting of dominant orchardgrass (Dactylis glomerata) varieties of China. Journal of Plant Genetic Resources, 2014, 15(3):604-614. (in Chinese with English abstract) |
| [15] | BOTSTEIN D, WHITE R L, SKOLNICK M, et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms. American Journal of Human Genetics, 1980, 32(3):314-331. |
| [16] |
罗成刚, 蒋予恩, 王元英, 等.烤烟新品种中烟103的选育及其特征特性.中国烟草科学, 2008, 29(5):1-5. LUO C G, JIANG Y E, WANG Y Y, et al. Breeding and evaluation of a new flue-cured tobacco variety Zhongyan103 and its characteristics. Chinese Tobacco Science, 2008, 29(5):1-5. (in Chinese with English abstract) |
| [17] |
刘洪祥, 罗成刚, 陈志强, 等.烤烟新品种中烟104的选育及评价利用.中国烟草科学, 2010, 31(3):1-6. LIU H X, LUO C G, CHEN Z Q, et al. Breeding and utilization of new flue-cured tobacco variety Zhongyan104. Chinese Tobacco Science, 2010, 31(3):1-6. (in Chinese with English abstract) |
| [18] |
郑明伟, 冯娅, 姜清治, 等.烤烟新品种遵烟6号的特性研究.耕作与栽培, 2012(2):29-30. ZHENG M W, FENG Y, JIANG Q Z, et al. Research on characteristics of new flue-cured tobacco cultivar Zunyan6. Tillage and Cultivation, 2012(2):29-30. (in Chinese) |
| [19] |
朱贵川, 龙丽琴, 喻奇伟, 等.烤烟新品种韭菜坪2号的选育及特征特性.贵州农业科学, 2009, 37(5):16-19. ZHU G C, LONG L Q, YU Q W, et al. Breeding of Jiucaiping2, a new tobacco variety, and its characteristics. Guizhou Agricultural Sciences, 2009, 37(5):16-19. (in Chinese with English abstract) |
| [20] |
李智勇, 韩晓红, 谭建, 等.烤烟新品种南江3号的选育及其特征特性.中国烟草科学, 2009, 30(4):1-5. LI Z Y, HAN X H, TAN J, et al. Breeding and selecting of a new flue-cured tobacco variety Nanjiang3 and its characteristics. Chinese Tobacco Science, 2009, 30(4):1-5. (in Chinese with English abstract) |
| [21] |
罗勇, 马莹, 彭宇, 等.烤烟新品种兴烟1号的选育及其特征特性.中国烟草科学, 2013, 34(2):89-92. LUO Y, MA Y, PENG Y, et al. Breeding and characteristics of a new flue-cured tobacco variety Xingyan No.1. Chinese Tobacco Science, 2013, 34(2):89-92. (in Chinese with English abstract) |
| [22] |
丁伟, 关国经, 曾吉凡, 等.烤烟新品种粤烟96选育研究.广东农业科学, 2008(3):11-14. DING W, GUAN G J, ZENG J F, et al. Breeding of a new flue-cured tobacco variety Yueyan96. Guangdong Agricultural Sciences, 2008(3):11-14. (in Chinese) |
| [23] |
杨立均, 翟文汇, 吴宁, 等.豫烟8号的选育及其特征特性.河南农业科学, 2012, 41(9):59-62. YANG L J, ZHAI W H, WU N, et al. Breeding and selecting of flue-cured tobacco variety Yuyan8 and its characteristics. Journal of Henan Agricultural Sciences, 2012, 41(9):59-62. (in Chinese with English abstract) |
| [24] |
缪恒彬, 陈发棣, 赵宏波, 等.应用ISSR对25个小菊品种进行遗传多样性分析及指纹图谱构建.中国农业科学, 2008, 41(11):3735-3740. MIAO H B, CHEN F D, ZHAO H B, et al. Genetic diversity and construction of fingerprinting of Chrysanthemum cultivars by ISSR markers. Scientia Agricultura Sinica, 2008, 41(11):3735-3740. (in Chinese with English abstract) |
| [25] |
徐宗大, 赵兰勇, 张玲, 等.玫瑰SRAP 遗传多样性分析与品种指纹图谱构建.中国农业科学, 2011, 44(8):1662-1669. XU Z D, ZHAO L Y, ZHANG L, et al. Analysis of genetic diversity and construction of fingerprint of Rosa rugosa by SRAP. Scientia Agricultura Sinica, 2011, 44(8):1662-1669. (in Chinese with English abstract) |
| [26] |
王凤格, 赵久然, 郭景伦, 等.比较3种DNA指纹分析方法在玉米品种纯度及真伪鉴定中的应用.分子植物育种, 2003, 1(5/6):655-661. WANG F G, ZHAO J R, GUO J L, et al. Comparison of three DNA fingerprint analyzing methods for maize cultivars’ identification. Molecular Plant Breeding, 2003, 1(5/6):655-661. (in Chinese with English abstract) |
| [27] |
汪斌, 祁伟, 兰涛, 等.应用ISSR分子标记绘制红麻种质资源DNA指纹图谱.作物学报, 2011, 37(6):1116-1123. WANG B, QI W, LAN T, et al. Establishment of DNA fingerprintings of kenaf (Hibiscus cannabinus L.) germplasm resources with ISSR molecular markers. Acta Agronomica Sinica, 2011, 37(6):1116-1123. (in Chinese with English abstract) |
| [28] | ARCHAK S, GAIKWAD A B, GAUTAM D, et al. DNA fingerprinting of Indian cashew ( Anacardium occidentale L.) varieties using RAPD and ISSR techniques. Euphytica, 2003, 130(3):397-404. |
| [29] | FANG D Q, ROOSE M L. Identification of closely related citrus cultivars with inter-simple sequence repeat markers. Theoretical and Applied Genetics, 1997, 95:408-417. |
| [30] | UPOV. Guidelines for DNA-Profiling: Molecular Marker Selection and Database Construction. Geneva: UPOV, 2007:3-4. |
| [31] | ZHANG H Y, WANG H, GONG S G, et al. Identification and validation of a core set of microsatellite markers for genetic diversity analysis in watermelon, Citrullus lanatus Thunb. Matsum. & Nakai. Euphytica, 2012, 18(2):329-342. |
 2016, Vol. 42
2016, Vol. 42


