| 多模态MRI影像组学对脑胶质瘤术后复发与治疗后反应的鉴别诊断 |
2. 中国中医科学院西苑医院济宁医院影像科, 山东 济宁 272000;
3. 山东第一医科大学附属省立医院影像科, 山东 济南 250021
2. Department of Medical Imaging, Jining Hospital of Xiyuan Hospital of China Academy of Chinese Medical Sciences, Jining 272000, China;
3. Department of Medical Imaging, Shandong Provincial Hospital Affiliated to Shandong First Medical University, Jinan 250021, China
脑胶质瘤是中枢神经系统原发肿瘤中最常见的神经上皮肿瘤,占脑肿瘤的81%[1],经标准疗法治疗的患者预后差,复发率高,高级别脑胶质瘤复发率可达90%[2-3]。脑胶质瘤复发与治疗后反应的影像学表现极其相似,均可表现为异常强化。常规影像学检查较难准确区分,组织病理学活检是判断脑胶质瘤术后是否复发的金标准,但其为侵入性检查,患者接受度差[4]。治疗后反应常见假性进展和放射性坏死,假性进展指在随访过程中MRI出现的一过性强化灶,病理学无新生肿瘤细胞,可能与放疗引起的神经系统炎症、新生血管不成熟及水肿有关;放射性坏死则是放疗导致的慢性血-脑脊液屏障破坏、水肿及占位效应。治疗后反应与胶质瘤复发在治疗方法上截然不同,因此采用无创检查鉴别两者有重要临床意义。目前用于胶质瘤复发或治疗后反应的MRI序列主要包括动态磁敏感对比灌注成像、动态对比增强成像(DCE-MRI)、DWI、动脉自旋标记成像、酰胺质子转移加权成像等新技术[5]。本研究基于常规MRI检查序列的影像组学方法,探索机器学习和特征选择技术确定胶质瘤分级、预后评估,探讨多模态MRI影像组学在胶质瘤术后评估中的应用价值。
1 资料与方法 1.1 一般资料回顾性收集2018年1月至2023年3月山东第一医科大学附属省立医院收治的125例脑胶质瘤患者,年龄19~68岁。纳入标准:①均行外科手术且病理诊断为脑胶质瘤;②术后行规律放疗和/或化疗;③术后随诊期间MRI均出现异常强化灶或经过二次手术病理确诊。排除标准:①MRI图像存在明显伪影,SNR差,图像序列不完整;②MRI图像无法勾画ROI或数据无法测量(如颅内严重出血等);③失访。最终共110例脑胶质瘤患者纳入本研究。
根据临床及影像随访或二次手术、穿刺活检病理,将110例分为治疗后反应组33例和复发组77例,2组一般资料见表 1。治疗反应组中,27例随访6个月以上,病灶强化范围较前缩小或强化程度较前减轻,临床症状有所改善,6例经病理证实为胶质增生;复发组中,59例随访6个月以上,病灶强化范围明显增大或出现新发强化病灶,18例经病理证实为复发。110例按7∶3比例随机分成训练集和测试集。
| 表 1 2组脑胶质瘤患者一般临床资料 |
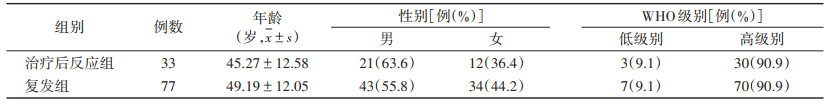 |
1.2 仪器与方法
采用Siemens Skyra 3.0 T超导型MRI扫描仪和32通道头部线圈。扫描序列及参数:轴位T1 FLAIR序列,TR 1 820 ms,TI 800 ms,TE 10 ms;轴位T2WI,TR 3 800 ms,TE 109 ms;轴位T2 FLAIR序列,TR 9 000 ms,TE 80 ms,TI 2 500 ms;DWI,TR 3 700 ms,TE 65 ms;T1WI增强扫描(T1WI-CE),TR 1 886 ms,TI 750 ms,TE 16 ms,翻转角10°,经肘静脉注射Gd-DTPA,注射流率3 mL/s,剂量0.1 mmol/kg体质量,随后以相同流率注射20 mL生理盐水;以上序列层厚5 mm,层距1 mm,视野220 mm×220 mm。
所有患者均于T1WI-CE后1周内行DCE-MRI扫描。DCE-MRI扫描参数:注射对比剂前扫描T1vibe三维容积式内插值法屏气检查序列,TE 2.5 ms,TR 6.0 ms,翻转角5°,视野340 mm×340 mm,层厚1.5 mm;再行DCE-MRI检查,TE 2.5 ms,TR 6 ms,翻转角10°,视野340 mm×340 mm,层厚1.5 mm,时间分辨率4.5 s,总时间5 min,共60期。在扫描完前5个非增强时相后,于第6个时相开始经高压注射器注射Gd-DTPA对比剂,流率3 mL/s,剂量0.1 mmol/kg体质量,后以相同样流率注射20 mL生理盐水冲洗导管。
1.3 影像组学数据处理及模型建立所有图像导入3D Slicer平台,由1位具有8年工作经验的影像科主治医师勾画ROI,并由1位具有20年工作经验的神经影像诊断经验的主任医师复核。采用ICC检验ROI的可重复性,2位医师意见不一致时,经协商达成一致,再次勾画样本所有的图像。逐层勾画病变整个区域为ROI,尽量避开囊变、坏死及水肿区,最后生成VOI(图 1)。
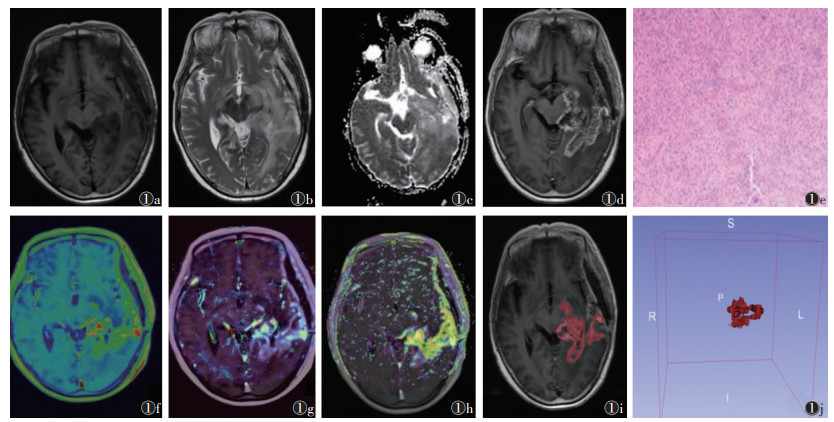 |
| 注:复发患者,女,62岁,二次手术病理为左颞叶胶质母细胞瘤(WHO Ⅳ级)。图1a为轴位T1WI图像,左侧术区显示不规则低信号;图1b为轴位T2WI,左侧术区、胼胝体压部显示指样高信号;图1c为ADC图,强化实质区ADCmean=0.916×10-3 mm2/s;图1d为轴位T1WI增强扫描图像,术区见明显不均质环样强化灶;图1e为二次手术病理图像,高级别胶质瘤(HE,低倍放大);图1f~1h分别为容积转运常数(Ktrans)、血管外细胞外间隙容积分数(Ve)及相对强化率曲线下面积(iAUC)伪彩图,强化实质区Ktrans=0.116 min-1,Ve=0.870,iAUC=0.080 mmol·L-1·min-1;图1i,1j分别为ROI勾画及VOI重建 图 1 脑胶质瘤VOI生成示意图 |
使用3D Slicer自带Radiomics插件提取所有特征,包括一阶特征、形态学特征和高阶特征。将全部特征导入Python.Radiomics,依次使用t检验、MUSE选择器、最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)算法进行筛选,筛选前对特征值进行均值-标准差归一化,组学模型在LASSO算法过程中使用10倍交叉验证进行训练,以确定最优特征。通过随机森林(random forest,RF)算法基于影像特征分别构建T2WI、ADC、T1WI-CE、容积转运常数(volume transfer constant,Ktrans)、血管外细胞外间隙容积分数(Ve)、相对强化率曲线下面积(iAUC)单一序列模型和DCE-MRI+T1WI-CE联合模型。
1.4 统计学分析采用SPSS 27.0软件进行数据分析。符合正态分布的计量资料以x ± s表示,组间比较行独立样本t检验;不符合正态分布的以M(IQR)表示,组间比较行Mann-Whitney U检验。计数资料以频数表示,组间比较行χ2检验。2位观察者间的一致性分析行ICC检验,ICC>0.75为一致性较好。绘制ROC曲线评估模型的鉴别诊断效能;对各模型间AUC比较采用DeLong检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 脑胶质瘤复发和治疗后反应的影像组学特征筛选通过LASSO算法降维、特征筛选,使用10倍交叉验证进行训练以确定最优特征,T2WI、ADC、T1WI-CE、Ktrans、Ve、iAUC、DCE-MRI+T1WI-CE模型分别筛选出7、5、3、7、5、10、5个最优特征(表 2)。
| 表 2 影像组学特征筛选结果 |
 |
2.2 不同组学模型鉴别脑胶质瘤复发和治疗后反应效能
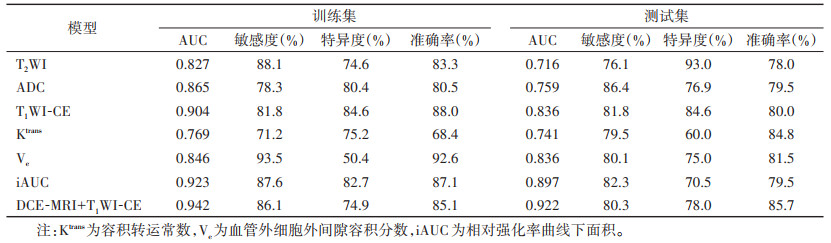
综合AUC及其他评价指标,DCE-MRI(参数Ktrans、Ve、iAUC)模型诊断效能优于T2WI、ADC、T1WI-CE模型,而DCE-MRI+T1WI-CE联合模型具有良好的诊断效能,AUC为0.922,敏感度为80.3%,准确率为85.7%(图 2,表 3)。经DeLong检验,联合模型与其余6种单序列组学模型的AUC差异均有统计学意义(均P < 0.05)。
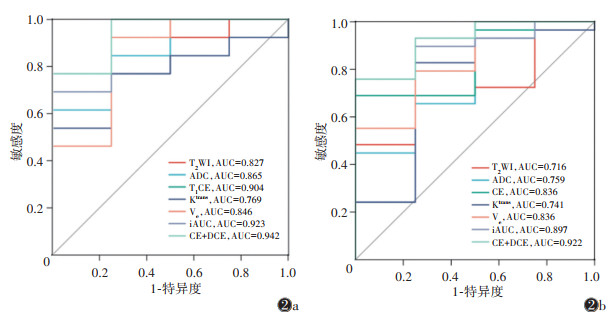 |
| 注:图2a,2b分别为训练集和测试集。Ktrans为容积转运常数,Ve为血管外细胞外间隙容积分数,iAUC为相对强化率曲线下面积 图 2 T2WI、ADC、T1WI-CE、Ktrans、Ve、iAUC及DCE-MRI+T1WI-CE模型鉴别脑胶质瘤复发和治疗后反应的ROC曲线 |
| 表 3 不同组学模型鉴别胶质瘤复发和治疗后反应的诊断效能 |
 |
3 讨论
胶质瘤术后复发和治疗后反应的常规MRI表现相似,难以准确区分。手术穿刺病理组织活检,尤其是再次手术,对患者伤害较大,且穿刺活检有时无法获得真正的病变组织[11]。脑胶质瘤肿瘤复发与治疗后反应的组织学特征、后续治疗及生存预期截然不同。肿瘤复发产生的新生血管多迂曲、紊乱,且基底膜也不完整,增加了微血管的通透性,使脑部血流动力学紊乱,后期治疗需行放化疗或再次手术[12]。本研究构建的联合模型在区分胶质瘤复发与治疗后反应方面,具有很好的诊断效能。
有研究基于脑胶质瘤术后的T1WI-CE图像建立的影像组学模型,鉴别复发与假性进展的诊断效能一般,训练组AUC为0.815,验证组AUC为0.804,对比T2WI、ADC、T1WI-CE建立的模型参数,联合模型的诊断效能较好[13]。本研究以病变T1WI-CE强化特征建立的模型区分复发和治疗后反应的AUC为0.836,与该研究结果相似,这是因为仅依靠常规MRI序列区分复发与治疗后反应的难度较大,脑胶质瘤复发区域的新生血管较多,血液供应增加;而治疗后反应区域的血-脑脊液屏障受到破坏,对比剂从血管内泄漏,在T1WI-CE上呈明显不均匀强化,如不进行纵向随访对比,能用的信息十分有限,目前更多的关注点在于能反映病灶血流灌注及细胞增殖等信息的MRI新技术上[14]。
影像组学从海量的影像数据中挖掘潜在信息,反映胶质瘤复杂的异质性,多项研究表明其有良好的效能,且多序列MRI模型性能优于单个序列。Youn等[15]将DWI、PWI纳入鉴别胶质母细胞瘤真假性进展的多序列影像组学联合模型,AUC高于常规MRI、DWI、PWI等单序列模型,明显提高了诊断效能。有研究指出单序列影像组学模型可鉴别复发与治疗后反应,但诊断效能中等,训练组AUC为0.761~0.867,验证组AUC为0.708~0.757。梁核心[16]研究表明,基于多模态MRI的组合模型具有较高的诊断效能,训练组AUC为0.956,验证组AUC为0.951,DeLong检验显示,组合模型与5个单序列组学模型AUC差异有统计学意义(P < 0.05)。可见,多模态MRI联合DCE-MRI影像组学有良好的诊断效能。
DCE-MRI以双室血流动力学为模型,可多参数联合评估肿瘤微循环的变化,反映肿瘤新生不成熟血管的渗漏情况。DCE-MRI在胶质瘤复发与放射性脑损伤中的研究相对较少。Wang等[17]纳入100例胶质瘤患者进行研究发现,基于优化后的Ktrans、Ve和ADC图像的影像组学特征构建线性支持向量机模型可有效评估胶质瘤异柠檬酸脱氢酶(IDH)突变状态和血管生成。与常规模型相比,支持向量机模型在训练组(AUC=0.939)和验证组(AUC=0.880)预测胶质瘤IDH1突变的AUC均较高。本研究中DCE-MRI+T1WI-CE联合模型在测试集的AUC、敏感度、特异度、准确率均较高,对胶质瘤患者术后的复发和治疗后反应的鉴别诊断、预后评估有重要意义。
本研究存在的局限性:为单中心研究、样本量较小,可能存在选择偏倚,后续将增加样本量进行多中心研究。
综述所述,DCE-MRI联合MRI多参数影像组学对鉴别胶质瘤复发、治疗后反应有良好的诊断效能,能为脑胶质瘤治疗后随访中MRI出现异常强化灶的患者制订准确的治疗方案。
| [1] |
KIM J Y, PARK J E, JO Y, et al. Incorporating diffusion- and perfusion-weighted MRI into a radiomics model improves diagnostic performance for pseudoprogression in glioblastoma patients[J]. Neuro-Oncology, 2019, 21(3): 404-414. |
| [2] |
OSTROM Q T, PRICE M, NEFF C, et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the united states in 2015-2019[J]. Neuro Oncol, 2022, 24(Suppl 5): v1-v95. |
| [3] |
BARNHOLTZ-SLOAN J S, OSTROM Q T, COTE D. Epidemiology of brain tumors[J]. Neurol Clin, 2018, 36(3): 395-419. |
| [4] |
刘静静, 黄雪莹, 党佩, 等. 体素内不相干运动成像对脑胶质瘤术后复发与假性进展的鉴别诊断[J]. 中国医学影像学杂志, 2022, 30(1): 17-22. |
| [5] |
胡宁芮. 磁共振DCE结合DTI鉴别脑高级别胶质瘤复发与治疗后反应的研究[D]. 济南: 山东大学, 2022.
|
| [6] |
STRAUSS S B, MENG A, EBANI E J, et al. Imaging glioblastoma posttreatment: progression, pseudoprogression, pseudoresponse, radiation necrosis[J]. Neuroimaging Clin N Am, 2021, 31(1): 103-120. |
| [7] |
朱正阳, 韩小伟, 叶梅萍, 等. MRI在鉴别胶质母细胞瘤治疗相关反应与复发中的应用进展[J]. 磁共振成像, 2023, 14(4): 147-153. |
| [8] |
WEI L, NIRAULA D, GATES E D H, et al. Artificial intelligence (AI) and machine learning (ML) in precision oncology: a review on enhancing discoverability through multiomics integration[J]. Br J Radiol, 2023, 96(1150): 20230211. |
| [9] |
HASHIDO T, SAITO S, ISHIDA T. Radiomics-based machine learning classification for glioma grading using diffusion-and perfusion weighted magnetic resonance imaging[J]. J Comput Assist Tomogr, 2021, 45(4): 606-613. |
| [10] |
HASHIDO T, SAITO S, ISHIDA T. A radiomics-based comparative study on arterial spin labeling and dynamic susceptibility contrast perfusionweighted imaging in gliomas[J]. Sci Rep, 2020, 10(1): 1-10. |
| [11] |
van DIJKEN B, VAN LAAR P J, HOLTMAN G A, et al. Diagnostic accuracy of magnetic resonance imaging techniques for treatment response evaluation in patients with high-grade glioma, a systematic review and meta-analysis[J]. Eur Radiol, 2017, 27(10): 4129-4144. |
| [12] |
TROYA-CASTILLA M, KAEN A, MÁRQUEZ-RIVAS J F, et al. Impact of early reoperation on the prognosis of patients operated on for glioblastoma[J]. World Neurosurgery, 2020, 139: e592-e600. |
| [13] |
JING H, YANG F, PENG K, et al. Multimodal MRI-based radiomic nomogram for theearly differentiation of recurrence and pseudoprogression of high-grade Glioma[J]. Biomed Res Int, 2022, 2022: 4667117. |
| [14] |
ELLINGSONB M, CHUNGC, POPEW B, et al. Pseudoprogression, radionecrosis.inflammation or true tumor progression? Challenges associated with glioblastoma responseassessment in an evolving therapeutic landscape[J]. J Neurooncol, 2017, 134(3): 495-504. |
| [15] |
YOUN J K, EUN J P, YOUNGHEUN J, et al. Incorporating diffusion- and perfusion-weighted MRI into a radiomics model improves diagnostic performance for pseudoprogression in glioblastoma patients[J]. Neuro-oncology, 2019, 21(3): 404-414. |
| [16] |
梁核心. 基于多模态磁共振的影像组学鉴别脑胶质瘤复发与治疗后反应的研究[D]. 济南: 山东大学, 2023.
|
| [17] |
WANG J, HU Y, ZHOU X, et al. A radiomics model based on DCE-MRI and DWI may improve the prediction of estimating IDH1 mutation and angiogenesis in gliomas[J]. Eur J Radiol, 2022, 147: 110141. |
 2025, Vol. 23
2025, Vol. 23


