| 基于ADC图影像组学特征预测非特殊类型浸润性乳腺癌组织学分级的临床研究 |
2. 西安交通大学第二附属医院医学影像科,陕西 西安 710000;
3. 甘肃省智能影像医学工程研究中心,甘肃 兰州 730000;
4. GE Healthcare China,北京 100000
乳腺癌的发病率和死亡率均高居全球女性恶性肿瘤的首位,且逐年增长并呈年轻化趋势[1]。乳腺癌的组织学分级与患者预后及复发风险呈独立相关[2-5]。DWI能反映肿瘤微环境的改变[6]。影像组学是一个新兴的转化研究领域,其核心是通过高通量提取和自动化分析将影像图像转换为可挖掘的数据信息[7]。本研究探讨基于ADC图影像组学特征预测非特殊类型浸润性乳腺癌组织学分级的临床应用价值。
1 资料与方法 1.1 一般资料回顾性分析2015年10月至2019年9月在兰州大学第一医院经病理确诊的非特殊类型浸润性乳腺癌患者152例,均为女性,年龄26~73岁,平均(47.07±8.84)岁。纳入标准:①经病理学确诊且病理报告中包含组织学分级;②术前均行高分辨力DWI检查;③病变均为肿块型,对多中心或多灶性病变,仅分析最大径最大的肿瘤。排除标准:①术前已接受治疗;②DWI图像伪影较重或脂肪抑制效果较差。
收集并分析患者临床资料(年龄、绝经状态)和影像学征象(肿瘤最大径、边缘情况和背景实质强化情况)。
1.2 肿瘤组织学分级采用由Elstom-Ellis修订的Scarff-Bloom-Richardson分级系统进行肿瘤组织学分级[8]:应用1~3分记分系统对肿瘤的腺体/小管组成的比例、细胞核的多形性、核分裂活性进行独立评估。将各项得分相加的总分分为3级:Ⅰ级,3~5分;Ⅱ级,6~7分;Ⅲ级,8~9分。因Ⅰ级患者数较少且Ⅰ、Ⅱ级肿瘤的复发评分及疾病特异性生存率无显著差异,故将Ⅰ、Ⅱ级定义为低级别组(Ⅰ+Ⅱ级),Ⅲ级定义为高级别组。
1.3 仪器与方法使用Siemens Skyra 3.0 T MRI扫描仪及专用8通道乳房线圈行俯卧位乳房扫描。扫描参数:DWI(RESOLVE序列)TR/TE 5 500 ms/50 ms,视野280 mm×280 mm,层数24层,层厚5 mm,弥散权重=3,b值为50、400、800 s/mm2,弥散方向=3,扫描完成后在Siemens工作站自动生成ADC图。从PACS中导出ADC图像(DICOM格式),将其导入AK软件执行预处理操作,并将预处理后的图像导出(图 1a~1f)。
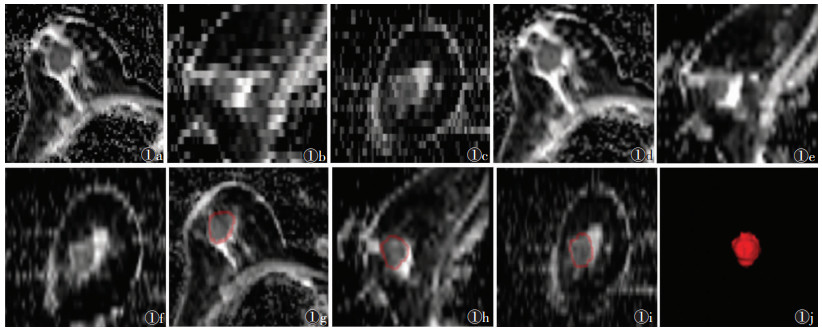 |
| 图 1 女,72岁,手术病理确诊为右乳非特殊类型浸润性乳腺癌 图 1a~1c 分别为原始轴位、矢状位、冠状位ADC图 图 1d~1f 分别为预处理后的轴位、矢状位、冠状位ADC图 图 1g~1i 分别为轴位、矢状位、冠状位ADC图上乳腺癌病灶区域的分割结果,红线区域内为ROI 图 1j 容积重组后的ROI |
1.4 图像分割
将预处理后的ADC图导入图像处理软件ITK-SNAP进行肿瘤分割。由2位工作5、8年的乳腺影像诊断医师在显示肿瘤的所有层面逐层勾画ROI(包含任何囊性或坏死区域),其界限参考DWI图像及T1WI增强扫描图像,2位医师意见不一致时,经协商确定最终结果,然后将二维ROI行三维容积重组(图 1g~1j)。
1.5 特征提取分析将所有患者的预处理与ROI图像批量导入AK软件,提取每个病灶的定量影像组学特征,包括直方图、形态学特征、灰度大小区域矩阵(grey level size zone matrix,GLSZM)、灰度共生矩阵(gray level co-occurrence matrix,GLCM)、灰度游程长度矩阵(gray level run length matrix,GLRLM)和Haralick参数,最终从每个病灶中分别提取了402个高通量影像组学特征。使用统计软件将152例患者随机分为训练集(108例占71.1%)和测试集(44例,占28.9%)2组。将训练集中的缺失值或异常值填补或替换为中位数;对2组每个特征使用Z-score进行标准化处理。根据最大相关最小冗余算法进行特征筛选,采用Mann-Whitney U检验移除P<0.05的特征,移除特征之间相关性 > 0.7。
1.6 模型构建与统计学分析利用从训练集中筛选得到的影像组学特征作为影像组学标签建立3个单纯的影像组学模型,分别是支持向量机、决策树和逻辑回归模型。将临床及影像征象行单因素Logistic回归分析,保留P<0.1的特征与最佳单纯组学模型输出的影像组学标签评分相结合建立组合模型。将4个预测模型在测试集中验证。
使用R软件(Version 3.0.1)(http://www.Rproject.org)进行数据分析。2组组内和组间连续变量比较行独立样本t检验,分类变量比较行χ2检验。应用ROC曲线分析评估每个模型在2组的分类性能,通过计算AUC、敏感度、特异度、准确率、阳性预测值、阴性预测值及各项指标相应的95%置信区间(95%CI)评价模型的诊断性能,模型间AUC比较行Delong检验。通过决策曲线和校准曲线分析评估预测模型的临床应用价值。以P<0.05为差异有统计学意义。
2 结果 2.1 测试集与训练集基本资料对比(表 1)| 表 1 测试集与训练集患者的基本资料比较 |
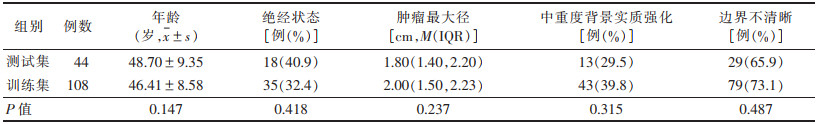 |
152例共152个肿瘤,病灶最大径0.50~5.80 cm,平均(1.90±0.66)cm;组织学分级低级别和高级别肿瘤各76个。测试集与训练集患者的年龄、绝经状态、肿瘤最大径、背景实质强化及边界情况差异均无统计学意义(均P >0.05)。训练集中高级别和低级别肿瘤间除最大径和背景实质强化外(均P<0.05),患者的年龄、绝经状态及肿瘤边缘情况差异均无统计学意义(均P > 0.05)。
2.2 特征筛选和模型构建从ADC图提取的402个定量影像组学特征中筛选出了4个与非特殊类型浸润性乳腺癌组织学分级具有最大相关最小冗余的特征(Correlation_angle90_offset7;sumEntrop;LongRunHighGreyLevelEmphasis_angle0_offset4;Short RunEmphasis_angle0_offset4)组成影像组学标签构建单纯组学模型,筛选2个影像征象(即肿瘤最大径和中重度背景实质强化)用于构建组合模型(决策树结合影像征象模型)。
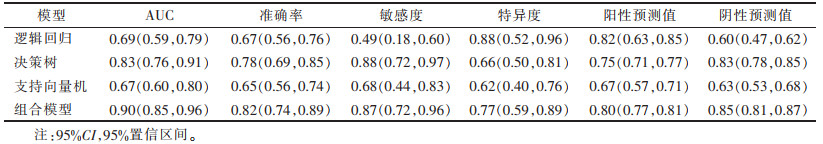
2.3 预测模型的诊断性能及应用价值(表 2~5,图 2~5)| 表 2 训练集中预测模型的分类性能(95%CI) |
 |
| 表 3 训练集中预测模型的分类性能比较 |
 |
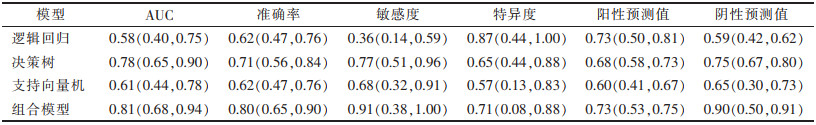
| 表 4 测试集中预测模型的分类性能(95%CI) |
 |
| 表 5 测试集中预测模型的分类性能比较 |
 |
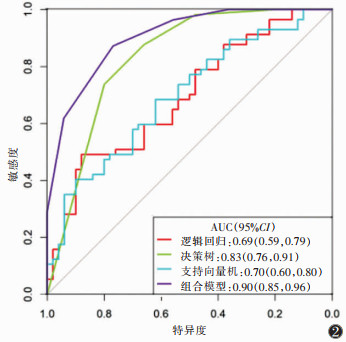 |
| 图 2 4个预测模型在训练集中的ROC曲线 |
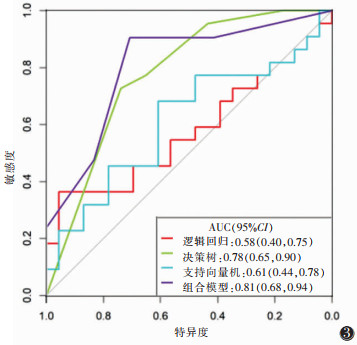 |
| 图 3 4个预测模型在测试集中的ROC曲线 |
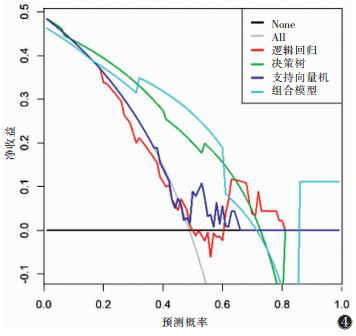 |
| 图 4 决策曲线分析 |
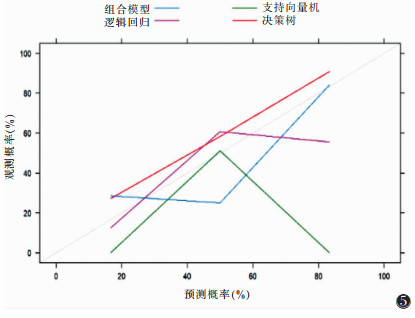 |
| 图 5 校准曲线 |
训练集及测试集中逻辑回归和支持向量机模型对非特殊类型浸润性乳腺癌组织学分级的分类性能差异均无统计学意义(均P > 0.05);决策树模型的分类性能均显著高于逻辑回归模型和支持向量机模型(均P<0.05);组合模型的分类性能与单纯的决策树模型比较,差异均无统计学意义(均P >0.05)。决策树、组合模型的临床应用价值优于逻辑回归和支持向量机(均P<0.05)。
3 讨论乳腺癌是一种高度异质性的肿瘤,基因表达及抑制的多样性决定了乳腺癌的临床特征,也决定了截然不同的治疗和预后[9-10]。Wirapati等[2]发现乳腺癌患者的存活率与增殖基因的表达密切相关,而组织学分级可作为基因异常增殖的表型标记来预测预后及评估复发风险。多项研究证明,组织学分级是与疾病特异性生存率相关的独立预后因素,在多变量分析中,组织学分级与复发评分显著相关,Ⅰ、Ⅱ级肿瘤的复发评分显著低于Ⅲ级[2-5]。因此,术前准确预测乳腺癌组织学分级对评估患者预后及复发等有重要意义。目前,组织学分级依赖于有创的侵入性活检,其结果的准确率和临床动态评估患者的依从性因乳腺癌的复杂异质性而受到限制[9]。
医学影像图像包含了基因表达、表型等癌症发生、发展的重要信息。影像组学对其进行深度挖掘和分析,具有无创地评估肿瘤微环境和预测肿瘤遗传异质性的潜力,包括图像采集、肿瘤分割、特征提取、特征降维、模型构建及评价等部分。
本研究使用Siemens Skyra 3.0 T MRI扫描仪的RESOLVE序列采集ADC图,与1.5 T设备和普通DWI序列相比,有效减小了磁场强度、成像协议和厂商的影响,可获得更好的分类结果[6]。此外,本研究在图像分割前先对图像预处理,提高了特征的鲁棒性并最大程度地减少影像特征对体素大小的依赖性。
本研究选择直接在ADC图上勾画ROI进行肿瘤分割,而不是在高b值的DWI上勾画ROI,而后将其复制到ADC图上,与吴佩琪等[11]的研究一致。Leithner等[12]比较2种肿瘤分割方法对分类准确率的影响,结果2种方法的分类准确率均 > 90%,但在ADC图上进行肿瘤分割的分类精度更优。原因是直接将高b值DWI上的ROI复制到ADC图上可能会包含非肿瘤区域而混淆结果,此外,在ADC图上直接勾画ROI可避免T2穿透效应的影响,使肿瘤实体边界的界定更准确[12-13]。考虑到影像特征与其对应部位的生物学特征很难精确对应,ROI仅包含有限区域的肿瘤会降低之后特征提取和分析的诊断及预后评估价值,如二维ROI会丢失形态学特征[13-14];本研究肿瘤分割范围包含囊变、坏死等的全肿瘤。
本研究从ADC图上分割的全肿瘤ROI中提取了402个定量影像特征对病变形态、灰度、强度和纹理进行全方位描述,最终筛选出的与非特殊类型浸润性乳腺癌组织学分级具有最大相关最小冗余的4个影像组学特征均是来自于GLCM和GLRLM的纹理特征,反映了图像灰度分布及排列存在的差异,主要与肿瘤的异质性有关,即高级别较低级别肿瘤具有更大的异质性,这与肿瘤异质性越大、预后越差的结论[15]一致。本研究中一阶直方图强度特征被全部剔除,证明来自GLCM和GLRLM的高阶纹理更利于表征肿瘤的异质性。此外,本研究中形态特征也被剔除,与吴佩琪等[11]的结果一致,可能与ADC图显示解剖学细节较差有关[6]。
本研究中决策树模型在训练集及测试集的分类性能均显著优于逻辑回归和支持向量机模型,与Jiang等[16]的研究中逻辑回归和支持向量机模型高性能的结果不同,提示不同类型影像图像与病理特征的最佳算法模型不同。本研究结合影像征象后组学模型的分类性能未得到显著提高,与Park等[17]的研究结果不同,原因可能是本研究纳入的危险因素不完全,且采用单因素Logistic回归分析,直接剔除了单因素分析差异无统计意义的参数,未能校正其他干扰因素的影响,致使一些有价值的特征丢失。在判断预测模型的预测性能方面,本研究不仅评估了预测模型的诊断准确率,还用决策曲线和校准曲线评估了特定模型的临床价值。
本研究局限性:①仅对单中心样本相对较小的肿块型病变进行了回顾性分析,今后需在更多机构选择各种条件的受试者进行前瞻性交叉验证;②纳入的临床特征有限,纳入更丰富的临床及影像征象可能会显著改善模型的分类性能及临床应用价值。
综上所述,基于高分辨力DWI序列ADC图的影像组学特征对术前预测非特殊类型浸润性乳腺癌患者的组织学分级具有较好的预测性能和应用前景。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
WIRAPATI P, SOTIRIOU C, KUNKEL S, et al. Meta-analysis of gene expression profiles in breast cancer: toward a unified understanding of breast cancer subtyping and prognosis signatures[J]. Breast Cancer Res, 2008, 10(4): 65. DOI:10.1186/bcr2124 |
| [3] |
PING Z, XIA Y, SHEN T, et al. A microscopic landscape of the invasive breast cancer genome[J]. Sci Rep, 2016, 6: 27545. DOI:10.1038/srep27545 |
| [4] |
CHANG J M, MCCULLOUGH A E, DUECK A C, et al. Back to basics: traditional nottingham grade mitotic counts alone are significant in predicting survival in invasive breast carcinoma[J]. Ann Surg Oncol, 2015, 22(3): 509-515. |
| [5] |
SINGH K, HE X, KALIFE E T, et al. Relationship of histologic grade and histologic subtype with oncotype Dx recurrence score; retrospective review of 863 breast cancer oncotype Dx results[J]. Breast Cancer Res Treat, 2018, 168(1): 29-34. DOI:10.1007/s10549-017-4619-4 |
| [6] |
MALAYERI A A, EL KHOULI R H, ZAHEER A, et al. Principles and applications of diffusion-weighted imaging in cancer detection, staging, and treatment follow-up[J]. Radiographics, 2011, 31(6): 1773-1791. DOI:10.1148/rg.316115515 |
| [7] |
GILLIES R J, KINAHAN P E, HRICAK H. Radiomics: images are more than pictures, they are data[J]. Radiology, 2016, 278(2): 563-577. DOI:10.1148/radiol.2015151169 |
| [8] |
LEBEAU A, KRIEGSMANN M, BURANDT E, et al. Invasive breast cancer: the current WHO classification[J]. Pathologe, 2014, 35(1): 7-17. DOI:10.1007/s00292-013-1841-7 |
| [9] |
GERLINGER M, ROWAN A J, HORSWELL S, et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing[J]. N Engl J Med, 2012, 366(10): 883-892. DOI:10.1056/NEJMoa1113205 |
| [10] |
JUNTTILA M R, DE SAUVAGE F J. Influence of tumour micro-environment heterogeneity on therapeutic response[J]. Nature, 2013, 501(7467): 346-354. DOI:10.1038/nature12626 |
| [11] |
吴佩琪, 刘再毅, 梁长虹. 基于MRI的影像组学特征在鉴别乳腺浸润性导管癌病理分级中的价值[J]. 医学研究生学报, 2018, 31(9): 938-942. |
| [12] |
LEITHNER D, BERNARD-DAVILA B, MARTINEZ D F, et al. Radiomic signatures derived from diffusion-weighted imaging for the assessment of breast cancer receptor status and molecular subtypes[J]. Mol Imaging Biol, 2020, 22(2): 453-461. DOI:10.1007/s11307-019-01383-w |
| [13] |
DAVNALL F, YIP C S, LJUNGQVIST G, et al. Assessment of tumor heterogeneity: an emerging imaging tool for clinical practice?[J]. Insights Imaging, 2012, 3(6): 573-589. DOI:10.1007/s13244-012-0196-6 |
| [14] |
CHEN W, GIGER M L, LI H, et al. Volumetric texture analysis of breast lesions on contrast-enhanced magnetic resonance images[J]. Magn Reson Med, 2007, 58(3): 562-571. DOI:10.1002/mrm.21347 |
| [15] |
FUMAGALLI C, BARBERIS M. Breast cancer heterogeneity[J]. Diagnostic, 2021, 11(9): 1555. DOI:10.3390/diagnostics11091555 |
| [16] |
JIANG Z, SONG L, LU H, et al. The potential use of DCE-MRI texture analysis to predict HER2 2+ status[J]. Front Oncol, 2019, 9: 242. DOI:10.3389/fonc.2019.00242 |
| [17] |
PARK H, LIM Y, KO E S, et al. Radiomics signature on magnetic resonance imaging: association with disease-free survival in patients with invasive breast cancer[J]. Clin Cancer Res, 2018, 24(19): 4705-4714. DOI:10.1158/1078-0432.CCR-17-3783 |
 2021, Vol. 19
2021, Vol. 19


