| CT纹理分析对醛固酮腺瘤与皮质醇腺瘤的鉴别诊断价值 |
肾上腺皮质腺瘤是最常见的良性肾上腺皮质肿瘤,占所有肾上腺肿瘤的50%~80%,其中功能性皮质腺瘤最常见的亚型包括醛固酮腺瘤(aldosterone-producing adenoma,APA)和皮质醇腺瘤(cortisol-producing adenoma,CPA)[1]。APA与CPA的临床症状和内分泌表现各自不同,但仍有部分临床表现不典型,在双侧及多发腺瘤需准确定位责任病灶时,两者鉴别诊断仍较困难[2-4]。病理学上传统HE染色无法准确区分不同类型的功能腺瘤[5],因此,其诊断需依靠临床表现、实验室检查、影像及病理综合诊断。随着诊疗技术的发展,目前肾上腺皮质腺瘤的诊治已由症状为导向的诊断性治疗向功能为导向的精确性治疗过渡。文献[6]报道,上述2种亚型的常规CT/MRI表现,如肿瘤大小、CT值虽有不同,但无法定性腺瘤功能亚型,其价值有限。纹理分析可通过对医学图像深度挖掘,提取分析图像中隐藏的定量特征,对疾病进行更精准的诊断、鉴别、疗效评价及预后预测等[7-9]。本研究尝试采用CT纹理特征分析对APA与CPA进行鉴别诊断,以探讨其临床应用价值。
1 资料与方法 1.1 一般资料回顾性分析我院在2015年1月至2019年12月经临床确诊的41例APA(APA组)和42例CPA(CPA组)的CT图像。APA组男13例,女28例,年龄26~69岁,平均(46.8±8.0)岁。CPA组男12例,女30例,年龄23~73岁,平均(47.9±8.2)岁。APA与CPA的诊断依据:①相应的临床表现和实验室检查,APA患者实验室检查提示血钾降低、血清醛固酮升高、醛固酮/肾素比值升高;CPA患者血清皮质醇激素升高,大、小剂量地塞米松抑制试验均为阴性。②术前经CT证实存在肾上腺肿瘤。③术后病理检查诊断为腺瘤。④术后治愈或相应临床症状显著改善。排除标准:①临床资料不完善;②术前接受过药物治疗;③肿瘤内含钙化灶;④图像质量差无法满足影像诊断。2组年龄、性别分布及动脉期CT值比较差异均无统计学意义(均P > 0.05)。
1.2 仪器与方法使用Siemens Somatom Sensation 64排CT扫描仪。扫描参数:100 kV,管电流采用自动毫安(Care dose 4D)技术,球管旋转时间为0.5 s,层厚5 mm。增强扫描经静脉注射碘海醇(碘含量300 mg/mL),流率3.0 mL/s,剂量1.5 mL/kg体质量,后用30 mL生理盐水冲洗,注射30 s后行动脉期扫描、60~70 s行静脉期扫描。
1.3 图像分析由2名放射科医师独立分析图像,意见不统一时由一名高级职称组长医师审阅并经讨论达成一致。首先在PACS工作站测量肿瘤大小(肿瘤横断面最大径)、平扫及动静脉期CT值(包括所有层面肿瘤整个轮廓的平均CT值),并观察有无同/对侧肾上腺皮质萎缩。后将平扫、动脉及静脉期CT图像以DICOM格式导入计算机。使用开源软件(www.itk-snap.org)在各期CT轴位2D图像上对肿瘤逐层手工勾画ROI形成3D图像(VOI),为精确分割采用图像放大和3D视图技术。利用ITK-SNAP软件从灰度共生矩阵、灰度游程矩阵、灰度区域大小矩阵和邻域灰度差分矩阵中提取纹理特征,共产生38个纹理特征参数。
1.4 统计学分析采用SPSS 19.0统计软件包进行数据分析。人口统计学资料分类变量分析行χ2检验。定量变量行t检验(符合正态分布和方差齐性检验),以x±s表示。先计算2位医师测得纹理特征的内部一致性系数(Cronbach α系数),再对一致性较好(α > 0.8)的CT纹理特征进行统计分析,符合正态分布且方差齐性检验的2组肿瘤CT纹理特征之间的差异行t检验;反之,则行Mann-Whitney U检验(所有参数均用2位医师测得纹理特征的平均值进行分析)。对各期差异有统计学意义的纹理特征运用因子分析方法,选取载荷指标较大(> 0.8)的纹理特征,应用Logistic回归分析行多特征联合回归分析,并联合多期图像分析。分析相关纹理特征ROC曲线的AUC,确定纹理特征鉴别2组肿瘤的阈值、敏感度和特异度。以P<0.05为差异有统计学意义。
2 结果 2.1 2组常规CT表现(表 1)| 表 1 2组一般资料及常规CT表现比较 |
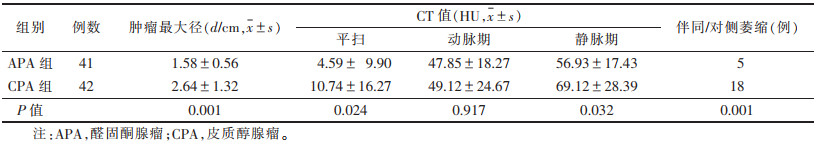 |
2组肿瘤大小、平扫及静脉期CT值和是否伴同/对侧皮质萎缩影像特征方面差异均有统计学意义(均P<0.05)。APA最大径较CPA小(P<0.05);APA的平扫及静脉期CT值较CPA低(均P<0.05);CPA较APA更易出现同/对侧皮质萎缩(P<0.05)(图 1)。
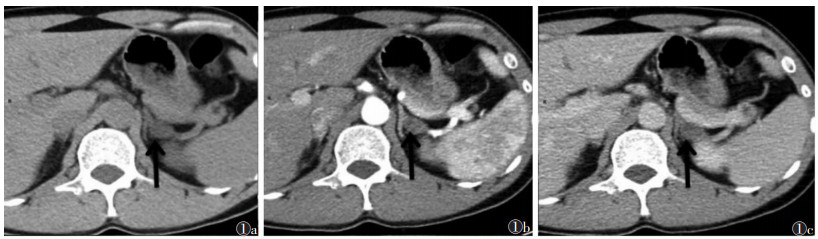 |
| 图 1 女,46岁,醛固酮腺瘤(APA)(黑箭) 图 1a~1c 分别为CT平扫、增强扫描动脉期、静脉期图像,肿瘤最大径约1.5 cm,平扫CT值约8 HU,增强扫描轻度强化,动脉期、静脉期CT值分别为19、21 HU |
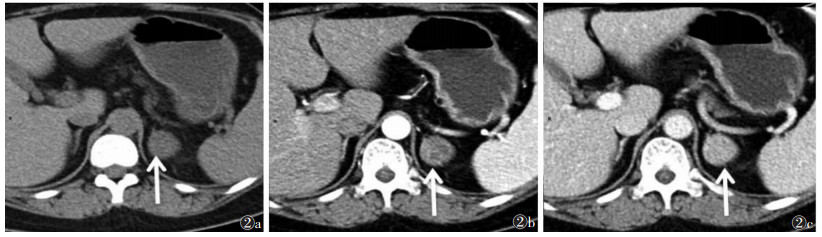 |
| 图 2 男,32岁,皮质醇腺瘤(CPA)(白箭) 图 2a~2c 分别为CT平扫、增强扫描动脉期、静脉期图像,肿瘤最大径约3.0 cm,平扫CT值约23 HU,增强扫描中度强化,动脉期、静脉期CT值分别约66、81 HU |
2.2 纹理特征分析
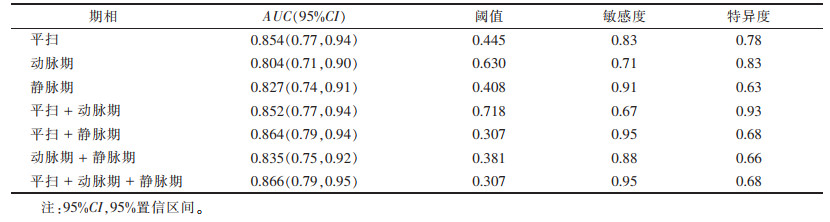
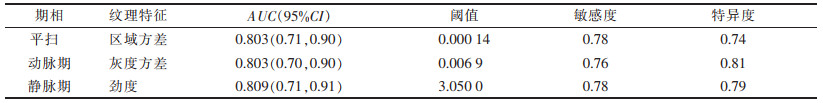
经一致性分析后筛选出一致性较好(α > 0.8)的纹理特征进行统计分析(表 2),平扫、动脉期、静脉期分别有18、16、21个纹理特征,差异均有统计学意义(均P<0.05),各期从灰度区域大小矩阵提取出的差异有统计学意义的纹理特征最多。各期对APA与CPA鉴别载荷指标较大的差异有统计学意义的纹理特征见表 3。各期及多期图像CT纹理特征联合ROC曲线分析结果见表 4:在平扫、动脉期、静脉期3期中,平扫纹理特征分析鉴别2组肿瘤的AUC值最大(AUC=0.854),仅略低于平扫+动脉期+静脉期(AUC=0.866),多期联合ROC曲线分析结果显示其鉴别效能并无明显提高(P=0.83)。各期ROC曲线的AUC值最大的纹理特征鉴别诊断效能结果见表 5。
| 表 2 APA和CPA鉴别各期差异有统计学意义的纹理特征 |
 |
| 表 3 各期载荷指标较大的具有统计学意义的纹理特征 |
 |
| 表 4 各期及多期CT纹理特征联合ROC曲线分析 |
 |
| 表 5 各期ROC曲线的AUC值最大的纹理特征的鉴别诊断效能 |
 |
3 讨论
大部分功能性肾上腺皮质腺瘤由于过度分泌激素,从而表现出相应的临床症状[1]。临床上表现不典型的功能性腺瘤并不少见,仅9%~37%的APA患者会出现典型的低钾血症[2, 10],且10%~20%的肾上腺皮质腺瘤可双侧发生或多发[4, 11],此时临床诊断较困难。经皮插管肾上腺静脉取血术是诊断APA的“金标准”,但操作难度大且具侵入性,限制了其在临床的广泛使用[12]。APA和CPA虽同为原发肾上腺内分泌腺瘤,但两者治疗策略截然不同,并不都是行手术切除治疗[13]。因此,需寻找更方便的无创性鉴别方法。目前的影像学研究多集中于多模态成像对肾上腺腺瘤与非腺瘤的鉴别诊断方面[14-15],尚无有关纹理分析鉴别功能性肾上腺腺瘤的研究报道。
笔者结合文献对2种功能性肾上腺腺瘤的常规CT表现总结分析如下:①CPA最大径较APA大,这与郭应坤等[16]研究结果一致。文献[17]报道CPA通常直径 > 2 cm,而APA一般<2 cm,约20%<1 cm。本研究CPA组 > 2 cm 35例(83.3%);APA组<2 cm 33例(80.5%),<1 cm 6例(14.6%)。这可能与肿瘤组织来源有关,肾上腺皮质束状带、球状带分别分泌皮质醇、醛固酮激素,组织学表明肾上腺皮质内束状带所占范围大于球状带[18]。②CPA的平扫CT值高于APA,组织学上APA由大量富含脂质的透明细胞构成,CT值类似于脂肪密度;而CPA由颗粒细胞组成,且细胞排列较紧密,CT值接近软组织密度[16]。③CPA较APA更易出现同侧/对侧皮质萎缩。肾上腺功能腺瘤由于相关激素分泌过多,抑制垂体分泌促肾上腺皮质激素,使得肾上腺皮质萎缩。CPA更易伴发同侧/对侧皮质萎缩的原因可能是肾上腺皮质主要分泌的是皮质醇激素,CPA会抑制正常肾上腺皮质;而APA虽然也分泌大量醛固酮激素,但对正常皮质抑制作用较小。张连成等[19]观察到APA同侧皮质和对侧肾上腺腺体未见明显萎缩改变,本组41例APA中5例伴同侧/对侧皮质萎缩。虽然APA和CPA在这些常规影像特征中有一定差异,但目前认为常规影像表现并不足以鉴别两者。
本研究显示,利用CT纹理分析能有效鉴别诊断醛固酮和皮质醇2种功能性腺瘤。以往研究[7-8]发现,纹理分析通过分析图像中像素或体素灰度的分布和关系,能够对肿瘤异质性进行客观、定量评估。如灰度游程矩阵中的灰度非一致性纹理特征反映了整个ROI的异质性,其数值越大提示灰度均匀性越差。本研究中,与之相对应APA的灰度非一致性纹理特征值较CPA更小,提示APA较CPA的肿瘤异质性相对小、密度更均匀。这与病理组织学一致,镜下见APA主要由透明细胞组成,组成成分较单一;而CPA以颗粒细胞为主,细胞索间有窦隙状血窦分割,肿瘤组成成分较APA复杂,故在纹理分析中提示APA的肿瘤异质性更小。综合比较各期纹理特征分析,发现从平扫图像提取的纹理特征在3个期相中的诊断效能最高(AUC=0.854),略低于平扫+动脉期+静脉期多期联合诊断效能(AUC=0.866),表明可能基于平扫CT图像纹理分析已能充分发掘肿瘤的隐藏特征,这对无创鉴别两者具有潜在价值。
本研究局限性:①样本量相对较小。②纹理特征的准确提取与VOI精准分割关系密切,虽然本研究中观察者之间的一致性较高且具有良好的重复性,但纹理特征的提取仍受影响。后续研究可探索使用全自动或半自动病变分割方法更精确分割病变。③为回顾性研究,无法精准控制扫描参数及图像质量。因此,今后的研究有待纳入多中心和大样本数据,并运用影像组学和人工智能方法来建立功能性肾上腺腺瘤的精准影像诊断体系。
综上所述,CT纹理分析能有效鉴别功能性肾上腺腺瘤的常见临床亚型即APA和CPA;CT平扫图像提取的纹理特征在各个期相中的鉴别诊断效能最高;多期联合分析的鉴别诊断效能并无明显提高。这或许为症状和激素表现不典型或双侧多发肾上腺腺瘤的鉴别诊断提供了一种值得探索的方法,为建立精准定位和定性功能性肾上腺腺瘤的一站式影像检查奠定基础。
| [1] |
LOW G, SAHI K. Clinical and imaging overview of functional adrenal neoplasms[J]. Int J Urol, 2012, 19(8): 697-708. |
| [2] |
GALATI S J. Primary aldosteronism:challenges in diagnosis and management[J]. Endocrinol Metab Clin of North Am, 2015, 44(2): 355-369. |
| [3] |
WAGNER-BARTAK N A, BAIOMY A, HABRA M A, et al. Cushing syndrome:diagnostic workup and imaging features, with clinical and pathologic correlation[J]. AJR Am J Roentgenol, 2017, 209(1): 19-32. |
| [4] |
MESHAL A M, MNAHI B S, TARIQ A, et al. Bilateral adrenal abnormalities:imaging review of different entities[J]. Abdom Radiol(NY), 2018, 44(1): 154-179. |
| [5] |
PAPOTTI M, DUREGON E, VOLANTE M, et al. Pathology of the adrenal cortex:a reappraisal of the past 25 years focusing on adrenal cortical tumors[J]. Endoc Pathol, 2014, 25(1): 35-48. |
| [6] |
PARK J J, PARK B K, KIM C K. Adrenal imaging for adenoma characterization:imaging features, diagnostic accuracies, and differential diagnoses[J]. Br J Radiol, 2016, 89(1062): 20151018. DOI:10.1259/bjr.20151018 |
| [7] |
LUBNER M G, SMITH A D, SANDRASEGARAN K, et al. CT texture analysis:definitions, applications, biologic correlates, and challenges[J]. Radiographics, 2017, 37(5): 1483-1503. DOI:10.1148/rg.2017170056 |
| [8] |
VARGHESE B A, CEN S Y, HWANG D H, et al. Texture analysis of imaging:what radiologists need to know[J]. AJR Am J Roentgenol, 2019, 212(3): 520-528. |
| [9] |
KUMAR S, YUNING L, MICHAEL A S, et al. CT texture analysis of pancreatic cance[J]. Eur Radiol, 2019, 29(3): 1067-1073. |
| [10] |
CAREY R M. Primary aldosteronism[J]. J Surg Oncol, 2012, 106(5): 575-579. |
| [11] |
KU E J, HONG A R, KIM Y A, et al. Adrenocorticotropic hormone-independent cushing syndrome with bilateral cortisolsecreting adenomas[J]. Endocrinol Metab(Seoul), 2013, 28(2): 133-137. |
| [12] |
SACKS B A, BROOK O R, BRENNAN I M. Adrenal venous sampling:promises and pitfalls[J]. Curr Opin Endocrinol Diabetes Obes, 2013, 20(3): 180-185. |
| [13] |
丑赛, 张玉石. 肾上腺皮质肿瘤的诊治进展[J]. 中华内分泌外科杂志, 2016, 10(3): 248-251. |
| [14] |
CTVRTLIK F, KORANDA P, TICHY T. Adrenal disease:a clinical update and overview of imaging. A review[J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2014, 158(1): 23-24. |
| [15] |
KIM Y K, PARK B K, KIM C K, et al. Adenoma characterization:adrenal protocol with dual-energy CT[J]. Radiology, 2013, 267(1): 155-163. |
| [16] |
郭应坤, 杨志刚, 张梅, 等. 肾上腺皮质小腺瘤的CT表现与临床及病理的关系[J]. 中国医学影像学杂志, 2004, 12(4): 259261. |
| [17] |
MAYOSMITH W W, BOLAND G W, NOTO R B, et al. Stateof-the-art adrenal imaging[J]. Radiographics, 2001, 21(4): 9951012. |
| [18] |
LATTIN G E, STURGILL E D, TUJO C A, et al. From the radiologic pathology archives:Adrenal tumors and tumor-like conditions in the adult:radiologic-pathologic correlation[J]. Radiographics, 2014, 34(3): 805. |
| [19] |
张连成, 徐荣天, 王欣. 多层螺旋CT多期相扫描及多层面重建诊断功能性肾上腺肿瘤的临床应用[J]. 中国医科大学学报, 2008, 37(3): 411-413. |
 2021, Vol. 19
2021, Vol. 19


