| 无症状高尿酸血症与痛风患者膝关节病变的高频超声声像图特征分析 |
血尿酸水平升高是指细胞外液的尿酸盐呈超饱和状态,正常情况下血液中尿酸盐饱和度为417μmol/L。国际上将高尿酸血症(hyperuricemia,HUA)的诊断标准定义为空腹血尿酸水平男性 > 420 μmol/L,女性 > 357 μmol/L。根据高尿酸血症病程进展不同可分为4个阶段:无症状HUA、急性痛风发作期、无症状慢性痛风和慢性症状性痛风[1-2]。HUA为痛风发生最重要的生化基础,持续的HUA状态可发展成痛风,部分患者持续HUA可无症状[3-5]。研究[6]表明单钠尿酸晶体可诱发炎症反应,引发痛风。识别单钠尿酸盐晶体在关节的沉积可为治疗无症状HUA及痛风提供影像学依据。
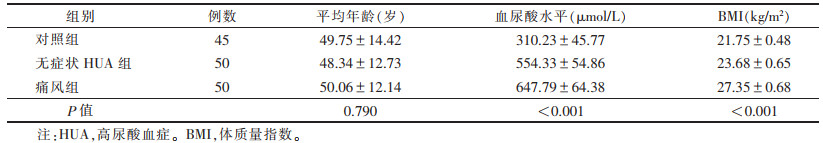
1 资料与方法 1.1 一般资料收集2017—2019年我院治疗的痛风性关节炎患者50例为痛风组(25~72岁),均符合美国风湿病协会(American Rheumatism Association,ARA)的痛风性关节炎诊断标准。收集50例无症状HUA患者为无症状HUA组(24~67岁),排除急性痛风发作史,正常嘌呤饮食状态下,空腹血尿酸水平 > 420 μmol/L。收集45例健康志愿者为对照组(27~69岁),尿酸水平<420 μmol/L,排除类风湿性关节炎、骨性关节炎。3组均为男性,年龄差异无统计学意义(P > 0.05),但血尿酸水平和体质量指数(body mass index,BMI)差异均有统计学意义(均P<0.05)(表 1)。
| 表 1 3组一般资料对照(x±s) |
 |
1.2 仪器与方法
采用Siemens Acuson OXana 2型彩色多普勒超声诊断仪、6~18 MHz高频线阵探头,设置为肌肉骨骼检查条件,患者膝关节屈曲45°,均行灰阶超声和彩色多普勒超声检查,由2位医师共同完成。彩色多普勒超声选用低通滤波的低速血流条件,先将彩色增益调至最大,再逐渐下调至骨皮质下血流信号消失。分别行长、短轴检查,检查切面为膝关节髌上囊、股四头肌腱、髌腱、腘肌腱、内外侧副韧带及髁间软骨,依据2015年类风湿关节炎临床试验结果测量组(OMERACT)超声痛风组发布的痛风患者基本病变的国际共识[7]及既往文献[8-10]分析8个超声声像图特征:双轨征、痛风石、骨侵蚀、滑膜增生、滑膜炎、积液、软骨厚度及最大痛风石直径。双轨征、痛风石、骨侵蚀、滑膜增生、滑膜炎、积液记录为存在或不存在,痛风石记录最大直径。
1.3 统计学方法采用SPSS 22.0统计软件进行分析、处理,计量资料以x±s表示,组间比较行方差分析;计数资料以率(%)表示,发生率比较行χ2检验。计量资料采用多项Logistic回归进一步分析每个有统计学意义的超声特征对无症状HUA组及痛风组的关联强度,以OR值表示,以对照组为参照组。以P<0.05为差异有统计学意义。
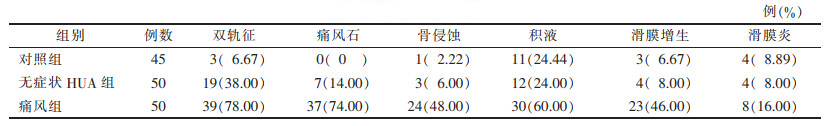
2 结果无症状HUA组双轨征(图 1)、痛风石的发生率明显大于对照组(χ2=11.37、6.80,均P<0.01);痛风组双轨征、痛风石(图 2)、骨侵蚀、积液、滑膜增生的发生率明显大于对照组(χ2=46.01、53.97、12.21、25.33、16.51,均P<0.01)(表 2)。最大痛风石直径3组间差异有统计学意义,且痛风组直径较无症状HUA组更大(均P<0.05);无症状HUA组与对照组组间软骨厚度无明显差异,而痛风组与对照组相比,软骨变薄(P<0.01)(表 3)。
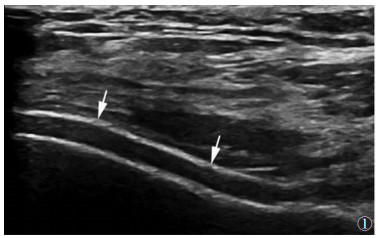 |
| 图 1 男,48岁,无症状高尿酸血症,膝关节前侧股骨髁间软骨横向检查声像图示双轨征(箭头) |
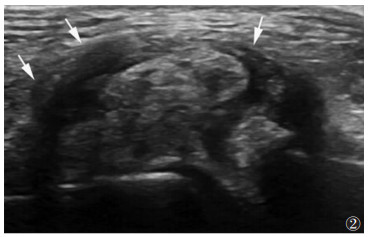 |
| 图 2 男,37岁,痛风,膝关节外侧腘肌腱纵向检查声像图示痛风石(箭头) |
| 表 2 3组超声征象比较 |
 |
| 表 3 3组最大痛风石直径及软骨厚度比较(mm,x±s) |
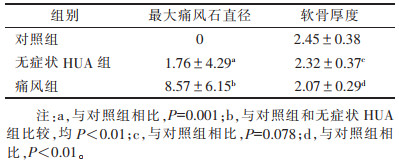 |
无症状HUA组和痛风组较对照组更常出现双轨征(OR=11.37、46.01,均P<0.01)及痛风石(OR=11.00、156.00,P=0.03)。痛风组较对照组及无症状HUA组更常出现骨侵蚀(OR=40.62,P<0.01)、积液(OR=4.64,P<0.01)、滑膜增生(OR=11.93,P<0.01)、软骨更薄(OR=18.00,P<0.01),最大痛风石直径较无症状HUA更大(OR=109.84,P<0.01)(表 4)。
| 表 4 超声特征Logistic回归分析 |
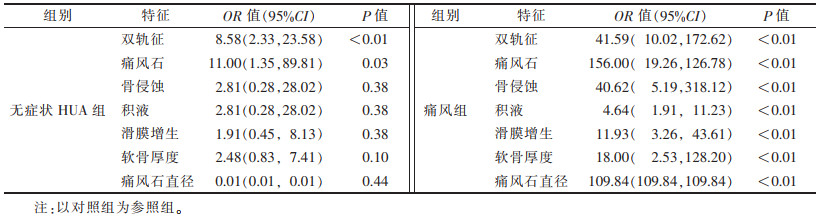 |
3 讨论
随着生活水平的提高和饮食习惯的改变,HUA发病率逐年上升,且发病年龄趋于年轻化。本研究中痛风组年龄最小25岁,无症状HUA组24岁。有学者[11-13]证实持续性无症状HUA可引起内皮细胞功能障碍,引发冠状动脉硬化性疾病及肾脏损害等,而对无症状HUA关节损害的研究较少。痛风性关节炎的研究较多涉及第一跖趾关节,但因跖趾关节本身软骨薄,厚度测量准确性及一致性差,同时因软骨层薄,双轨征的假阴性率较高[14]。有研究[15]提示痛风患者在症状首次发作及整个病程中膝关节是较易受累关节,因此本文就无症状HUA及痛风患者膝关节损害的声像特征进行分析。
2015年OMERACT发布国际共识[7],指出双轨征能可靠地反映单钠尿酸盐在关节的沉积。PINEDA等[17]发现25%的无症状HUA患者存在双轨征。本研究中38.00%(19/50)的无症状HUA患者膝关节软骨关节面出现双轨征,提示其膝关节软骨关节面有单钠尿酸盐沉积。说明部分无症状HUA进展为痛风前已出现关节内单钠尿酸盐结晶体的沉积。有研究[16]显示,单钠尿酸盐结晶易于沉积软骨表面的机制是软骨的硫酸软骨素和磷脂酰胆碱的正常成分有助于单钠尿酸盐结晶的形成。
本研究中14.00%(7/50)的无症状HUA患者韧带和肌腱内出现痛风石,表现为不均质强回声,常伴外周环形低回声。无症状HUA虽尚未进展为痛风期,但其血尿酸水平持续增高是形成痛风石的风险因素。组织病理示,痛风石中央区是尿酸盐晶体层,中间带是大量炎性细胞层,最外层是纤维血管层,其形成是组织对单钠尿酸盐晶体炎症性反应的体现[18-19]。研究[10]报道痛风石与关节的骨质破坏密切相关。虽然本研究中无症状HUA组与对照组骨侵蚀发生率差异无统计学意义,但无症状HUA患者痛风石的出现提示其对关节骨质存在损害。
部分无症状HUA患者虽与痛风患者一样出现了双轨征、痛风石超声征象,但痛风患者较其更常出现骨侵蚀、积液及滑膜增生等,且痛风患者软骨更薄、痛风石直径更大。这些超声征象的存在可帮助鉴别无症状HUA和痛风患者。骨侵蚀、积液、滑膜增生、软骨破坏及较大直径的痛风石提示痛风是一种持续存在的慢性炎症。无症状HUA进展为痛风可伴骨及软骨等关节结构损伤。
有研究[20]提示,痛风患者接受降尿酸治疗时血尿酸水平维持在357 μmol/L以下达7个月,超声监测的部分征象可消失。超声在无症状HUA及痛风的治疗检测中有重要临床意义。超声可检测无症状HUA和痛风患者单钠尿酸盐结晶体引起的关节损害,能识别无症状HUA患者单钠尿酸盐结晶体的存在,可为防止远期结构性破坏提供影像学依据。
| [1] |
胡大一, 丁荣晶. 无症状高尿酸血症合并心血管疾病诊治建议中国专家共识[J]. 中国全科医学, 2010, 13(11): 1145-1149. |
| [2] |
DOHERTY M. New insights into the epidemiology of gout[J]. Rheumatology (Oxford), 2009, 48(12): ii2-ii8. |
| [3] |
FRITZ J, HENES J C, FULD M K, et al. Dual-energy computed tomography of the knee, ankle, and foot:noninvasive diagnosis of gout and quantification of monosodium urate in tendons and ligaments[J]. Semin Musculoskelet Radiol, 2016, 20(1): 130-136. DOI:10.1055/s-0036-1579709 |
| [4] |
DALBETH N, POOL B, GAMBLE G D, et al. Cellular character-ization of the gouty tophus:a quantitative analysis[J]. Arthritis Rheum, 2010, 62(5): 1549-1556. DOI:10.1002/art.27356 |
| [5] |
中华医学会风湿病学分会. 原发性痛风诊治指南(草案)[J]. 中华风湿病学杂志, 2004, 8(3): 178-181. |
| [6] |
DALBETH N, HASKARD D O. Mechanisms of inflammation in gout[J]. Rheumatology (Oxford), 2005, 44(9): 1090-1096. DOI:10.1093/rheumatology/keh640 |
| [7] |
GUTIERREZ M, SCHMIDT W A, THIELE R G, et al. Interna-tional Consensus for ultrasound lesions in gout:results of Delphi process and web-reliability exercise[J]. Rheumatology (Oxford), 2015, 4(10): 1797-1805. |
| [8] |
PEREZ-RUIZ F, MARTIN I, CANTELI B. Ultrasonographic mea-surement of tophi as an outcome measure for chronic gout[J]. J Rheumatol, 2007, 34(9): 1888-1893. |
| [9] |
FILIPPUCCI E, SCIRE C A, DELLE SEDIE A, et al. Ultrasound imaging for the rheumatologist. XXV. Sonographic assessment of the knee in patients with gout and calcium pyrophosphate deposition disease[J]. Clin Exp Rheumatol, 2010, 28(1): 2-5. |
| [10] |
DALBETH N, CLARK B, GRERORY K, et al. Mechanisms of bone erosion in gout:a quantitative analysis using plain radio-graphy and computed tomography[J]. Ann Rheum Dis, 2009, 68(8): 1290-1295. DOI:10.1136/ard.2008.094201 |
| [11] |
HO W J, TSAI W P, YU K H, et al. Association between endothelial dysfunction and hyperuricaemia[J]. Rheumatology (Oxford), 2010, 49(10): 1929-1934. DOI:10.1093/rheumatology/keq184 |
| [12] |
NEOGI T, ELLISON R C, HUNT S, et al. Serum uric acid is associated with carotid plaques:the National Heart, Lung, and Blood Institute Family Heart Study[J]. J Rheumatol, 2009, 36(2): 378-384. DOI:10.3899/jrheum.080646 |
| [13] |
EDWARDS N L. The role of hyperuricemia and gout in kidney and cardiovascular disease[J]. Cleve Clin J Med, 2008, 75(5): S13-S16. |
| [14] |
CAMPION E W, GLYNN R J, DELABRY L O. Asymptomatic hyperuricemia. Risks and consequences in the Normative Aging Study[J]. Am J Med, 1987, 82(3): 421-426. DOI:10.1016/0002-9343(87)90441-4 |
| [15] |
王小静.肌肉骨骼超声在痛风诊断的建立及临床应用研究[D].太原: 山西医科大学, 2016.
|
| [16] |
BURT H M, DUTT Y C. Growth of monosodium urate monohy-drate crystals:effect of cartilage and synovial fluid components on in vitro growth rates[J]. Ann Rheum Dis, 1986, 45(10): 858-864. DOI:10.1136/ard.45.10.858 |
| [17] |
PINEDA C, AMEZCUA-GUERRA L M, SOLANO C, et al. Joint and tendon subclinical involvement suggestive of gouty arthritis in asymptomatic hyperuricemia:an ultrasound controlled study[J]. Arthritis Res Ther, 2011, 13(1): R4. |
| [18] |
SINGH J A, DALBETH N. Is the double contour sign specific for gout? Or only for crystal arthritis?[J]. J Rheumatol, 2015, 42(3): 353-354. DOI:10.3899/jrheum.141322 |
| [19] |
PALMER DG, HOGG N, DENHOLM I, et al. Comparison of phenotype expression by mononuclear phagocytes within subcu-taneous gouty tophi and rheumatoid nodules[J]. Rheumatol Int, 1987, 7(5): 187-193. DOI:10.1007/BF00541376 |
| [20] |
THIELE R G, SCHLESINGER N. Ultrasonography shows disap-pearance of monosodium urate crystal deposition on hyaline cartilage after sustained normouricemia is achieved[J]. Rheumatol Int, 2010, 30(4): 495-503. DOI:10.1007/s00296-009-1002-8 |
 2020, Vol. 18
2020, Vol. 18


