| 电针即刻调节哮喘患者脑功能的静息态fMRI研究 |
近年来,哮喘患病人数在全球范围内呈逐年上升趋势,预计在2025年将增至4亿[1]。随着研究的深入,人们逐渐认识到哮喘是一种异质性疾病[2],不仅涉及呼吸系统,还涉及中枢神经系统。哮喘患者主要表现为间歇性呼吸困难,这可能导致大脑结构异常。
针刺具有历史悠久、疗效好、不良反应小的特点,越来越受到人们的重视。目前,针刺已成为治疗支气管哮喘的主要手段[3]。全国首批名老中医邵经明教授提出的“三穴五针”法,即以双侧肺俞穴、风门穴及单穴大椎为主穴的针刺疗法,在治疗哮病的临床实践中取得了显著疗效[4-5],已成为国家中医药管理局治疗哮喘适宜推广技术[6]。然而,电针调节哮喘的机制尚不清楚。神经影像技术为研究电针调节哮喘的作用机制提供了可视化途径。静息态fMRI以其高空间分辨力、无创性、可视化等优点,极大地推动了神经影像学的快速发展,为探索哮喘脑区的结构、功能及网络连接改变提供了极大帮助,且能显示针刺信息在脑内的变化过程。因此,本研究采用静息态fMRI,分析哮喘患者电针前、后大脑局部一致性(regional homogeneity,ReHo),以及功能连接改变情况,旨在探讨针灸干预哮喘的脑活动变化情况,为进一步研究电针治疗哮喘的神经生理机制奠定基础。
1 资料与方法 1.1 受试者招募所有受试者均来自2019年9月至2020年6月我院呼吸科门诊,招募10例哮喘患者为哮喘组,招募18例与哮喘组年龄、性别、受教育年限相匹配的健康受试者为对照组。本研究通过我院伦理委员会批准(伦理号:2019-766-121-01),所有受试者均被详细告知研究流程并签署知情同意书。
1.2 纳入与排除标准纳入标准:①确诊为支气管哮喘且近2周内未急性发作;②年龄18~60岁,不限性别,右利手;③近1个月未接受过针灸治疗;④能够接受后续电针干预并配合完成MRI扫描;⑤签署知情同意书。排除标准:①近1个月内发热、咳嗽或服用镇静药物;②合并肺部感染、肿瘤或慢性阻塞性肺疾病;③伴失眠、头痛等神经或精神症状;④有幽闭恐惧症或心脏起搏器等MRI扫描禁忌证;⑤哮喘控制测试(asthma control test,ACT)量表评分低于15分,考虑为哮喘急性发作或控制不佳。
1.3 针刺方法选用一次性不锈钢针灸针(0.35 mm×40 mm,华佗牌),电子针疗仪(SDZ-Ⅱ型,苏州医疗用品厂有限公司生产),所有针刺操作由同一位有3年以上经验的针灸医师完成。大椎、风门、肺俞分别依据《腧穴名称与定位:GB/T 12346—2006》进行定位[7]。大穴位定位消毒后进针,行平补平泻手法,以患者产生酸、麻、痛、传递感等为得气标志,记录受试者针感视觉模拟评分。得气后,于肺俞、风门连接导线,电针维持得气。连续波,频率2 Hz,电针30 min。
1.4 MRI扫描采用联影uMR780 3.0 T MRI机,32通道相控阵线圈。受试者戴降噪耳机,闭目保持清醒,尽量减少思考。扫描序列与参数:T1WI结构像,TR 7.2 ms,TE 3.1 ms,层厚1 mm,翻转角10°,视野256 mm×256 mm,层数192;功能像,TR 2 000 ms,TE 30 ms,层厚3.5 mm,翻转角90°,视野224 mm×224 mm,层数33,矩阵64×64。行全脑横断面扫描,平行于AC-PC线,包括小脑和脑干,每次扫描前行空扫5次。每期扫描时间均为8 min(分别于受试者电针前后各扫描1期),共240个时间点。
1.5 数据预处理静息态fMRI数据使用SPM12软件(http://www.fil.ion.ucl.ac.uk/spm/)进行预处理,步骤包括:①剔除前10个时间点,避免初始磁场的不稳定;②时间层校正,同一时间点不同层面扫描存在先后顺序,通过时间层校正消除因时间差带来的误差;③头动校正,剔除在x、y、z轴上头动位移大于1.5 mm或转动大于1.5°的受试者;④图像配准,使用DARTEL算法将受试者的T1WI结构像和功能图像与蒙特利尔神经病学研究所(MNI)标准颅脑解剖模板进行空间配准(重采样体素大小3 mm×3 mm×3 mm),手动检查配准后结果;⑤去线性漂移;⑥滤波,频段为0.01<f<0.08 Hz,消除高频振幅产生的噪声影响;⑦去除协变量,即去除6个头动参数、白质信号,以及脑脊液信号等协变量的影响。
1.6 ReHo值与功能连接分析使用REST软件包(http://www.restfmri.net)计算预处理后数据的肯德尔和谐系数(KCC),评估每个体素与其相邻体素(相邻的26个体素)时间序列的相似性。计算每例受试者的全脑ReHo值,除以该个体全脑的平均ReHo值,减少个体差异带来的误差。以半高全宽为6 mm的高斯核对数据进行平滑处理。选取组间ReHo值差异有统计学意义的脑区作为ROI进行基于种子点的功能连接分析,创建一个半径6 mm的球形ROI,提取并计算每例受试者ROI中所有体素的平均时间序列,然后与全脑余下体素的时间序列行Pearson相关分析,从而得到ROI与全脑的功能连接图(Map图)。功能连接值用相关系数(r值)表示,然后经Fisher’s变换,将r值转变为Z值,使其符合正态分布。
1.7 统计学分析采用SPSS 23.0软件分析数据。2组间正态分布计量资料的比较行t检验,计数资料比较行χ2检验。统计水准取P<0.05。以年龄、性别、受教育年限、头动为协变量,采用独立样本t检验分析2组间ReHo值和功能连接差异,使用AlphaSim多重比较校正,采用体素水平P<0.001,簇体素数ReHo > 26个、功能连接 > 18个进行校正,簇水平P<0.05为差异有统计学意义的区域。
2 结果 2.1 2组临床资料比较(表 1)| 表 1 2组临床资料比较 |
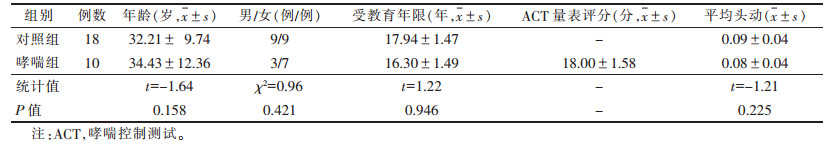 |
2组年龄、性别、受教育年限和MRI扫描期间的平均头动均匹配(均P > 0.05)。
2.2 2组ReHo值比较电针前,与对照组相比,哮喘组左侧脑岛(x=-36,y=-12,z=21)ReHo值升高,差异有统计学意义(t=4.04,P<0.001)。2组其他脑区ReHo值差异均无统计学意义(均P > 0.001)(图 1)。
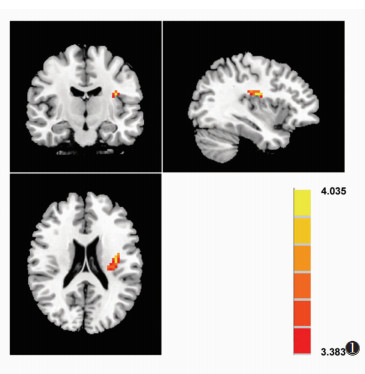 |
| 图 1 电针前哮喘组与对照组局部一致性(ReHo)值差异有统计学意义的脑区(红色-黄色) |
2.3 电针前2组静息态脑功能连接差异
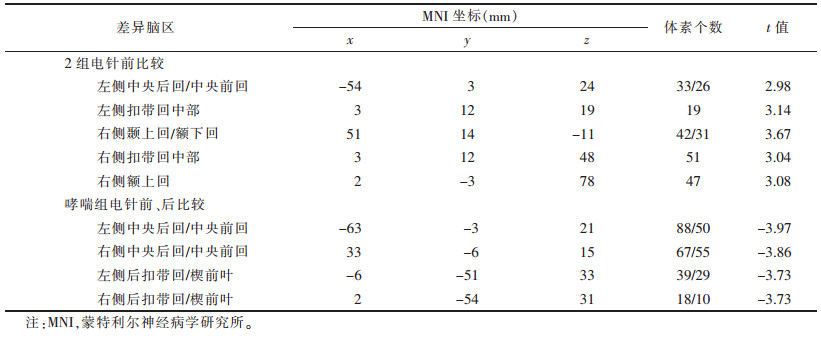
电针前,与对照组相比,哮喘组左侧脑岛与左侧中央前回/中央后回、双侧扣带回中部、右侧颞上回/额下回、右侧额上回功能连接增强(均P<0.001)(图 2,表 2)。
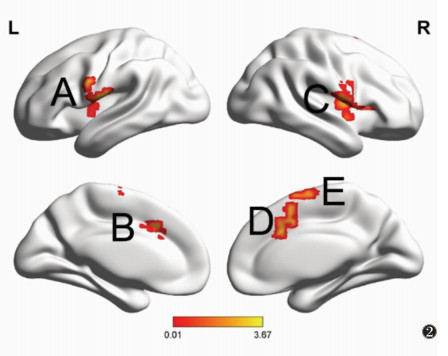 |
| 图 2 电针前哮喘组与对照组功能连接值差异有统计学意义的脑区。以左侧脑岛为种子点,与对照组相比,哮喘组全脑功能连接增强脑区:左侧中央前回/中央后回(A)、左侧扣带回中部(B)、右侧颞上回/额下回(C)、右侧扣带回中部(D)、右侧额上回(E);未发现功能连接降低的脑区(L,左;R,右) |
| 表 2 以左侧脑岛为种子点进行全脑功能连接分析哮喘组与对照组差异有统计学意义的脑区 |
 |
2.4 电针前后哮喘组静息态脑功能连接差异
与电针前相比,电针后哮喘组左侧脑岛与双侧中央后回/中央前回、后扣带回/楔前叶功能连接降低(均P<0.001)(图 3,表 2)。
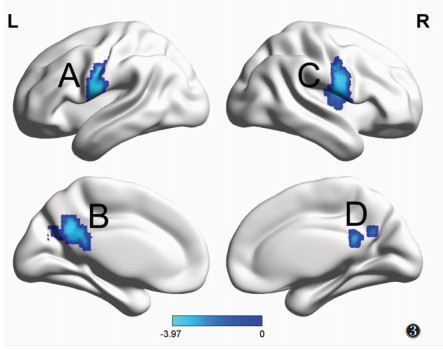 |
| 图 3 电针前、后哮喘组功能连接差异有统计学意义的脑区。以左侧脑岛为种子点,与电针前相比,电针后全脑功能连接降低脑区:左侧中央后回/中央前回(A)、左侧后扣带回/楔前叶(B)、右侧中央后回/中央前回(C)、右侧后扣带回/楔前叶(D);未发现功能连接增强的脑区 |
3 讨论 3.1 脑岛参与情绪及呼吸困难的感知
哮喘在很大程度上被认为是一种心理疾病。左侧脑岛主要负责调节情绪记忆,研究表明,脑岛作为参与情绪调控的重要神经环路在哮喘中同样具有十分重要的作用[8-9]。脑岛可通过影响内分泌-应激反应调控炎症过程[10],且脑岛作为大脑的重要中心,参加呼吸调节[10-12]。脑岛的激活在人类的许多感觉中出现,如对食物的渴望、口渴、恶心,以及接触不愉快的味道和气味[13-14]。有研究认为,脑岛可作为一个内部警报中心,提醒个体潜在的痛苦感受刺激,赋予负面的情绪意义[15],脑岛损伤会导致生理行为的失调。fMRI研究发现,呼吸困难和疼痛感觉涉及的脑区类似,主要包括脑岛在内的边缘系统脑区[16],巧合的是,这些脑区也参与情绪调节[9]。呼吸困难和疼痛的程度越严重,脑岛功能活动度越低。呼吸和脑存在神经连接,呼吸化学感受器和肺感受器经迷走神经传入,投射到脑岛区域[17]。
3.2 哮喘患者脑岛活性增加影像研究表明,健康人在经历呼吸困难时,包括脑岛在内的边缘系统脑区出现脑血流量的增加[18],推测其与呼吸困难的感知有关。Banzett等[19]证实,呼吸困难的感觉涉及了脑岛皮质的显著激活,而这种激活并不是由于二氧化碳浓度增加导致的其他感觉和生理变化所引起。脑岛整合了与体内平衡相关的行为、学习和动机,参与维持足够的气体交换最重要的体内平衡[19-20]。目前较为一致的结论是脑岛的激活可能是呼吸困难的潜在机制。任务态fMRI研究表明,哮喘相关的词语刺激能够使脑岛的血氧水平依赖信号发生改变,哮喘患者进行症状刺激期间,左侧脑岛的神经元活动较对照组增强[9]。Brannan等[21]研究发现,健康受试者经历呼吸困难时脑岛皮质同样被激活。另有研究表明,左侧脑岛皮质的激活能够预示后期肺功能的下降及肺组织中嗜酸性粒细胞的渗透程度[22]。本研究中,患者在静息状态下左侧脑岛的ReHo值升高,即哮喘患者在静息状态下表现为左侧脑岛神经元自发性活动增强,与以往研究结果一致。
3.3 电针可调节哮喘患者感觉运动区网络及情绪认知网络的异常功能连接本研究发现,在以左侧脑岛为ROI的基础上行全脑功能连接分析,电针前与对照组相比,哮喘患者左侧脑岛与左侧中央前回/中央后回、双侧扣带回中部、右侧颞上回/额下回、右侧额上回功能连接增强。这些脑区定位于感觉运动皮质区及认知情绪相关皮质区,提示哮喘患者在静息状态下功能连接增强的这些异常脑网络处于感觉运动、情绪认知信息整合功能增强状态。上述结果与Dodd等[23]的研究类似,他们的研究发现慢性阻塞性肺疾病患者的大多数静息态网络呈现较高的活性。Burki等[24]研究表明,感觉运动皮质在呼吸困难的感觉中起着主要作用。Liu等[25]研究发现,感觉运动网络的改变与哮喘患者呼吸振幅的改变有关。本研究中,电针后,哮喘患者左侧脑岛与左侧中央前回/中央后回的功能连接,与电针前相比,显著降低,推测左侧脑岛与左侧中央前回/中央后回功能连接的逆转有可能是电针改善哮喘疾病的潜在神经生物学机制,仍需进一步的临床研究证实。同时,本研究中,与对照组相比,哮喘组左侧脑岛与右侧额上回功能连接增强。额上回是感觉运动网络中的一个重要脑区[26]。既往研究发现,包括呼吸困难、气道炎症和哮喘控制程度的分级,均与该区域的大脑功能改变有关[27]。慢性阻塞性肺疾病患者也表现出相同脑区的激活[28]。除了网络变化和临床特征之间的关系之外,研究发现了神经炎症的直接证据,即额上回中肿瘤坏死因子α和白细胞介素-1β的水平增加,哮喘小鼠大脑中显著的神经元丢失[29]。此外,研究还发现哮喘患者左侧脑岛与情绪认知相关脑区的功能连接改变[30]。解剖学研究表明,脑岛与情绪认知有关的重要神经结构有很强的关联[31],主要负责自我参照的情感决策[32]。本研究中电针后哮喘患者默认网络较电针前功能连接降低,提示电针后默认网络的改变有可能参与哮喘患者的情绪处理。
总之,哮喘患者静息状态下左侧脑岛ReHo信号增强,电针能够调节左侧脑岛与感觉运动网络及默认网络、认知网络之间的异常功能连接,这为研究电针治疗哮喘产生疗效的神经生理机制奠定了基础。本研究的不足:样本量较小;未对哮喘患者的病程、电针的长期疗效和脑功能的关系进行研究。未来拟进一步增加样本量,结合多维度临床资料进一步探讨电针治疗哮喘的脑影像学机制。
| [1] |
中华医学会呼吸病学分会哮喘学组. 支气管哮喘防治指南(2020年版)[J]. 中华结核和呼吸杂志, 2020, 43(12): 1023-1048. DOI:10.3760/cma.j.cn112147-20200618-00721 |
| [2] |
NTONTSI P, PHOTIADES A, ZERVAS E, et al. Genetics and epigenetics in asthma[J]. Int J Mol Sci, 2021, 22(5): 2412. DOI:10.3390/ijms22052412 |
| [3] |
李孟媛, 王朝辉, 王洪峰. 针刺治疗支气管哮喘机制的研究进展[J]. 上海针灸杂志, 2018, 37(10): 1116-1120. |
| [4] |
张奥, 严兴科, 刘安国. 邵氏"三穴五针法"治疗哮病的临床研究进展[J]. 上海针灸杂志, 2017, 36(9): 1142-1146. |
| [5] |
郑洁, 邵素菊, 王培育, 等. "邵氏五针法"为主治疗变应性鼻炎-哮喘综合征: 多中心随机对照研究[J]. 中国针灸, 2020, 40(5): 483-487. |
| [6] |
ZHANG Y, LI P, MA Y, et al. Investigation of health anxiety and related factors in Chinese patients with physical disease[J]. Perspect Psychiatr Care, 2018, 54(2): 185-191. DOI:10.1111/ppc.12220 |
| [7] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 腧穴名称与定位: GB/T 12346—2006[S]. 北京: 中国标准出版社, 2006.
|
| [8] |
ROSENKRANZ M A, BUSSE W W, SHERIDAN J F, et al. Are there neurophenotypes for asthma? Functional brain imaging of the interaction between emotion and inflammation in asthma[J]. PLoS ONE, 2012, 7(8): 40921. DOI:10.1371/journal.pone.0040921 |
| [9] |
ROSENKRANZ M A, BUSSE W W, JOHNSTONE T, et al. From the cover: neural circuitry underlying the interaction between emotion and asthma symptom exacerbation[J]. Proc Natl Acad Sci U S A, 2005, 102(37): 13319-13324. DOI:10.1073/pnas.0504365102 |
| [10] |
KLINE J N, ROSE R M. Central nervous system influences in asthma[J]. Adv Exp Med Biol, 2014, 795: 309-319. |
| [11] |
COBAN H, AYDEMIR Y. The relationship between allergy and asthma control, quality of life, and emotional status in patients with asthma: a cross-sectional study[J]. Allergy Asthma Clin Immunol, 2014, 10(1): 67. DOI:10.1186/s13223-014-0067-4 |
| [12] |
YU L, DE MAZANCOURT M, HESS A, et al. Functional connec- tivity and information flow of the respiratory neural network in chronic obstructive pulmonary disease[J]. Hum Brain Mapp, 2016, 37(8): 2736-2754. DOI:10.1002/hbm.23205 |
| [13] |
MILLER A D, ROWLEY H A, ROBERTS T P, et al. Human cortical activity during vestibular- and drug-induced nausea detected using MSI[J]. Ann N Y Acad Sci, 1996, 781: 670-672. DOI:10.1111/j.1749-6632.1996.tb15755.x |
| [14] |
KINOMURA S, KAWASHIMA R, YAMADA K, et al. Functional anatomy of taste perception in the human brain studied with positron emission tomography[J]. Brain Research, 1994, 659(1-2): 263-266. DOI:10.1016/0006-8993(94)90890-7 |
| [15] |
REIMAN E M. The application of positron emission tomography to the study of normal and pathologic emotions[J]. J Clin Psychiatry, 1997, 58(16): 4-12. |
| [16] |
SCANO G, GIGLIOTTI F, STENDARDI L, et al. Dyspnea and emotional states in health and disease[J]. Respir Med, 2013, 107(5): 649-655. DOI:10.1016/j.rmed.2012.12.018 |
| [17] |
HANAMORI T, KUNITAKE T, KATO K, et al. Convergence of oropharyngolaryngeal, baroreceptor and chemoreceptor afferents onto insular cortex neurons in rats[J]. Chem Senses, 1997, 22(4): 399-406. DOI:10.1093/chemse/22.4.399 |
| [18] |
CORFIELD D R, FINK G R, RAMSAY S C, et al. Evidence for limbic system activation during CO2-stimulated breathing in man[J]. J Physiol, 1995, 488(1): 77-84. DOI:10.1113/jphysiol.1995.sp020947 |
| [19] |
BANZETT R B, MULNIER H E, MURPHY K, et al. Breath- lessness in humans activates insular cortex[J]. NeuroReport, 2000, 11(10): 2117-2120. DOI:10.1097/00001756-200007140-00012 |
| [20] |
AUGUSTINE J R. Circuitry and functional aspects of the insular lobe in primates including humans[J]. Brain Res Brain Res Rev, 1996, 22(3): 229-244. DOI:10.1016/S0165-0173(96)00011-2 |
| [21] |
BRANNAN S, LIOTTI M, EGAN G, et al. Neuroimaging of cerebral activations and deactivations associated with hypercapnia and hunger for air[J]. Proc Natl Acad Sci U S A, 2001, 98(4): 2029-2034. DOI:10.1073/pnas.98.4.2029 |
| [22] |
STRINE T W, MOKDAD A H, BALLUZ L S, et al. Impact of depression and anxiety on quality of life, health behaviors, and asthma control among adults in the United States with asthma, 2006[J]. J Asthma, 2008, 45(2): 123-133. DOI:10.1080/02770900701840238 |
| [23] |
DODD J W, CHUNG A W, VAN DEN BROEK M D, et al. Brain structure and function in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2012, 186(3): 240-245. DOI:10.1164/rccm.201202-0355OC |
| [24] |
BURKI N K, LEE L Y. Mechanisms of dyspnea[J]. Chest, 2010, 138(5): 1196-1201. DOI:10.1378/chest.10-0534 |
| [25] |
LIU Y, QIN W, LI R, et al. Investigation on the neural mechanism of hypnosis-based respiratory control using functional MRI[J]. Contrast Media Mol Imaging, 2018, 2018: 8182542. |
| [26] |
LI W, QIN W, LIU H, et al. Subregions of the human superior frontal gyrus and their connections[J]. NeuroImage, 2013, 78: 46-58. DOI:10.1016/j.neuroimage.2013.04.011 |
| [27] |
HERIGSTAD M, FAULL O K, HAYEN A, et al. Treating breath- lessness via the brain: changes in brain activity over a course of pulmonary rehabilitation[J]. Eur Respir J, 2017, 50(3): 1701029. DOI:10.1183/13993003.01029-2017 |
| [28] |
HERIGSTAD M, HAYEN A, EVANS E, et al. Dyspnea-related cues engage the prefrontal cortex[J]. Chest, 2015, 148(4): 953-961. DOI:10.1378/chest.15-0416 |
| [29] |
XIA M X, DING X, QI J, et al. Inhaled budesonide protects against chronic asthma-induced neuroinflammation in mouse brain[J]. J Neuroimmunol, 2014, 273(1-2): 53-57. DOI:10.1016/j.jneuroim.2014.06.005 |
| [30] |
ZHANG Y, YANG Y, BIAN R, et al. Abnormal functional connec- tivity of ventral anterior insula in asthmatic patients with depres- sion[J]. Neural Plast, 2017, 2017: 7838035. |
| [31] |
NIEUWENHUYS R. The insular cortex: a review[J]. Prog Brain Res, 2012, 195: 123-163. |
| [32] |
DAVEY C G, HARRISON B J. The brain's center of gravity: how the default mode network helps us to understand the self[J]. World Psychiatry, 2018, 17(3): 278-279. DOI:10.1002/wps.20553 |
 2022, Vol. 20
2022, Vol. 20


