| 血管性认知障碍大鼠模型海马损伤的MRI表征 |
血管性认知障碍(vascular cognitive impairment, VCI)是老年人群认知功能障碍最常见的2种类型疾病之一。脑血管病变是老年人及神经退行性病患者常见的隐匿性疾病, 被认为是引起认知功能障碍及痴呆的主要危险因素[1-2]。海马是公认的与认知功能密切相关的脑区, 临床研究[3-4]显示, VCI伴海马萎缩。但目前对VCI的早期诊断、有效治疗和预后评估一直是医学界面临的难题。动物模型的MRI研究作为连接疾病临床和基础研究的桥梁, 可帮助理解VCI进程中影像学指标与病理变化之间的联系, 将有助于更好地认识VCI的发生及发展。因此, 探讨VCI早期海马的影像学表现及VCI引起海马的病理改变具有重要的临床意义。本研究通过建立VCI的大鼠模型, 利用MRI并结合组织化学染色发现VCI引起海马损伤的MRI表征及其病理改变, 现报道如下。
1 材料与方法 1.1 VCI大鼠模型制作将30只体质量约200 g的雄性SPF级大鼠[购买于贵州医科大学实验动物中心, 合格证编号:SYXK(黔)2018-0001]随机分为模型组20只和对照组10只, 采用改良的Pulsinelli四血管闭塞(4-VO)法模拟全脑慢性缺血。大鼠术前12 h禁食, 4 h禁水, 使用10%水合氯醛行腹腔注射麻醉(剂量300 mg/kg体质量)。手术第1天颈后正中切口, 分离出C1两侧翼孔, 用电凝针凝闭双侧椎动脉, 缝合; 24 h后于大鼠颈部正中切开, 钝性分离双侧颈总动脉, 并用血管夹夹闭10 min, 共3次, 每次间隔1 h。大鼠发生缺血性改变判断标准:夹闭双侧颈内动脉后, 皮肤黏膜变为白色, 眼球变白, 自主活动消失, 生命体征存在; 放开动脉夹行再灌注时, 皮肤黏膜及眼球逐渐变为红色, 大鼠可自主活动。对照组重复以上过程, 但不行血管处理。
1.2 仪器与方法 1.2.1 MRI扫描所有大鼠于造模后2周、1个月、3个月、5个月行MRI扫描, 使用3.0 T人体扫描仪及小动物专用4通道相控阵表面线圈。使用10%水合氯醛对大鼠进行腹腔注射麻醉(剂量300 mg/kg体质量), 并将其头部固定于表面线圈。
T2WI解剖结构像, 扫描参数:TR 5 800 ms, TE 80 ms, 视野3.5 cm×3.5 cm, 采集矩阵256×128, 层厚1 mm, 层数20。
1H-MRS扫描采用单体素PRESS序列, 扫描参数:TR 2 000 ms, TE 40 ms, 采集矩阵128×128, 视野5 mm×8 mm×8 mm, 翻转角90°, 激励次数1, 扫描时长4 min 52 s。根据大鼠MRI轴位、冠状位、矢状位T2WI确定ROI, 即双侧海马, 尽量避开周围脑脊液等结构。ROI包含部分皮层及皮层下区域。
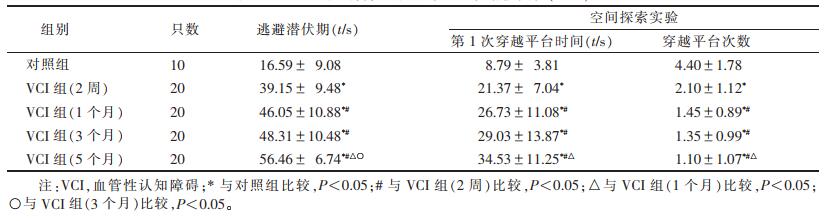
1.2.2 学习记忆能力检测用Morris水迷宫检测大鼠学习记忆功能变化, 适应性喂养2周行预扫描。选择T2WI结构像上大脑实质无明显结构及信号异常的大鼠进行水迷宫实验, 主要包括定位航行和空间探索实验两部分。第1~5天完成定位航行实验, 方法:每日将大鼠按1、2、3、4象限顺序面向池壁从入水点放入水池中, 并记录60 s内大鼠找到固定于第4象限隐藏平台的时间(即逃避潜伏期)及游泳路径。每只大鼠每天训练4次, 以其4次逃避潜伏期的平均值作为当日的学习成绩; 第6天完成空间探索实验:撤去位于第4象限的平台, 将大鼠按同样方法放入水中, 记录其60 s内穿过第4象限原平台位置的次数及第1次穿过原平台位置的时间。
1.3 数据处理在T2WI图像上手动画出代表海马面积的ROI(图 1), 读出像素个数。所有波谱原始数据导入电脑工作站, 应用LCModel软件进行处理, 主要包括N-乙酰天门冬氨酸(NAA)、肌酸(Cr)、肌醇(MI)、谷氨酸(Glu)的浓度。本研究采用NAA/Cr、MI/Cr、Glu/Cr比值的方法代表各代谢物的含量变化, 以消除个体差异。
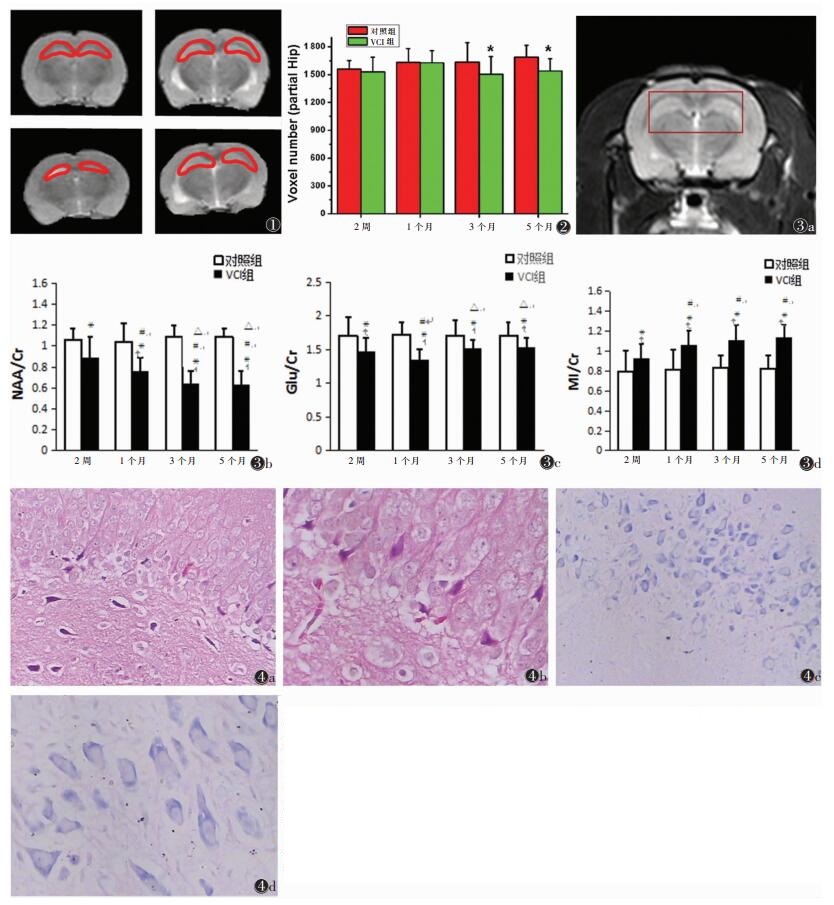 |
| 图 1 左侧红色曲线勾画出选取海马的解剖位置 图 2 柱状图显示,从术后3个月起,海马出现萎缩[红色为对照组,绿色为血管性认知障碍(VCI)模型组] 图 3 ROI区(主要为海马大部分)1H-MRS定量分析统计图 图 3a 定位像红色方框显示的是1H-MRS波谱所采集的区域 图 3b 柱状图分别显示的是随VCI病程发展,NAA/Cr、Glu/Cr及MI/Cr(NAA,N-乙酰天门冬氨酸;Cr,肌酸;MI,肌醇)比值的变化 图 4 术后5个月VCI大鼠海马HE及Nissl染色图 图 4a(HE×100),4b(HE×200)海马CA1区锥体细胞排列紊乱、结构模糊,少数神经元呈点状或片状嗜伊红染色增强 图 4c(Nissl×100),4d(Nissl×200)显示海马锥体细胞胞浆内尼氏体减少、染色减弱,部分锥体细胞胞浆内尼氏体溶解、轮廓模糊着色浅淡 |
1.4 统计学分析
采用SPSS 17.0统计软件进行数据分析。水迷宫数据处理:实验数据以x±s表示, 模型组与对照组之间比较采用独立样本t检验, 模型组不同时间点的比较采用重复测量的方差分析, 使用Origin 7.0作图, 数据统计分析行两样本t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 水迷宫实验结果模型组大鼠术后2周, 即出现学习和记忆能力下降, 与对照组大鼠相比, 其逃避潜伏期及第1次穿越平台时间延长, 穿越平台次数减少, 差异均有统计学意义(均P < 0.05)。术后1、3、5个月, 其学习记忆能力持续下降(表 1)。
| 表 1 Morris水迷宫检测大鼠学习记忆功能变化(x±s) |
 |
2.2 海马形态的变化
模型组大鼠2周、1个月海马面积大小与对照组大鼠相比, 差异均无统计学意义(均P > 0.05);但在术后3、5个月, 模型组大鼠海马体积明显萎缩, 与对照组大鼠相比, 差异均有统计学意义(均P < 0.05)(图 2)。
2.3 海马区域代谢产物的异常对海马区域1H-MRS的定量分析, 发现模型组大鼠海马内存在代谢异常, 与对照组比较, 术后2周其NAA/Cr显著下降、MI/Cr显著升高, 一直持续至术后5个月; 此外, Glu/Cr在术后2周出现显著下降, 术后1个月下降至最低, 而后略有回升(图 3)。
2.4 海马区域HE及Nissl染色海马CA1区锥体细胞排列紊乱、结构模糊, 少数神经元呈点状或片状嗜伊红染色增强, 似红色神经元。海马锥体细胞胞浆内尼氏体减少、染色减弱, 部分锥体细胞胞浆内尼氏体溶解、轮廓模糊着色浅淡(图 4)。
3 讨论本实验采用改良Pulsinelli 4-VO法制作VCI大鼠模型, 水迷宫实验结果提示, 与对照组相比, VCI组在造模后2周即出现学习和记忆能力下降, 表现为逃避潜伏期及第1次穿越平台时间延长, 穿越平台次数减少, 证明VCI模型制作成功。VCI模型大鼠的学习和记忆能力随术后时间的延长, 损害加重, 说明此模型引起的全脑慢性缺血性改变可持续造成海马的损伤。
海马是公认的与认知功能密切相关的脑区, 临床实验[3-4]显示, VCI伴海马萎缩, 且两侧海马体积明显不对称, 左侧海马体积萎缩更明显。动物实验[5]也发现, VCI动物模型存在明显的海马损伤, 海马损伤可导致认知能力的受损, 且认知能力下降程度与海马组织受损的体积大小相关。本研究发现, 模型组大鼠2周、1个月海马体积大小与对照组相比, 差异均无统计学意义(均P > 0.05), 但在术后3、5个月, VCI模型组大鼠海马体积明显萎缩, 与对照组大鼠相比, 差异均有统计学意义(均P < 0.05), 提示海马组织损伤明显; 且随时间延长, 损伤加重, 认知能力下降越明显。
1H-MRS是目前检测脑内代谢物和生化成分的唯一非侵袭性技术, 具有很好的可重复性及稳定性, 它可提供神经元的功能、活力、完整性、能量代谢及神经胶质增生等信息[6]。据报道[7], VCI患者NAA、NAA/Cr水平降低, 卒中后无认知障碍的患者无神经代谢的改变, 但伴认知功能障碍者顶、枕叶NAA水平显著降低[8]。MI仅存在于胶质细胞中, 其功能和维持神经胶质细胞的体积稳定有关, 升高则提示胶质增生[9]。既往研究[7]显示, 双侧海马MI的升高与认知损害程度呈正相关, 说明认知损害随海马区神经胶质细胞增生的程度加深而不断加重。在阿尔茨海默病研究[10-11]中发现, 轻度认知障碍患者海马MI/Cr值显著增加, 且其敏感程度高于NAA的降低。本研究也发现, 与对照组比较, VCI模型组大鼠MI/Cr升高, 术后1、3、5个月大鼠海马MI/Cr较术后2周升高, 表明VCI模型组大鼠海马早期即出现神经胶质细胞的增生。
综上所述, VCI大鼠在术后2周即出现海马代谢物的异常, 主要为NAA含量的持续降低及MI含量的持续上升, 而在术后3个月, 海马才表现出明显萎缩。因此, 推测VCI大鼠海马内代谢物的改变可能早于海马形态的改变, VCI大鼠海马NAA浓度的早期降低和MI浓度的早期升高可能成为VCI早期诊断的观察指标。
| [1] |
ZHANG Y, XU Y, NIE H, et al. Prevalence of dementia and major dementia subtypes in the chinese populations:a meta-analysis of dementia prevalence surveys, 1980-2010[J]. J Clin Neurosci, 2012, 19(10): 1333-1337. DOI:10.1016/j.jocn.2012.01.029 |
| [2] |
KALARIA R N, AKINYEMI R, IHARA M. Does vascular pathology contribute to alzheimer changes?[J]. J Neurol Sci, 2012, 322(1-2): 141-147. DOI:10.1016/j.jns.2012.07.032 |
| [3] |
BASTOS-LEITE A J, VAN DER FLIER W M, et al. The contribution of medial temporal lobe atrophy and vascular pathology to cognitive impairment in vascular dementia[J]. Stroke, 2007, 38(12): 3182-3185. DOI:10.1161/STROKEAHA.107.490102 |
| [4] |
SHIINO A, AKIGUCHI I, WATANABE T, et al. Morphometric characterization of Binswanger's disease:comparison with Alzheimer's disease[J]. Eur J Radiol, 2012, 81(9): 2375-2379. DOI:10.1016/j.ejrad.2011.05.031 |
| [5] |
MOMS R G M, MESER E L, RIEDEL G. Elements of a neurobiologieal theory of the hippocompus:the role of activity-dependent synaptic plasticity in memory[J]. Philes Trans R Soc Lond B Biol Sci, 2003, 358(1432): 773-786. DOI:10.1098/rstb.2002.1264 |
| [6] |
MARTIN W R. MR spectroscopy in neurodegenerative disease[J]. Mol Imaging Biol, 2007, 9(4): 196. DOI:10.1007/s11307-007-0087-2 |
| [7] |
MCHUGH T L, SAYKIN A J, WISHART H A, et al. Hippocampal volume and shape analysis in an older adult population[J]. Clin Neuropsychol, 2007, 21(1): 130-145. DOI:10.1080/13854040601064534 |
| [8] |
FRANCZAK M, PROST R M, AUTUONO P G, et al. Proton magnetic resonance spectroscopy of the hippocampus in patients with mild cognitive impairment:a pilot study[J]. J Comput Assist Tomogr, 2007, 31(5): 666-670. DOI:10.1097/RCT.0b013e318031bc31 |
| [9] |
SALMENPERA T, KALVIAINEN R, PARTANEN K, et al. Hippocampal and amygdaloid damage in partial epilepsy:a cross-sectional MRI study of 241 parients[J]. Epilepsy Res, 2001, 46(1): 69-82. |
| [10] |
FRANCZAK M, PROST R M, AUTUONO P G, et al. Proton magnetic resonance spectroscopy of the hippocampus in patients with mild cognitive impairment:a pilot study[J]. J Comput Assist Tomogr, 2007, 31(5): 666-670. DOI:10.1097/RCT.0b013e318031bc31 |
| [11] |
SIGER M, SCHUFF N, ZHU X, et al. Regional myo-inositol concentration in mild cognitive impairment using 1H magnetic resonance spectroscopy imaging[J]. Alzheimer Dis Assoc Disord, 2009, 23(1): 57-62. DOI:10.1097/WAD.0b013e3181875434 |
 2020, Vol. 18
2020, Vol. 18


