| 铁氰化锰纳米对比剂对大鼠肝脏MRI T1WI增强扫描效果的实验研究 |
2. 苏州大学附属第二医院放射科,江苏 苏州 215004
肝细胞癌是常见的恶性肿瘤, 早期发现并及时治疗是提高预后及生存率的关键。影像检查尤其是MRI增强扫描是目前诊断肝癌极其重要的手段。Gd-DTPA是临床广泛应用的MRI对比剂, 但其代谢快, 须用快速序列完成增强扫描, 因其在体内分布无特异性, 无组织或器官选择性, 近年来与基于Gd的对比剂相关的肾源性系统纤维化引起了严重的安全问题, 特别是对于肾功能异常的患者[1-3]。随着纳米技术的快速发展, 磁性纳米颗粒显示出巨大的生物成像潜力, 如锰纳米粒子[4-5]。顺磁性元素锰为人体必需微量元素, 第三轨道含有5个不成对电子, 能够缩短T1弛豫时间, 提高T1WI信号强度, 已被开发为理想的替代对比剂。本研究分析使用铁氰化锰纳米颗粒时大鼠肝脏的MRI T1WI增强扫描特征, 以探讨其作为MRI对比剂的可行性。
1 材料与方法 1.1 实验动物健康雄性SD大鼠, 体质量260~310 g, 7周龄, 由常州卡文斯实验动物中心提供。
1.2 实验试剂及分析方法铁氰化锰纳米对比剂由常州柯艾医药科技有限公司研制。透射电子显微镜下观察铁氰化锰纳米颗粒的表征, X射线衍射仪测定其分子结构。
1.3 仪器与方法采用Philips 1.5 T超导MRI仪。向大鼠腹腔注射3.6%的水合氯醛(剂量1 mL/100 g体质量)将其麻醉; 待深度麻醉后(角膜反射减弱、肌张力减弱), 腹部加压包扎以抑制呼吸运动幅度, 使其俯卧位固定于自制扫描架上, 肝脏部位置于Microscopy 4.7 cm显微线圈中央, 调整大鼠位置确保大鼠肝脏位于磁体中心位置; 给药前行TSE-T1WI序列MRI扫描, 扫描参数:TR 100 ms, TE 7.6 ms, 层厚2 mm, 层距0.2 mm, FOV 64 mm×64 mm, 矩阵256×256。后经尾静脉注入铁氰化锰纳米对比剂, 剂量50 μmmol/kg体质量, 分别在5 min、20 min、40 min、1 h、2 h、4 h、6 h、10 h、16 h、24 h、7 d对大鼠肝脏行TSE-T1WI序列扫描, 观察肝脏强化情况。一次麻醉持续2~4 h, 根据实验需要及大鼠状态补麻药。
1.4 图像分析在图像后处理工作站上, 分别测量注射对比剂前后各时间点的肝脏信号强度(SI), 图像噪声为同层水平背景噪声信号强度的标准差(SDn)。测量时, ROI选择信号强度均匀、远离大血管和伪影的圆形区域, 面积35 mm2, 应尽可能在增强扫描前后相同层面的同一部位进行, 每个层面选3处测量并取其平均值, 作为每只大鼠整个肝脏的平均SI。测量背景噪声时, ROI放在与肝脏同一相位编码方向腹前壁之外的邻近背景处, 面积15 mm2。
计算肝脏的SNR, SNR=SI/SDn。绘制平扫及增强扫描后各时间点的肝脏SNR-时间曲线。
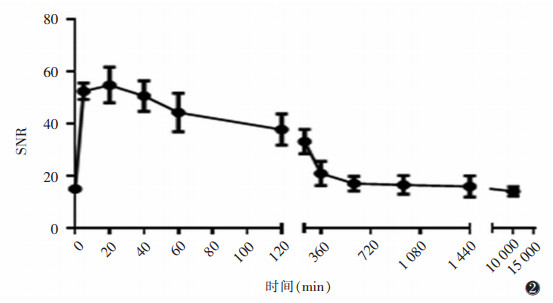
1.5 统计学分析使用SPSS 20.0统计软件, 计量资料以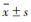
透射电子显微镜下, 铁氰化锰纳米颗粒呈正方体, 粒径1~5 nm, 分散均匀。X射线粉末衍射分析结果显示, 其主要成分为Mn3[Fe(CN)6]2·13H2O。
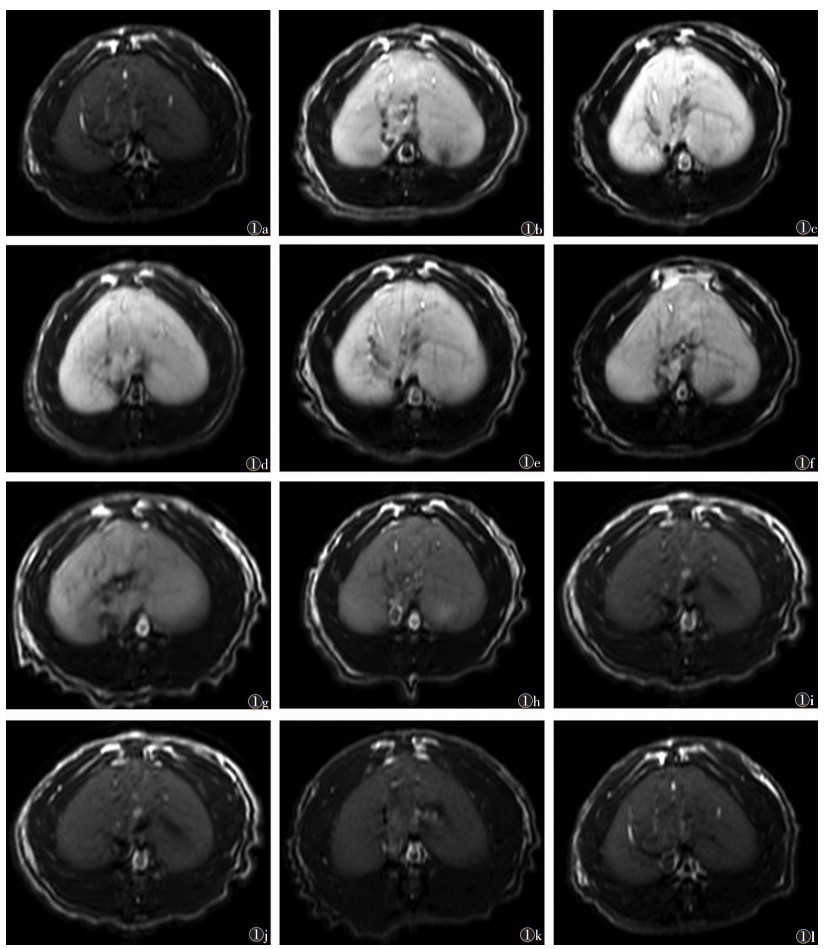
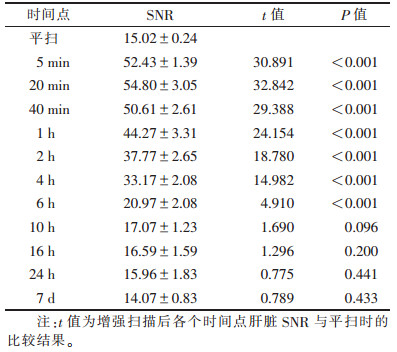
2.2 体内实验增强扫描前后各时间点大鼠肝脏的SNR见表 1。增强扫描后5 min, 肝脏组织明显强化, 20 min达高峰, 40 min强化程度仍很高, 5 min~1 h为肝脏强化平台期, 1~2 h肝脏信号强度轻度下降, 4 h开始明显下降。注射对比剂后5 min~6 h各时间点肝脏SNR与平扫时相比, 差异均有统计学意义(均P < 0.05), 10 h~7 d各时间点肝脏SNR与平扫比较差异均无统计学意义(均P> 0.05)。增强扫描前后各时间点大鼠肝脏图像见图 1, 肝脏SNR-时间曲线见图 2。
 |
| 图 1 图 1a~1l 分别为注射铁氰化锰纳米对比剂前及注射后5 min、20 min、40 min、1 h、2 h、4 h、6 h、10 h、16 h、24 h、7 d大鼠肝脏T1WI图像 图 1a 为平扫图像 图 1b~1e 增强扫描后5 min~1 h肝脏明显强化 图 1f~1j 增强扫描2 h及以后肝脏信号减低 图 1k~1l 肝脏信号基本恢复至平扫水平 |
 |
| 图 2 肝脏SNR-时间曲线,横坐标轴代表平扫及增强扫描后各时间点(5 min、20 min、40 min、1 h、2 h、4 h、6 h、10 h、16 h、24 h、7 d)。纵坐标轴代表肝脏SNR |
表 1 增强扫描前后不同时间点肝脏SNR比较(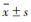 |
 |
3 讨论
锰是人体必需的微量元素, 与人体多种生理功能有关。金属锰离子第三轨道上有5个不成对电子, 故具有很强的顺磁性和很好的弛豫效能。而本研究所用的铁氰化锰纳米颗粒, 电镜下仅1~5 nm, 具有较好的分散性, 进入血液后, 被肝脏中的库普弗细胞吞噬[6]。由于Mn2+能明显缩短组织的T1弛豫时间, 正常肝脏中含有大量的吞噬细胞(库普弗细胞), 故注射后正常肝脏组织明显强化, T1WI呈明显高信号, 这与其他学者[7-8]关于锰纳米材料对肝脏的增强扫描的研究结果一致。纳米颗粒能够延长对比剂在肝脏中的停留时间[9-10], 因而具有较好的体内分布和代谢特性。本研究中, 大鼠肝脏信号从注入对比剂后5 min即明显增高, 20 min时达高峰, 为54.80±3.05, 40 min肝脏强化仍很明显, 肝脏持续高强化至1 h左右, 5 min~1 h为平台期, 但强化峰值出现在注射对比剂20 min左右, 1 h之后信号强度轻度下降, 4 h明显下降。本研究中锰对比剂肝脏增强扫描的平台期约1 h, 平台期出现的意义:①增强扫描后5 min~1 h肝脏持续强化, 峰值持续时间长, 说明铁氰化锰增强扫描时间窗很宽; ②如发生铁氰化锰注射后扫描失败(循环时间变异、动脉期扫描太早或太晚、动脉期屏气配合欠佳等), 可在增强扫描后1 h内重复检查, 还可根据需要行多序列扫描, 而不影响增强扫描效果。锰的清除机制主要是肝脏通过胆道排泄, 16 h后肝脏的信号强度与平扫相比差异无统计学意义, 24 h肝脏信号强度恢复至增强扫描前水平, 肉眼观察图像与平扫类似, 在注射对比剂后7 d肝脏信号已恢复至平扫水平, 锰在肝脏中已代谢完毕。
目前, 被FDA批准商业化的锰对比剂锰福地吡(Mn-DPDP)具有较强的肝脏强化作用[11], 但Mn-DPDP是一种络合物, Mn2+易解离, 具有缩血管作用[12], 患者在注射后面色潮红, 全身发热, 心跳加快, 极少数有血压升高等不良反应; 而且超剂量的Mn2+会在大脑基底节、黑质等脑区沉积, 可能引起生物毒性, 其中一些表现与帕金森病相似[13-14]。本研究所用的铁氰化锰纳米对比剂为合成的纳米材料, 结构稳定, 在含锰量相同的情况下, 其Mn2+造成的不良反应小于Mn-DPDP。与Mn-DPDP相比, 铁氰化锰纳米对比剂弛豫率高, 获得的图像SNR高, 在肝脏中的强化效果更明显。
本研究不足:仅对大鼠肝脏行MRI成像初步研究, 未对铁氰化锰纳米颗粒在动物体内各脏器的组织分布及清除规律进行分析, 还需在今后的研究中进一步完善。
综上所述, 目前, 铁氰化锰纳米对比剂仅限于动物实验研究, 其对大鼠肝脏有明显的强化效果, 具有作为MRI对比剂的潜能。
| [1] |
Leyba K, Wagner B. Gadolinium-based contrast agents:why nephrologists need to be concerned[J]. Curr Opin Nephrol Hypertens, 2019, 28: 154-162. |
| [2] |
Young LK, Matthew SZ, Houston JG. Absence of potential gadolinium toxicity symptoms following 22897 gadoteric acid (DotaremR) examinations, including 3209 performed on renally insufficient individuals[J]. Eur Radiol, 2019, 29: 1922-1930. |
| [3] |
Shah AH, Olivero JJ. Gadolinium-induced nephrogenic systemic fibrosis[J]. Methodist Debakey Cardiovasc, 2017, 13: 172-173. |
| [4] |
Li B, Gu Z, Kurniawan N, et al. Manganese-based layered double hydroxide nanoparticles as a T1-MRI contrast agent with ultrasensitive pH response and high relaxivity[J]. Adv Mater, 2017, 29. DOI:10.1002/adma.201700373 |
| [5] |
Zheng Y, Zhang H, HU Y, et al. MnO nanoparticles with potential application in magnetic resonancybae imaging and drug delivery for myocardial infarction[J]. Int J Nanomedicine, 2018, 13: 6177-6188. |
| [6] |
徐耀.铁氰化锰钾纳米对比剂对大鼠肝脏MR成像T2WI增强效应分析及其病理基础研究[D].苏州: 苏州大学, 2017.
|
| [7] |
Kim SM, Im GH, Lee DG, et al. Mn2+-doped silica nanoparticles for hepatocyte-targeted detection of liver cancer in T1-weighted MRI[J]. Biomaterials, 2013, 34: 8941-8948. |
| [8] |
Sahani DV, O'Malley ME, Bhat S, et al. Contrast-enhanced MRI of the liver with mangafodipir trisodium:imaging technigue and resuIts[J]. Comput Assist Tomogr, 2002, 26: 216-222. |
| [9] |
Zheng SG, Xu HX, Chen HR. Nano/microparticles and ultrasound contrast agents[J]. World J Radiol, 2013, 5: 468-471. |
| [10] |
Tu C, Louie AY. Nanoformulations for molecular MRI[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2012, 4: 448-457. |
| [11] |
范明霞, 周康荣, 沈继章, 等. 大鼠正常肝脏Mn-DPDP增强MRI研究[J]. 放射学实践, 2004, 19(5): 315-318. |
| [12] |
Schmidt PP, Toft KG, Skotland T, et al. Stability and transmeta llation of the magnetic resonance contrast agent Mn-DPDP measured by EPR[J]. J Biol Inorg Chem, 2002, 7: 241-248. |
| [13] |
Uchino A, Noguchi T, Nomiyama K, et al. Manganese accumul ation in the brain:MR imaging[J]. Neuroradiology, 2007, 49: 715-720. |
| [14] |
Jackson SJ, Hussey R, Jansen MA, et al. Manganese-enhanced magnetic resonance imaging (MEMRI) of rat brain after syste mic administration of MnCl2:Hippocampal signal enhancement without disruption of hippocampus-dependent behavior[J]. Behav Brain Res, 2011, 216: 293-300. |
 2020, Vol. 18
2020, Vol. 18


