| 改良伸直位制动法建立兔膝骨关节炎模型的效果评价 |
骨性关节炎(osteoarthritis, OA)是最常见的骨关节病, 主要病因是软骨退变[1]。相关研究[2]显示, 我国OA的发病率约8.3%, 65岁以上人群放射学OA的发病率高达50.0%。目前, OA发病及治疗干预机制的前期研究都依赖于动物实验, 因此, 建立一种可行、可靠的动物模型对OA的研究具有十分重要的意义。制动法OA模型在模拟OA病理生改变、药物筛选、疗效评价方面具有较大优势, 但经典的制动法存在造模时间长、制动管型易咬除脱落、并发症较多等问题, 因此本研究对伸直位制动法进行了改良, 成功制备了兔膝关节OA模型, 现阐述如下。
1 材料与方法 1.1 实验动物选择新西兰大白兔27只(湖南中医药研究院实验动物中心提供), 体质量(2 035±167)g; 雄性14只, 雌性13只; 适应性喂养1周; 随机分为2组, A组9只, 制动2周; B组18只, 制动6周。本实验经湖南省中医药研究院伦理委员会批准(伦理审查备案号2017-0021)。
1.2 实验器械兔架、电子秤、医用高分子固定绷带(苏州元康医疗器械有限公司)、压舌板、绷带、纱布、石膏剪、手术刀、手术剪、骨剪、镊子和动物用去毛剪等。
1.3 实验方法 1.3.1 造模方法① 造模前准备:将实验兔斜俯卧位固定于实验台, 向后上方拉直右下肢。去毛剪去毛, 范围为右侧髋关节至踝关节。医用碘伏消毒裸露皮肤, 如有皮肤损伤, 止血消毒后, 用医用纱布包扎。②造模:伸直右下肢膝关节, 同侧踝关节保持正常生理曲度。用绷带将压舌板缠绕固定于右下肢内侧, 再用医用胶带加固, 压舌板上端距髋关节1~2 cm, 下端超过踝关节。后依次缠绕多层纱布和4层医用高分子固定绷带, 高分子固定绷带缠绕松紧适中, 缠绕方式为重叠二分之一螺旋状缠绕, 缠绕区域为髋关节至踝关节以下4~5 cm, 裸露远端脚趾以便后续观察。高分子固定绷带管型在踝关节处呈"L"型, 角度为120°~150°。姿势固定4~5 min以待管型定型。确定姿势固定满意、管型位置、形态符合要求、无其他损伤后, 将实验兔放回兔笼。一兔一笼, 按照实验兔标准喂养, 允许其在笼内自由活动和进食, 饲养环境适宜。若管型脱落, 立即重新固定; 若管型过紧、远端肢体淤血肿胀等, 立即拆除管型, 待患肢情况好转后重新固定。
1.3.2 造模效果评价造模后2周和6周以空气栓塞法分别处死A组和B组实验兔。以前上方入路分别解剖右侧制动膝关节和左侧对照膝关节, 观察膝关节有无感染、溃烂等情况, 剔除周围肌肉和韧带等附属组织, 暴露股骨和胫骨平台关节软骨、半月板。大体观察股骨内外侧髁关节软骨情况, 并取股骨内侧髁后部关节软骨, 以10%甲醛固定48 h, 再脱水、包埋, 切片后HE染色观察关节软骨退变情况。
1.3.3 造模并发症评价造模前记录实验兔体质量, 每天观察实验兔肢端血液循环、近端皮肤磨损、姿势、制动管型脱落和咬除等情况。每周测量一次体质量。若出现感染, 可使用抗生素治疗。
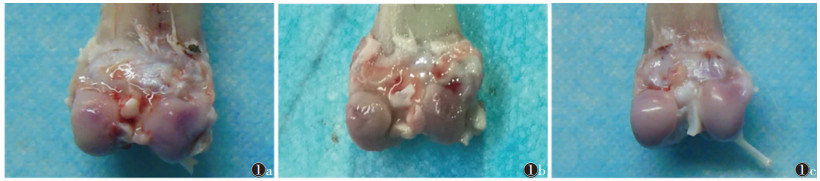
1.4 统计学方法采用SPSS 18.0软件进行统计分析。计量资料以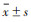
A组造模前和处死前体质量分别为(1 932±91)、(1 623±213)g, 差异有统计学意义(P < 0.05)。B组造模前和处死前体质量分别为(2 087±177)、(1 851±393)g, 差异有统计学意义(P < 0.05)。
2.2 骨关节炎造模效果实验兔右膝关节姿势固定满意、制动效果良好, 未出现制动管型被咬除、脱落情况, 可自由移位和进食进水。
大体病理所见股骨软骨受损部位稳定, 位于股骨内外侧髁后部, 股骨内侧髁软骨病变中心距离内侧骨缘5~7 mm。A组右膝关节见关节囊增厚并关节滑膜充血, 关节腔积液增多, 股骨内外侧髁后部关节软骨色泽暗淡不均且发红, 表面光整(图 1a); HE染色见软骨表面局部不规则浅裂隙形成, 软骨细胞数量减少、局部成簇增生、结构紊乱, 基质染色变浅, 潮线完整(图 2a)。B组右膝关节明显僵直, 关节滑膜增厚并部分填充到关节腔内, 大部分关节腔积液增多、黏稠, 少部分关节腔积液减少, 股骨内外侧髁后部关节软骨失去光泽、颜色不均、发红, 较2周时更明显, 表面不光整, 可见不同程度斑片状关节软骨缺损, 部分可见软骨下骨暴露(图 1b); HE染色见软骨表面不完整, 大量溃疡形成, 大部分深达软骨钙化层, 软骨4层结构显示不清, 软骨细胞显著减少且形态、大小不同程度改变, 部分标本表层、移行层细胞稀疏, 部分潮线消失(图 2b)。对照侧关节软骨透亮, 色泽均匀, 表面光整(图 1c); HE染色软骨细胞未见明显改变, 细胞呈圆形, 散在分布, 潮线完整, 基质染色正常(图 2c)。
 |
| 图 1 不同制动时间股骨髁关节软骨大体病理图 图 1a 制动2周时,股骨内外侧髁后部关节软骨色泽暗淡不均且发红,表面光整 图 1b 制动6周时,股骨内外侧髁后部关节软骨表面不光整、不同程度软骨缺损和软骨下骨暴露 图 1c 正常对照,关节软骨透亮,色泽均匀,表面光整 |
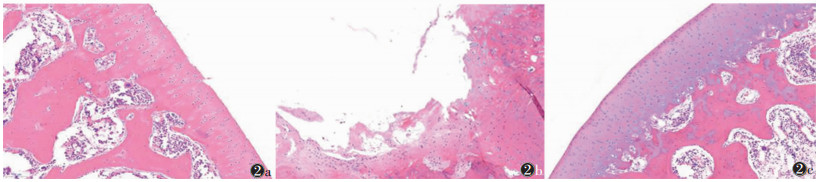 |
| 图 2 不同制动时间股骨髁关节软骨HE染色图(×100) 图 2a 制动2周时,软骨表面局部不规则浅裂隙形成,软骨细胞数量减少并局部增生、基质染色变浅,潮线完整 图 2b 制动6周,软骨大量溃疡形成,深达软骨钙化层,软骨4层结构显示不清,软骨细胞显著减少且形态、大小不同程度改变,潮线消失 图 2c 正常对照,软骨细胞未见明显改变,潮线完整,基质染色正常 |
2.3 并发症
造模过程中, 3只实验兔死亡, A组1只, B组2只, 3只均出现明显消瘦和持续腹泻。所有造模动物均未出现严重淤血所致制动管型拆除、开放性骨折和明显感染、破溃, 未出现制动管型脱落、咬除和近端严重皮肤磨损等现象。
3 讨论OA动物模型的造模方式主要包括手术法、自发OA模型、非手术法[3]。其中手术是目前最常用的造模方式[4], 包括关节腔内手术(交叉韧带切断法[5]、半月板切除法[6]、关节软骨划痕法[7]等)、关节腔外手术(臀肌切断法[8]、卵巢切除法[9]、下肢静脉结扎法[10]等)。手术法方法可靠、造模时间短, 但对生理结构破坏较大, 不利于模拟慢性OA病理过程和进行药物治疗相关研究。自发OA模型是通过筛选具有自发OA倾向的实验动物(Hartley豚鼠、B6C3F1栗鼠等[11-13])或通过基因敲除诱导小鼠自发OA[14]。其优点是可充分模拟OA的病理改变、模型病理生理稳定, 对疗效评估等研究也有优势, 但造模时间长、成本高。非手术方法包括制动法、关节撞击法、关节腔内注射药物法等[15-16]。其中关节制动法既可模拟OA的病理改变, 又能避免手术和药物注射对关节腔内环境的破坏, 在药物筛选和疗效评估方面具有一定优势。
本实验采用的伸直位制动法主要原理是通过关节制动限制关节的主被动活动, 使跨越关节的肌肉和关节囊收缩、关节面压力持续增高, 造成关节软骨变性、坏死和关节软骨下骨骨质增生[17]。但也具有以下缺陷:①因石膏管型过于宽松或动物啃咬破坏, 管型脱落的发生率较高, 需反复固定, 导致造模工作繁重、模型稳定性欠佳、实验耗材多。②制动法造模相关并发症较多, 主要包括远端肢体血运障碍、动物一般情况差等[18-19], 造模成功率较低并增加了实验成本。③大部分文献[6, 15, 18-19]报道, 制动法造模造模时间较长, 需4~6周才可达到早期OA的效果, 中期OA效果需7~10周, 明显长于手术法的造模时间。针对以上问题, 很多学者对伸直制动法进行了改良。熊勇等[20]使用伊丽莎白圈防止石膏被啃咬并在左下肢内侧安置小铝板, 固定牢靠、成功率高, 但自制伊丽莎白圈因实验动物消瘦而变得过大或过松, 影响效果, 同时伊丽莎白圈会干扰实验兔自由活动和进食, 增加局部皮损风险。
本实验对经典伸直制动法进行了以下改良:①采用医用高分子固定绷带。相较于传统医用石膏, 医用高分子固定绷带具有良好的抗啃咬性能。4层及以上高分子固定绷带可有效减少石膏咬脱, 但6层及以上高分子固定绷带会增加拆除难度和损伤风险。因此, 采用4层高分子固定绷带, 既能有效制动、防止啃咬脱落, 又可方便拆除, 可行性较高。②采用"L"型管型。与传统直型管型不同, "L"型管型可通过踝关节处的自然弯曲和骨性突起, 有效限制管型向下移动和滑脱, 极大地降低了脱落概率。③使用压舌板共同制动。右下肢内侧增加压舌板作为姿势固定和制动组件, 确保膝关节处于伸直位, 避免了不同操作者和不同位置关节软骨对实验效果可能造成的影响。④无需麻醉, 通过人工按压即可完成造模, 避免了麻醉对实验兔的损伤。
通过以上改良, 既保持了伸直位制动的优势, 又克服了部分缺陷:①改良伸直制动法模拟OA的病理改变, 缩短了造模所需时间, 制动2周即可观察到轻度关节软骨退变, 第6周退变程度可达中晚期OA的程度, 提示仅需控制制动时间, 就可模拟不同程度的关节软骨退变, 满足各种实验的需求。②伸直制动法造模效果可靠, 成功率高。本实验所有造模侧实验标本均出现不同程度的软骨退变, A、B组内部关节退变程度基本保持稳定, 如A组受累区域关节软骨肉眼下以颜色改变为主, 均未见明显缺损、HE染色观察软骨退变主要累及浅层, 潮线均完整; B组受累区域关节软骨可见不同程度缺损, HE染色可见深大溃疡形成、均累及钙化层、软骨4层结构显示不清, 潮线大部分或全部消失, 退变位置相对固定, 未出现因制动管型脱落、咬除或严重淤血、破溃而需重新固定的情况。③制动法在保证造模效果的同时, 避免了手术和药物对关节腔内结构的破坏, 同时制动装置未使用金属, 对影像学研究的开展十分有利。
本实验造模过程中3只动物死亡, 原因可能为:运输过程的高温环境和变换饲养环境使部分实验兔适应性喂养阶段就出现腹泻及进食、活动较差; 造模过程对实验兔造成了惊吓、损伤等; 制动后, 实验兔主动活动、进食、饮水受到干扰, 足趾末端血运障碍等并发症对其造成一定影响。
综上所述, 改良伸直制动法是一种简单易行、成功率高、实验过程灵活可控的OA造模方法, 尤其在药物筛选、疗效评估、影像评估等方面具有较大优势。
| [1] |
Lotz M, Martel-Pelletier J, Christiansen C, et al. Republished:Value of biomarkers in osteoarthritis:current status and perspectives[J]. Postgrad Med J, 2014, 90: 171-178. |
| [2] |
陆艳红, 石晓兵. 膝骨关节炎国内外流行病学研究现状及进展[J]. 中国中医骨伤科杂志, 2012, 20(6): 81-84. |
| [3] |
曾俊华, 马笃军, 彭力平, 等. 实验兔膝骨关节炎模型的建立及鉴定[J]. 中国临床研究, 2016, 29(5): 679-682. |
| [4] |
张荣凯, 叶志强, 陈琰, 等. 早期骨关节炎软骨下骨趋化因子信号通路的表达[J]. 中国组织工程研究, 2013, 17(11): 1925-1930. |
| [5] |
Roman-Blas JA, Mediero A, Tardío L, et al. The combined therapy with chondroitin sulfate plus glucosamine sulfate or chondroitin sulfate plus glucosamine hydrochloride does not improve joint damage in an experimental model of knee osteoarthritis in rabbits[J]. Eur J Pharmacol, 2017, 794: 8-14. |
| [6] |
李忠, 杨柳, 戴刚, 等. 关节镜下半月板部分切除制备骨关节炎动物模型[J]. 第三军医大学学报, 2007, 29(10): 919-921. |
| [7] |
Fischenich K, Pauly H, Button K, et al. A study of acute and chronic tissue changes in surgical and traumatically-induced experimental models of knee joint injury using magnetic resonance imaging and micro-computed tomography[J]. Osteoarthritis Cartilage, 2017, 25: 561-569. |
| [8] |
白希壮, 任继尧. 选择性臀肌切断诱发骨关节炎实验模型[J]. 中华骨科杂志, 1994, 14(2): 118-120. |
| [9] |
王文胜, 陈伟, 沈堡垒, 等. 上、下坡跑台训练膝骨关节炎模型大鼠关节软骨及炎症因子的变化[J]. 中国组织工程研究, 2016, 20(2): 197-201. |
| [10] |
戴七一, 覃学流, 袁经阳, 等. 兔骨内高压型膝关节骨性关节炎模型的建立[J]. 中国组织工程研究与临床康复, 2011, 15(20): 3645-3648. |
| [11] |
Griffin TM, Huebner JL, Kraus VB, et al. Induction of osteoarth ritis and metabolic inflammation by a very high-fat diet in mi ce:effects of short-term exercise[J]. Arthritis Rheum, 2012, 64: 443-453. |
| [12] |
Muraoka T, Hagino H, Okano T, et al. Role of subchondral bone in osteoarthritis development:a comparative study of two strains of guinea pigs with and without spontaneously occurring osteo arthritis[J]. Arthritis Rheum, 2007, 56: 3366-3374. |
| [13] |
马驯.软骨下骨在Hartley豚鼠自发性骨性关节炎的发生与发展中属性变化的基础研究[D].沈阳: 中国医科大学, 2018.
|
| [14] |
曹斌, 李彦林, 李晓林, 等. 骨关节炎的转基因动物模型[J]. 中国组织工程研究与临床康复, 2011, 15(7): 1269-1272. |
| [15] |
Okazaki R, Sakai A, Ootsuyama A, et al. Apoptosis and p53 ex pression in chondrocytes relate to degeneration in articular ca rtilage of immobilized knee joints[J]. J Rheumatol, 2003, 30: 559-566. |
| [16] |
侯进, 梅颖洁, 代月黎, 等. 兔骨性关节炎模型关节软骨的弥散张量研究[J]. 中国比较医学杂志, 2014, 24(1): 1-4. |
| [17] |
吴权, 李启运, 王素英, 等. 活血、温经、补益肝肾类中药对膝骨关节炎兔关节软骨形态的影响[J]. 中医正骨, 2014, 26(6): 15-18. |
| [18] |
陈达, 彭力平, 廖州伟, 等. 木瓜蛋白酶与石膏制动建立兔膝骨关节炎模型的比较[J]. 广东医学, 2017, 38(14): 2114-2118. |
| [19] |
吴强, 郑倩华, 蒋一璐, 等. 膝骨性关节炎动物模型选择与制备的比较[J]. 中国比较医学杂志, 2019, 29(5): 125-130. |
| [20] |
熊勇.艾灸对膝骨性关节炎的防治作用及其机理的实验研究[D].武汉: 湖北中医药大学, 2010.
|
 2020, Vol. 18
2020, Vol. 18


