| 韦氏肉芽肿病的CT表现分析 |
韦氏肉芽肿病是一种特殊类型的坏死性肉芽肿性血管炎,为少见的全身性疾病,主要累及呼吸道、肾脏及皮肤等,其临床及影像学表现缺乏特异性,常误诊为其他疾病而延误诊治。早期诊断并治疗,可取得显著疗效。回顾性分析我院2001年1月至2012年12月经CT引导下穿刺病理活检证实为韦氏肉芽肿病29例的影像学表现,以提高对该病的认识。
1 资料与方法 1.1 一般资料29例中,男16例,女13例;年龄19~69岁,平均(49.72±10.76)岁。所有患者均有不同程度的发热、咳嗽、咳痰及肾功能不全。
1.2 仪器与方法29例均行胸部CT扫描,10例行鼻窦CT扫描,1例行腹部CT扫描。采用Siemens Somatom Definition双源CT机。扫描参数:120 kV,采用自动化管电流调节模式,层厚5 mm,重建层厚1.0 mm。纵隔窗:窗位40 HU,窗宽300 HU。肺窗:窗位-450~500 HU,窗宽1 450~1 500 HU。所有数据均传输至GE Station工作站进行图像后处理。
2 结果 2.1 胸部CT表现29例中28例胸部影像表现异常,1例胸部未见异常征象。20例以两肺多发结节灶为主,主要分布在胸膜下,下肺病灶数目多于上肺,直径<1.0 cm的结节多边缘清楚,可有分叶,与胸膜分界尚清;≥1.0 cm的结节边缘不规则,部分有长短不等毛刺样改变,并与邻近胸膜相连,部分病灶边缘可见云絮样高密度区,以及局部空洞形成(图 1)。5例呈孤立性结节或肿块(图 2),其中2例出现不规则厚壁空洞(图 3),无液-气平面。3例出现多发斑片状实变(图 4,5),其病灶分布亦无明显规律性,部分病灶内可见支气管充气影。合并支气管扩张1例,液气胸1例,心包积液2例。1例胸部CT未见明显异常改变,后经鼻窦穿刺活检证实为肉芽肿病变。
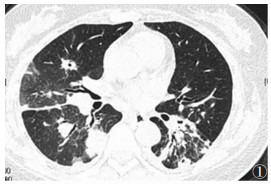 |
| 图 1 女,48岁,两肺多发大小不等结节灶,边缘可有长短毛刺样改变,部分病灶中心可见小空洞影 |
 |
| 图 2 男,33岁,左肺下叶胸膜处一边界清晰球形病灶 |
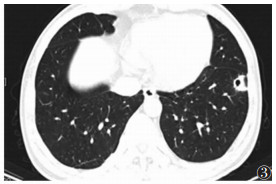 |
| 图 3 男,36岁,左肺上叶一边界清晰结节病灶,其内可见空洞,洞壁边缘光整 |
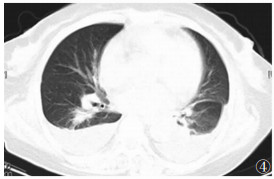 |
| 图 4 女,38岁,两下肺片状影并双侧胸腔积液 |
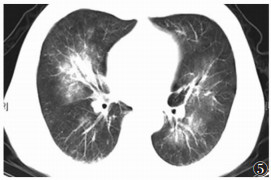 |
| 图 5 男,36岁,两肺弥漫性对称性片状渗出改变 |
29例中,4例出现弥漫性肺泡出血性磨玻璃样表现。其中1例未及时治疗致病灶迅速进展(图 6a,6b)。1例因对激素免疫治疗不敏感,经1周激素治疗后病变显著加重,合并气胸(图 7a,7b)。
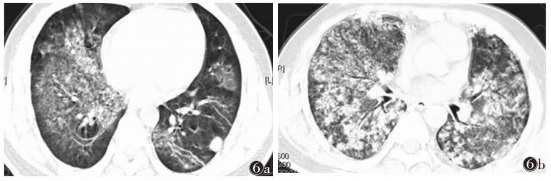 |
| 图 6 男,36岁 图 6a 两肺野弥漫性磨玻璃样变,局部融合,并左下肺孤立性结节影 图 6b 未及时治疗,1个月后两肺野病变区明显增多、增大 |
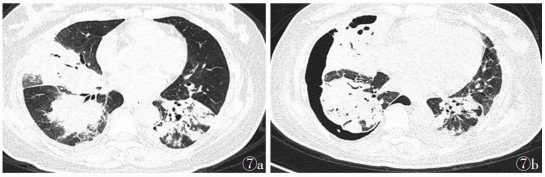 |
| 图 7 女,47岁 图 7a 两肺多发片状及结节样软组织密度影 图 7b 激素治疗1周后两肺病变范围增大,病变区密度明显增高并右侧气胸形成 |
2.2 鼻窦CT表现
6例双侧鼻窦黏膜不同程度增厚,其中2例筛窦和部分上颌窦内侧壁骨质缺如,并窦壁骨质密度异常增高;1例合并上颌窦囊肿;1例合并上颌窦霉菌感染(图 8)。5例同时伴两肺弥漫性斑片高密度表现。
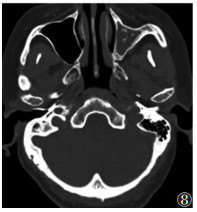 |
| 图 8 女,38岁,左侧上颌窦炎症,可见多发片状高密度影 |
3 讨论 3.1 病理表现
韦氏肉芽肿病是一种少见的血管性系统性炎症性疾病,病因不明。1982年Davies等首先在韦氏肉芽肿体内发现抗酸中性粒细胞胞浆抗体(ANCA)。1985年VAN DER WOUDE等[1]发现ANCA与活动性韦氏肉芽肿有高度相关,具有较高的敏感度和特异度。其病理改变主要为坏死性肉芽肿及血管炎:坏死性肉芽肿病变主要由炎性细胞组成,病灶常发生坏死,并可形成空洞,也可表现为片状地图样嗜碱性凝固性坏死,内有大量坏死细胞核碎片及触解性坏死形成囊腔,坏死周围有大量炎性细胞浸润;血管炎主要位于坏死灶周围,以白细胞碎裂性血管炎多见,表现为血管腔内及周围大量中性粒白细胞浸润,管腔可狭窄或闭塞。
3.2 临床表现韦氏肉芽肿病常累及呼吸道和肾脏等多系统,其中约72%的韦氏肉芽肿病累及肾脏[2-7];通常将无肾病者称为局限性韦氏肉芽肿病,其余则为全身性韦氏肉芽肿病。韦氏肉芽肿病的临床表现和发病率变异很大,与累及的器官、复发次数和严重程度、细胞毒药物治疗的不良反应有关。最常累及的组织按受累频率依次为上呼吸道、肺、肾、皮肤、眼和眼眶、耳、关节及淋巴结。本组29例中28例两肺均不同程度异常改变;29例均表现为不同程度的肾脏功能不全,但早期肾脏影像学表现无明显变化,晚期可出现萎缩。
韦氏肉芽肿病可发生于任何年龄,好发于30~50岁男性,本组平均年龄(49.72±10.76)岁。病情可为急性或慢性,常以上呼吸道黏膜局限性肉芽肿性炎发病,进展至肺的坏死性肉芽肿性血管炎和肾小球肾炎。早期明确诊断、积极治疗可阻止其向全身发展。因此,临床及影像医师应提高对该病的认识,避免误漏诊,延误治疗时机。
3.3 影像学表现韦氏肉芽肿病的影像表现具有多样性,45%的患者以肺部病变为首发症状,87%的患者累及肺,其次是鼻咽部,尤其在病变早期,肺部表现较明显。本组29例中受累最多、表现最多的器官是肺28例(96.6%),肺部韦氏肉芽肿病具有多发性、多形性、多变性,即“三多性”特性[8]:①多发性,指肺内弥漫性多处病变,本组23例(79.3%)。②多形性,指病变形态多样,呈结节、实变、空洞及条索影,本组20例(69.0%)以两肺多发结节病灶为主,同时合并斑片及条索样等病灶,部分结节可见空洞形成,结节病灶多分布于近胸膜处,亦可见部分结节沿支气管走行方向分布;有的结节周边由于出血或感染可导致模糊,呈磨玻璃样改变,称为晕征,15%的韦氏肉芽肿病由于肺实质出血或感染而出现此征象[11]。空洞的形成提示坏死性结节,渗出、实变、间质性病变提示合并炎症、出血。病程较长者可出现纤维化[9-10]。③多变性,指在病程中病变大小、形态发生变化,病灶可表现为此消彼起,结节影转变为空洞结节影,或空洞影消失。本组2例对治疗不敏感病变进展迅速,短时间内由早期弥漫性云絮状渗出改变,进展至两肺呈弥漫性结节及斑片状高密度混合表现。慢性韦氏肉芽肿病的影像特点是病变多发、散在,多种征象并存,对诊断有一定帮助。
另外,鼻咽部韦氏肉芽肿病首先侵及鼻部中线区,累及鼻中隔及鼻甲,对称性延伸至双侧上颌窦,然后再向其他鼻窦生长,最终导致上颌窦壁、筛窦间隔、纸样板和筛板破坏消失而形成大空腔。本组6例出现不同程度的鼻窦炎,2例鼻中隔及双侧上颌窦内侧壁、筛板骨质缺损,符合鼻部韦氏肉芽肿病特征。在韦氏肉芽肿病中,心脏损害较罕见,尸检报告中不到1/3出现心脏损害,主要包括心包炎、心包积液、心肌缺血等[12]。本组2例合并心包积液,占6.9%。
3.4 鉴别诊断肺部韦氏肉芽肿病需与以下肺部疾病进行鉴别:①肺癌。肺部韦氏肉芽肿病结节较少出现深分叶征和毛刺征;空洞壁多较薄,边缘规则,可形成环形空洞,其内可见结节,无壁结节。增强扫描空洞壁强化较肺癌显著,空洞周围可见小结节状卫星灶,结节和空洞可缩小或消失,但常复发,或一处吸收,其他部位又出现病灶[13]。此外,韦氏肉芽肿病一般无纵隔和肺门淋巴结肿大。②肺结核。其与肺部韦氏肉芽肿病均表现为多种病灶形态,存在于肺内多个部位。但韦氏肉芽肿病无肺结核分布的特点,其多发病灶密度一致,一般无钙化,其空洞壁更薄,无结核病的支气管播散灶,抗结核治疗无好转,激素治疗病灶吸收较快。③肺炎和/或肺脓肿。肺部韦氏肉芽肿病可呈片状、浸润状病灶,似一般肺炎改变;常表现为坏死或空洞,似肺脓肿;但其空洞壁较薄。韦氏肉芽肿病肺部病灶常有游走性改变,而普通肺炎和肺脓肿无此特征性变化[14-15]。
综上所述,韦氏肉芽肿病影像征象复杂多样。当肺部病灶出现渗出实变、空洞时需与肺炎、肺脓肿鉴别,仅靠CT或平片表现鉴别有一定困难,如临床大剂量抗生素治疗无效,或同时合并鼻窦、眼、耳、肾脏等多发脏器的症状时应考虑本病的可能,活检和临床、实验室检查有助于该病的诊断。
| [1] |
LANGFORD C A, HOFFMAN G S. RARE diseases. 3:Wegener's grnaulomatosis[J]. Thorax, 1999, 54(7): 629-637. DOI:10.1136/thx.54.7.629 |
| [2] |
LAMPRECHT P, GROSS W L. Wegener's granulomatosis[J]. Herz, 2004, 29(1): 47-56. DOI:10.1007/s00059-004-2525-0 |
| [3] |
LOEHRL T A, SMITH T L. Inflammatory and granulomatous lesions of the larynx and pharynx[J]. Am J Med, 2001, 111(8): 113-117. DOI:10.1016/S0002-9343(01)00856-7 |
| [4] |
FRAZIER A A, ROSADO-DE-CHRISTENSON M L, GALVIN J R, et al. Pulmonary angiitis and granulomatosis:radiologic-pathologic correlation[J]. Radiographics, 1998, 18(3): 687-710, 727. DOI:10.1148/radiographics.18.3.9599392 |
| [5] |
SHIN M S, YOUNG K R, HO K J. Wegener's granulomatosis upper respiratory tract and pulmonary radiographic manifestations in 30 cases with pathogenetic consideration[J]. Clin Imaging, 1998, 22(2): 99-104. |
| [6] |
MARTINEZ F, CHUNG J H, DIGUMARTHY S R, et al. Common and uncommon manifestations of Wegener granulomatosis at chest CT:radiologic-pathologic correlation[J]. Radiographics, 2012, 32(1): 51-69. DOI:10.1148/rg.321115060 |
| [7] |
朱天照, 王仪生. 肺Wegener肉芽肿的HRCT表现[J]. 中国医学影像技术, 2004, 20(6): 870-872. |
| [8] |
常瑞萍, 卢占兴, 余为民, 等. 韦格氏肉芽肿的影像学表现及临床分析[J]. 实用诊断与治疗杂志, 2006, 20(10): 749-750. |
| [9] |
李铁一. 胸部肉芽肿病变影像诊断[J]. 中华放射学杂志, 1999, 33(6): 366-367. |
| [10] |
丁朝鹏, 杨志昌, 刘素娥, 等. 肺部韦格肉芽肿的影像学诊断:附5例报告[J]. 实用放射学杂志, 1999, 15(6): 375-376. |
| [11] |
LEE K S, KIM T S, FUJIMOTO K, et al. Thoracic manifestation of Wegener's granulomatosis:CT findings in 30 patients[J]. Eur Radiol, 2003, 13(1): 43-51. |
| [12] |
YI E S, COLBY T V. Wegener's granulomatosis[J]. Semin Diagn Pathol, 2001, 18(1): 34-46. |
| [13] |
赵永碧, 殷泽富. 肺部局限性韦格氏肉芽肿的CT诊断[J]. 中华放射学杂志, 2001, 35(6): 442-444. |
| [14] |
戴冽, 郑东辉, 韩智娟. 韦格氏肉芽肿病致蚕蚀性角膜溃疡并坏死性巩膜炎一例[J]. 中华风湿杂志, 2003, 7(3): 132-133. |
| [15] |
YANG C, TALBOT J M, HWANG P H, et al. Bony abnormalitied of the paranasal sinuses in patients with Wegener's cranulo matosis[J]. Am J Rhinol, 2001, 15(2): 121-125. DOI:10.2500/105065801781543763 |
 2020, Vol. 18
2020, Vol. 18


