| 经胸超声心动图在左冠状动脉异常起源于肺动脉的诊断及随访中的应用 |
左冠状动脉异常起源于肺动脉(anomalous left coronary artery from the pulmonary artery,ALCAPA),又称Bland-White-Garland综合征,是一种罕见的先天性心脏病,其发病率在活产新生儿中约占1/30万[1-2]。ALCAPA根据心肌侧支循环的发育程度分为婴儿型与成人型,其中年幼发病者仅少数能存活至成年[3]。ALCAPA的临床表现无特征性,明确诊断需依赖影像学检查。经胸超声心动图(transthoracic echocardiography,TTE)可明确异常起源的解剖及功能信息,是ALCAPA的首选筛查方法。本文通过分析18例ALCAPA患儿的临床资料,探讨TTE对ALCAPA的应用价值,报道如下。
1 资料与方法 1.1 一般资料收集我院2013年1月至2019年4月经手术证实的ALCAPA患儿18例,其中男11例,女7例;年龄6 d~13岁。18例中,婴儿型8例,男5例,女3例,平均(8.2±2.4)个月;成人型10例,男6例,女4例,平均(92.5±6.7)个月。婴儿型平均年龄小于成人型(P<0.05),两型男女构成比差异无统计学意义(P > 0.05)。
1.2 仪器与方法18例术前均行TTE检查。采用Philips iE33超声诊断仪,经胸探头频率2~8 MHz,常规行多切面扫查。明确冠状动脉起源及左心室壁肌层内的侧支循环发育程度,观察室壁运动,胸骨旁长轴切面测量主动脉瓣环内径。二尖瓣反流程度按反流面积与左房面积比分为4级:无返流、轻度返流(<20%)、中度返流(20%~40%)和重度返流(> 40%)[4]。测量左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD),并计算左心室射血分数(left ventricular ejection fraction,LVEF)。
1.3 统计学方法采用SPSS 20.0软件分析数据,连续型变量及分类变量以x±s及%表示,行t检验或方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 手术结果18例均经手术证实,10例行左冠状动脉移植术,5例行Takeuchi术,3例行冠状动脉搭桥术。术后患儿均好转出院,随访6个月。
2.2 TTE结果TTE准确诊断14例(77.8%),其中婴儿型6例(图 1),成人型8例(图 2)。TTE示左冠状动脉主干或分支开口于肺动脉壁,舒张期见连续性血流逆流入肺动脉,左室扩大,二尖瓣及瓣下腱索增厚、纤维化、脱垂。婴儿型超声示左心明显扩大,LVEF明显降低,其中1例合并室壁瘤,右冠状动脉内径为(2.9±0.2)mm,左、右冠状动脉间血流信号稀疏;成人型超声示左右冠状动脉间可见丰富侧支血流信号,右冠状动脉内径为(4.5±0.3)mm。两型内径比较,差异有统计学意义(P<0.05)。
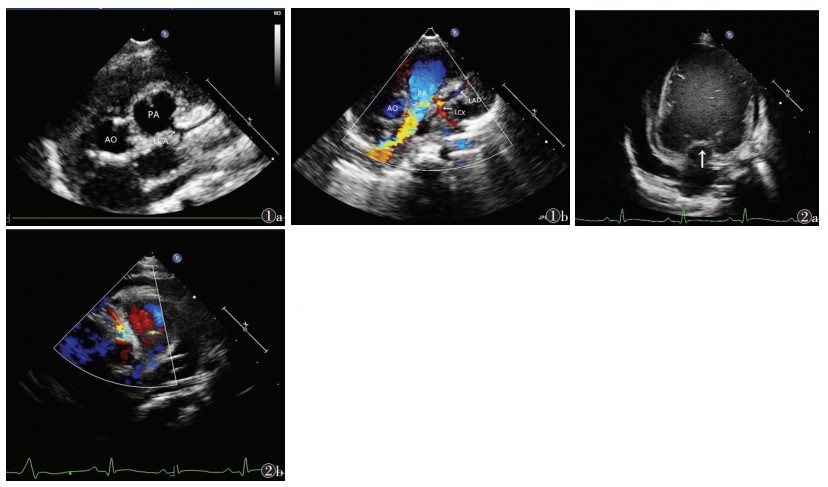 |
| 图 1 男,23 d,婴儿型左冠状动脉异常起源于肺动脉(ALCAPA) 图 1a 二维超声示左冠状动脉开口于肺动脉侧壁 图 1b 彩色多普勒超声示舒张期左前降支及左回旋支血流逆流入肺动脉内 图 2 女,4个月,成人型ALCAPA 图 2a 二维超声示左心扩大、二尖瓣增厚粘连、纤维化(箭头) 图 2b 彩色多普勒超声示右冠状动脉扩张,血流丰富(注:AO,主动脉;PA,肺动脉;LAD,左前降支;LCX,左回旋支;RCA,右冠状动脉) |
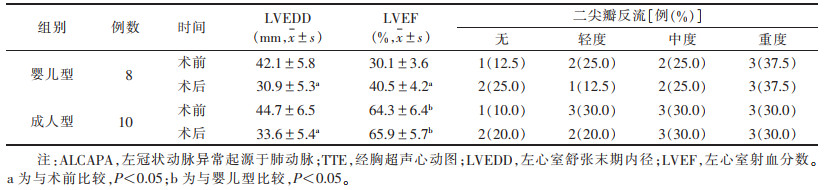
与婴儿型相比,术前成人型LVEF较高(P<0.05);术后6个月婴儿型的LVEF较术前明显升高,但仍低于成人型(均P<0.05)。两型LVEDD均较术前明显缩小(均P<0.05),但术后两型间差异无统计学意义(P > 0.05)。两型术前及术后二尖瓣反流情况差异均无统计学意义(均P > 0.05)(表 1)。
| 表 1 两型ALCAPA术前及术后TTE主要指标比较 |
 |
TTE误诊3例,误诊率为16.7%,其中2例婴儿型误诊为心内膜弹力纤维增生症,1例成人型误诊为冠状动脉-肺动脉瘘;TTE漏诊1例成人型,漏诊率为5.5%。
3 讨论冠状动脉异常起源于肺动脉属于先天性畸形,其中ALCAPA约占90%以上,可累及冠状动脉整个血管或某段分支[5-6],多为单发,约5%的患儿可并发其他畸形,其病理基础大致如下[7-10]:婴儿型因左冠状动脉接受低饱和度的静脉血灌注,出生后2~3周随着肺动脉压力的降低,冠状动脉灌注压逐渐降低,由于无可代偿的侧支循环,患儿出生后多数出现左心室功能下降等症状;成人型因存在可代偿的侧支循环,即左冠状动脉供血的心肌细胞可通过右冠状动脉在心肌内建立的侧支供血存活,并满足正常功能,因此成人型的左心功能常强于婴儿型[11]。由于心肌损伤程度及预后取决于肺血管阻力的维持和冠状动脉侧支建立程度,因此一经确诊应尽快手术治疗,如治疗不及时,婴儿型多在生后几周至几个月内死亡,90%的患儿生存期不足1年[9]。
心导管造影、CT或MRI检查可在术前对ALCAPA明确诊断,上述检查方法可全程显示冠状动脉起源、走行及有无扩张或狭窄,也可清晰显示侧支血管的建立程度[12]。但心导管造影、CT检查存在一定电离辐射,可重复性不强,且心导管造影存在影像重叠,不适用于新生儿。MRI虽然无创伤和电离辐射,但费用较高,检查禁忌证多,不适用于重症患儿。TTE无创、无电离辐射,且费用低廉,可重复操作性强,成为ALCAPA病的重要筛查方法[13-14]。本研究对2种类型ALCAPA的TTE特征总结如下:①共同特征有大动脉短轴切面显示左冠状动脉主干或其分支起源于主肺动脉,或位于其近端分支上,最常见于肺动脉根部的左后窦,左室不同程度扩大,二尖瓣及瓣下腱索增厚、纤维化、脱垂,彩色多普勒超声示舒张期连续性血流逆流,分流速度通常<2.5 m/s[15];②婴儿型ALCAPA由于严重的心肌缺血、受损,左心功能显著降低,局部或弥漫性心肌纤维化,同时累及二尖瓣乳头肌,致二尖瓣关闭不全;③成人型ALCAPA因左右冠状动脉间侧支血管较多,可在胸骨旁短轴切面探及右室前壁、左室后壁、心尖部及室间隔由后向前的侧支血流,二尖瓣亦可伴关闭不全。
ALCAPA需与以下疾病鉴别:①婴儿型ALCAPA应与扩张型心肌病、心肌致密化不全或心内膜弹力纤维增生症鉴别。本组2例误诊为心内膜弹力纤维增生症,原因是未认真扫查冠状动脉起源及是否存在侧支循环。②成人型ALCAPA应与川崎病、大动脉炎等所致冠状动脉扩张、冠状动脉-肺动脉瘘及单纯二尖瓣脱垂鉴别。本组误诊2例,1例为冠状动脉-肺动脉瘘,原因是未考虑到冠状动脉起源及血流方向,以及心肌内有无广泛交通血流;另1例为单纯二尖瓣脱垂,原因主要为婴幼儿患者冠状动脉细小、走行迂曲,加之胸骨旁大动脉短轴的大界面回声失落效应,操作医师经验不足未仔细观察左冠状动脉起源。此外,任何限制左冠状动脉至肺动脉血流逆灌的机制均有益于侧支循环的建立,如动脉导管未闭及主肺动脉窗等,应注意鉴别。
综上所述,早期诊断、尽快手术是改善ALCAPA预后的关键。TTE在ALCAPA的诊断、手术方案制订、预后评估及随访观察中起着非常关键的作用。
| [1] |
BOUTSIKOU M, SHORE D, LI W, et al. Anomalous left coronary artery from the pulmonary artery (ALCAPA) diagnosed in adulthood:varied clinical presentation, therapeutic approach and outcome[J]. Int J Cardiol, 2018, 261(7): 49-53. |
| [2] |
梅贤, 李奋, 傅立军, 等. 儿童左冠状动脉异常起源于肺动脉91例临床分析[J]. 中华儿科杂志, 2019, 57(8): 614-619. |
| [3] |
陈君君, 吴道珠, 王亮, 等. 左冠状动脉异常起源于肺动脉的超声心动图表现分析[J]. 中国超声医学杂志, 2018, 34(8): 755-757. DOI:10.3969/j.issn.1002-0101.2018.08.027 |
| [4] |
洪雯静, 吴兰平, 张玉奇, 等. 不同年龄儿童左冠状动脉异常起源于肺动脉的超声心动图比较[J]. 医学影像学杂志, 2016, 26(3): 413-417. |
| [5] |
WALSH R, NIELSEN J C, KO H H, et al. Imaging congenital coronary artery anomalies[J]. Pediatr Radiol, 2011, 41(12): 1526-1535. |
| [6] |
LANGE R, CLEUZIOU J, KRANE M, et al. Long-term outcome after anomalous left coronary artery from the pulmonary artery repair:a 40-year single-centre experience[J]. Eur J Cardiothorac Surg, 2018, 53(4): 732-739. DOI:10.1093/ejcts/ezx407 |
| [7] |
WEIGAND JD, GOWDA S, LORBER R, et al. Echocardiographic diagnosis of left main coronary artery atresia[J]. World J Pediatr Congenit Heart Surg, 2017, 8(1): 101-102. DOI:10.1177/2150135116664702 |
| [8] |
PATEL S G, FROMMELT M A, FROMMELT P C, et al. Echocardiographic diagnosis, surgical treatment, andoutcomes of anomalous left coronary arter from the pulmonary artery[J]. J Am Soc Echocardiogr, 2017, 30(9): 896-903. |
| [9] |
齐红霞, 孙境, 李慧, 等. 超声心动图在左冠状动脉异常起源于肺动脉诊断中的临床应用价值及术后随访研究[J]. 中国循环杂志, 2019, 34(2): 165-170. |
| [10] |
张海波. 左冠状动脉异常起源于肺动脉的外科治疗[J]. 临床小儿外科杂志, 2016, 15(3): 214-216. |
| [11] |
CHIGURUPATI K, GADHINGLAJKAR S, SREEDHAR R, et al. Anomalous origin of the left coronary artery from the pulmonary artery in an infant and adult:intraoperative echocardiographic comparison[J]. J Cardiothorac Vasc Anesth, 2016, 30(5): 13531357. |
| [12] |
李慧, 孟红, 张昌伟, 等. 左冠状动脉异常起源于肺动脉的超声心动图诊断及随访[J]. 中华超声影像学杂志, 2016, 25(10): 840843. |
| [13] |
王淑玲, 郑春华, 任军, 等. 超声心动图诊断左冠状动脉起源异常于肺动脉1例[J]. 中国医学影像学杂志, 2016, 24(1): 24-25. |
| [14] |
杨呈伟, 刘廷亮, 李欣, 等. 冠状动脉起源于肺动脉的影像学评价[J]. 心肺血管病杂志, 2019, 38(5): 522-528. |
| [15] |
CABRERA AG, CHEN DW, PIGNATELLI RH, et al. Outcomes of anomalous left coronary artery from pulmonary artery repair:beyond normal function[J]. Ann Thorac Surg, 2015, 99(4): 1342-1347. |
 2021, Vol. 19
2021, Vol. 19


