| 兔坐骨神经挤压伤模型的超声弹性成像研究 |
2. 山东第一医科大学附属省立医院手足外科,山东 济南 250021
外周神经损伤是临床常见病之一,常引起相应肢体的功能障碍,重者导致残疾。常规超声可显示神经的走行、连续性、内部结构及其周围的解剖关系,但无法准确评估神经的硬度[1-2]。剪切波弹性成像(shear wave elastography,SWE)作为一种新的超声技术,可定量评价外周神经的硬度,目前其临床研究多集中于外周神经卡压,如腕管综合征。已有研究[3-4]证实,随着正中神经卡压程度的增加,神经硬度越来越高。但对外周神经挤压伤后的神经硬度评价报道较少[5]。本研究对兔坐骨神经挤压伤模型行SWE,并与常规超声进行观察对比,探讨SWE对兔坐骨神经挤压伤的诊断价值。
1 材料与方法 1.1 实验动物选择新西兰兔40只[许可证号:SCXK(鲁)20180006,购于济南金丰实验动物有限公司],饲养于山东第一医科大学附属省立医院实验动物中心。参考Mckinnon方法建立兔坐骨神经挤压伤模型,用5%的戊巴比妥钠(剂量25~35 mg/kg体质量)经耳缘静脉进行麻醉,剪除手术野内(右侧臀部及右下肢)的毛并消毒,取右侧臀部斜切口,在臀大肌间隙和股二头肌间隙游离出坐骨神经,暴露长度约2.5 cm,操作前,采用利多卡因局部封闭。于坐骨结节下方约1.5 cm处用普通外科止血钳垂直夹持神经,宽度约5 mm,夹持至第三扣并维持30 s,重复此过程以覆盖远端5 mm,造成兔坐骨神经挤压伤约10 mm,坐骨神经损伤区域为半透明状但未离断(图 1)。术后每天肌内注射头孢唑啉钠2次,持续1周。40只兔坐骨神经损伤模型按1、2、4及8周分为A、B、C、D组各10只。将40只兔左侧正常的坐骨神经作为对照组,与右侧坐骨神经损伤各组对比观察。本实验方案经山东省医学影像学研究所医学伦理学委员会审核通过。40只实验兔均行双侧坐骨神经的常规超声检查和SWE检查。
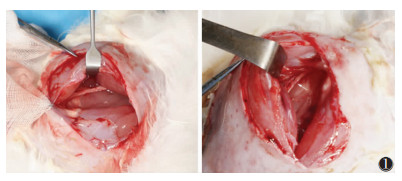 |
| 图 1 解剖暴露兔坐骨神经并制作挤压伤模型,箭头所指为坐骨神经挤压伤处 |
1.2 仪器与方法 1.2.1 常规超声检查
采用Philips EPIQ 7超声诊断仪,线阵探头频率5~18 MHz及5~12 MHz,选用浅表肌肉骨骼模式。测量右侧坐骨神经损伤区及左侧相应位置正常坐骨神经的内径,观察其连续性和内部回声,所有数值均测量3次,取平均值。
1.2.2 SWE检查采用Philips EPIQ 7弹性成像模式,探头频率5~12 MHz。获得右侧坐骨神经损伤区清晰长轴图像,将损伤区置于图像中央,采用穿透模式,并在框中实时显示颜色编码的SWE图。SWE图稳定3~5 s后,冻结图像进行测量。为减少其他因素的影响,采用弹性模量比值对坐骨神经进行评价。将ROI分别放置在坐骨神经损伤区及近心侧约1 cm处坐骨神经内,自动显示ROI内2个弹性模量的比值,测量3次取平均值,每次测量间隔时间≥5 s。坐骨神经内的ROI固定为1 mm。
1.2.3 病理观察每组常规超声及SWE检查结束后选5只处死并行病理学组织观察,观察每组坐骨神经损伤区的病理学改变。
1.3 统计学分析使用SPSS 22.0软件进行统计分析。连续变量以x±s表示。绘制坐骨神经损伤区弹性模量比值时间曲线。兔坐骨神经内径及弹性模量比较行配对t检验。以P<0.05为差异有统计学意义。
2 结果对照组正常坐骨神经连续性完整,内径(1.15± 0.06)mm,表现为均衡的线状低回声(图 2)。右侧坐骨神经挤压伤模型坐骨神经开始明显增粗,约在2周时达峰值,后逐渐恢复正常。坐骨神经厚度从A组(1.26±0.11)mm逐渐增加至B组(1.74±0.10)mm,并从C组(1.28±0.13)mm恢复至D组(1.17±0.05)mm。其中A与B,B与C及C与D组之间神经内径比较,差异均有统计学意义(均P<0.05)。A、B组坐骨神经损伤区增粗,内部回声不均匀,损伤区坐骨神经外膜和周围组织分界不清(图 3)。D组坐骨神经内径恢复良好,与对照组内径差异无统计学意义(P>0.05)。
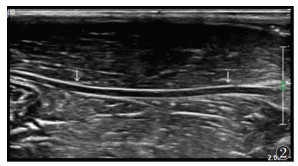 |
| 图 2 正常兔坐骨神经声像图表现,箭头所指为兔坐骨神经 |
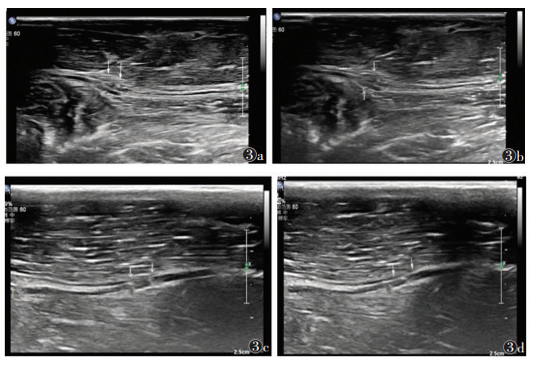 |
| 图 3 兔坐骨神经挤压伤模型声像图 图 3a~3d 箭头所指为A、B、C及D组兔坐骨神经挤压伤处 |
在4组坐骨神经损伤模型中,随时间延长,神经硬度逐渐增加,其中A、B、C、D组弹性模量比值分别为1.40±0.06,1.95±0.10,2.30±0.12,2.69±0.13,弹性模量比值时间曲线见图 4。
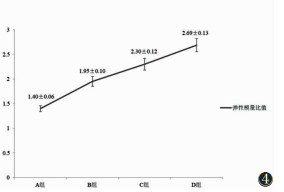 |
| 图 4 兔坐骨神经挤压伤模型弹性模量比值时间曲线 |
兔坐骨神经挤压伤后病理切片示,A组损伤区表现为神经纤维排列紊乱,轴突肿胀,同时伴炎性细胞浸润。B、C组坐骨神经可见空泡化,在间质组织内可见丰富的毛细血管,施万细胞增生明显。D组损伤区可见再生的轴突及神经纤维形成(图 5)。
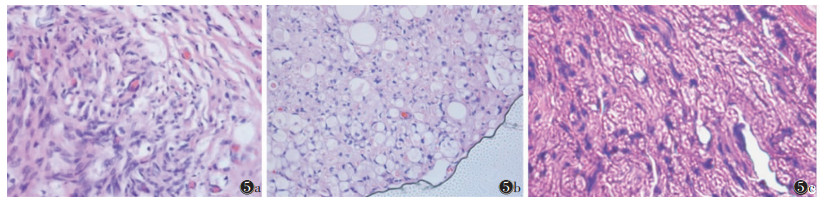 |
| 图 5 坐骨神经挤压伤处病理图片(HE×400) 图 5a A组显示神经纤维紊乱,内可见炎细胞浸润 图 5b B组及C组,神经内可见空泡化,间质内可见毛细血管显示 图 5c D组显示空泡化减少,轴突及神经纤维再生明显 |
3 讨论
在外周神经挤压伤中,常规超声检查可提示创伤早期神经水肿,表现为外周神经增粗、回声减弱、束膜结构显示欠清晰;随时间延长,损伤的外周神经内径逐渐恢复正常。常规超声虽能提示神经的形态学变化信息[6-7],但无法进一步显示其病理变化过程,如神经损伤过程中的空泡化及间质增生等。临床医师迫切需要一种新的影像技术,能准确反映神经修复过程中的变化并定量评价。
SWE可反映周围神经挤压伤的相关信息,有学者[8]对放疗乳腺癌患者的患侧臂丛神经和健侧臂丛神经进行SWE研究,发现患侧臂丛神经硬度高于健侧。臂丛神经僵硬度的增加可能与纤维化过程有关。另有文献[9]报道,腕管综合征患者正中神经硬度变化在形态学改变之前已增加,因此,SWE比常规超声检查可更早发现外周神经的卡压。本研究表明,神经挤压伤后神经僵硬度逐渐增加。病理切片示在挤压后第2、4和8周的胶原蛋白面积百分比显著增加,这也导致了神经僵硬度的增加。另外,神经挤压伤会引起束膜内水肿,神经局部缺血、缺氧的压力增加,从而诱导胶原蛋白在细胞外基质中的沉积,导致神经的僵硬度进一步增大[10]。
虽然MRI也可评价外周神经的挤压伤,但其扫描时间长,无法任意切面成像,如对神经内纤维束传导进行评估,需行DTI,且对机器设备及图像后处理要求较高,技术难度大,这也限制了其临床应用。相比MRI等其他影像学检查,超声具有方便快捷、无创、低廉等优点[11-12]。本研究采用弹性模量比值进行评价,进一步降低了弹性成像中的误差,提高了准确率,可定量评价神经的僵硬度,间接反映神经挤压伤后的病理改变。
本研究也存在一定的局限性:超声检查对操作者的依赖性较大;未将SWE与其他影像学检查方法(如DTI等)进行对比分析。
总之,常规超声结合弹性成像可全面、定量地评估坐骨神经的形态变化及力学性能等,这可能对周围神经挤压伤的修复及康复治疗具有重要意义。
| [1] |
DY C J, AUNINS B, BROGAN D M. Barriers to epineural scarring:Role in treatment of traumatic nerve injury and chronic compressive neuropathy[J]. J Hand Surg Am, 2018, 43(4): 360367. |
| [2] |
VAHED L K, ARIANPUR A, GHAREDAGHI M, et al. Ultrasound as a diagnostic tool in the investigation of patients with carpal tunnel syndrome[J]. Eur J Transl Myol, 2018, 28(2): 7380. |
| [3] |
TALJANOVIC M S, GIMBER L H, BECKER G W, et al. Shearwave elastography:Basic physics and musculoskeletal applications[J]. Radiographics, 2017, 37(3): 855-870. DOI:10.1148/rg.2017160116 |
| [4] |
BURULDAY V, DOGAN A, SAHAN M H, et al. Ultrasound elastography of the median nerve in patients with acromegaly:A case-control study[J]. J Ultrasound Med, 2018, 37(10): 23712377. |
| [5] |
WEN J, WANG Y, JIANG W, et al. Quantitative evaluation of denervated muscle atrophy with shear wave ultrasound elastography and a comparison with the histopathologic parameters in an animal model[J]. Ultrasound Med Biol, 2018, 44(2): 458-466. |
| [6] |
CINGOZ M, KANDEMIRLI S G, ALIS D C, et al. Evaluation of median nerve by shear wave elastography and diffusion tensor imaging in carpal tunnel syndrome[J]. Eur J Radiol, 2018, 101(1): 59-64. |
| [7] |
刘慧, 陈定章, 朱永胜, 等. 兔坐骨神经慢性卡压的高频超声与病理学观察[J]. 中国医学影像技术, 2009, 25(4): 555-558. |
| [8] |
KULTUR T, OKUMUS M, INAL M, et al. Evaluation of the brachial plexus with shear wave elastography after radiotherapy for breast cancer[J]. J Ultrasound Med, 2018, 37(8): 20292035. |
| [9] |
MOTOMIYA M, FUNAKOSHI T, ISHIZAKA K, et al. Blood flow changes in subsynovial connective tissue on contrast-enhanced ultrasonography in patients with carpal tunnel syndrome before and after surgical decompression[J]. J Ultrasound Med, 2018, 37(7): 1597-1604. DOI:10.1002/jum.14500 |
| [10] |
ZHU Y Q, ZHUANG J, LUO Y K, et al. Evaluation of the crushed sciatic nerve and denervated muscle with multimodality ultrasound techniques:an animal study[J]. Ultrasound Med Biol, 2020, 46(2): 377-392. |
| [11] |
王铁铮, 亓恒涛, 徐磊, 等. 外周神经内血管畸形的超声诊断价值探讨[J]. 中华超声影像学杂志, 2019, 28(8): 709-712. |
| [12] |
KLAUSER A S, BUZZEGOLI T, TALJANOVIC M S, et al. Nerve entrapment syndromes at the wrist and elbow by sonography[J]. Semin Musculoskelet Radiol, 2018, 22(3): 344-353. DOI:10.1055/s-0038-1641577 |
 2020, Vol. 18
2020, Vol. 18


