| IVIM-DWI对TACE序贯氩氦刀治疗肝癌疗效的评估价值 |
肝癌是临床上常见的消化道恶性肿瘤,发现时多为中晚期而失去外科手术机会。TACE为无法外科手术切除肝癌患者的首选治疗方法,其疗效已得到公认[1]。介入在内的综合治疗是肝癌的发展趋势,TACE联合氩氦刀冷冻消融治疗中晚期肝癌是有效的综合治疗方法之一[2-3]。本研究尝试使用基于体素内不相干运动弥散功能成像(intravoxel incoherent motion-diffusion weighted imaging,IVIM-DWI),即双指数模型DWI对TACE序贯氩氦刀治疗肝癌的疗效评估价值进行探讨。
1 资料与方法 1.1 研究对象随机选取2016年1月至2017年12月我院收治的40例肝癌患者,均为男性;年龄37~67岁,平均(55.0±9.2)岁。纳入标准:①符合中国抗癌协会肝癌专业委员会制定的肝癌诊断标准[4];②均经病理活检或影像学检查及血清甲胎蛋白(AFP)检测等明确诊断;③肝内肿瘤数目≤5个;④肝功能Child A级或B级,使用Karnofsky行为状态评分标准(Kar- nofsky performance status,KPS)[5],KPS评分均≥60分。排除标准:①肝功能Child C级或D级;②原发性肝癌已确诊远处脏器转移者;③术后未复查DWI者;④脱访或随访时间少于6个月者。其中原发性肝细胞癌38例,胆管细胞癌2例;3例为原发性肝癌外科根治性术后复发,其他37例均未行外科手术治疗。肝内结节单发33例,多发7例;肝功能Child A级25例,Child B级15例;合并肝门区或腹膜后淋巴结转移4例,均无门脉癌栓形成。
1.2 治疗方法40例行影像学检查及血清AFP检测后,先接受TACE、术后4周内序贯氩氦刀冷冻消融治疗。①TACE:根据术前CT增强扫描显示的肿瘤病灶(图 1a),使用5F-RH导管联合2.4F微导管行超选择腹腔干及肠系膜上动脉造影,造影证实后均使用奥沙利铂0.1 g、氟尿嘧啶1.0 g联合灌注化疗[6-7],根据肿瘤大小注入超液化碘化油5~15 mL乳剂栓塞肿瘤供血血管,栓塞至对比剂停留2个心动周期时停止(图 1b)。TACE术后1~2周复查MRI平扫+IVIM-DWI检查,通过MRI确定活性病灶[8-10],针对活性区域于TACE术后4周内行氩氦刀冷冻消融术(图 1c)。②氩氦刀冷冻消融术:根据术前MRI显示肿瘤的大小、形态、位置及活性区域,制订CT引导下冷冻方案。在CT引导下逐个穿刺点使用氩氦刀穿刺针进入肝内病灶,给予氩气(纯度99.999%)冷冻消融15 min(压力3 500 kPa),CT扫描检测冷冻范围,氦气(纯度99.999%)复温3 min(压力2 500 kPa),重复1次。拔针,压迫止血并包扎。术后行CT平扫复查,确保冰球完全覆盖肿瘤活性部分边缘范围大于1 cm(图 1d)[8]。
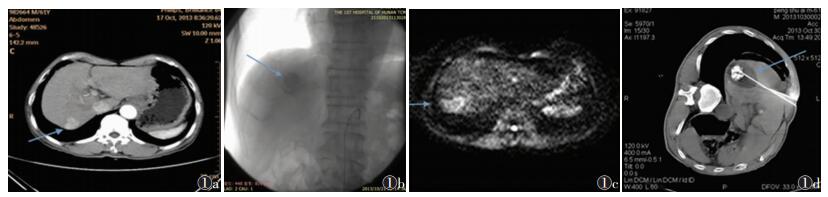 |
| 图 1 男,61岁,原发性肝癌 图 1a CT增强扫描动脉期示右肝SⅦ段直径约2.3 cm结节,动脉期明显强化(箭头) 图 1b TACE术后显示肝癌病灶碘油沉积(箭头) 图 1c DWI示病灶呈高信号,提示肿瘤有活性(箭头) 图 1d 活性病灶行CT引导下氩氦刀冷冻消融术(箭头) |
1.3 MRI检查方法 1.3.1 扫描方法
采用GE Signa HD 3.0 T MRI仪与腹部专用表面线圈。采用呼吸门控防止运动伪影。先行上腹部平扫,再行多b值DWI及动态增强扫描。传统单指数模型DWI,b值取0和1 000 s/mm2,矩阵80×128,NEX 4;IVIM-DWI的多b值(b=0、50、100、200、400、800、1 000 s/mm2)DWI,矩阵96×130,TR 9 000 ms,TE最小值,层厚4 mm,层距1 mm。动态增强扫描:横轴位LAVA技术,层厚5 mm。蒙片扫描结束后注射对比剂莫迪斯,流率2 mL/s,剂量0.2 mL/kg体质量,17 s后开始连续2次增强扫描(动脉早期、动脉晚期),50 s后扫门脉期,5 min后扫延迟期,50 min后再次扫延迟期。
1.3.2 图像后处理扫描结束后将原始图像数据传至AW4.6工作站,应用Functool软件中的ADC软件对DWI图像进行后处理,在治疗术后DWI高、低信号区标记ROI。以MRI动态增强扫描图像为参考,在显示病灶最清楚的相应b值的DWI图像上手动放置病灶ROI。ROI会在相应解剖层面,以相同位置同步复制到standard ADC值伪彩参数图或Slow ADC值、Fast ADC值及f值伪彩参数图上,并自动得到单指数模型DWI检查的ADC值,及IVIM-DWI检查的Slow ADC值、Fast ADC值及f值(图 2)。
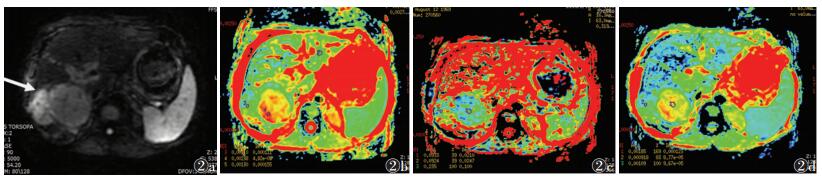 |
| 图 2 男,47岁,TACE联合氩氦刀冷冻消融术后4周 图 2a DWI示2个可疑残留病灶(箭头) 图 2b b=800 s/mm2时后处理测量ADC值 图 2c 体素内不相干运动(IVIM)-DWI测量Fast ADC值 图 2d IVIM-DWI测量Slow ADC值 |
1.4 CT扫描方法
采用Philips 64排128层brilliance CT对肝脏行3期扫描。使用对比剂碘海醇(剂量1.8 mL/kg体质量)经高压注射器团注扫描,流率3.0 mL/s。层厚、层距均为5 mm,25~27 s扫动脉期,65 s扫门脉期,5 min扫延迟期。扫描结束后将原始图像数据传至EBW工作站行三维重建。治疗术后平扫无碘油沉积区为重点观察区,在显示病灶强化最明显的区域手动放置病灶ROI,测量动脉期CT值,复制同样大小ROI至平扫期相同位置,测量CT值,相减得出CT净增值(图 3)。
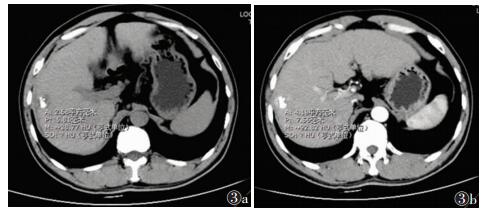 |
| 图 3 男,46岁,TACE术后行CT增强扫描 图 3a 平扫可见碘油沉积部分缺损,CT值38.77 HU 图 3b 增强扫描可见碘油沉积缺损区外缘明显强化,CT值92.82 HU,得出CT净增值为54.05 HU |
1.5 评价指标
临床判断标准:DWI检查后行经皮穿刺活检术,行免疫组化检查明确病灶性质;连续2次以上的影像学检查,持续随访6个月以上观察病灶;病灶变化:进展为残留灶,无变化为坏死灶,新增病灶并持续进展为新发灶[9]。
CT增强扫描病灶活性区域界定标准[10]:与术前对比,选择术前可疑活性区域,测量病灶平扫、增强扫描CT值及CT净增值。增强扫描表现为典型“快进快出”特征或CT值增加40 HU以上考虑有活性,小于10 HU考虑病灶无活性,10~40 HU无法判断,由3位副高以上职称专家单独阅片判读有无活性。
DWI界定标准[11]:在后处理工作站观察DWI图像,并与术前原发癌灶对比,观察信号特点,测量原发癌灶氩氦冷冻区域或新发病灶的ADC、Slow ADC、f值及Fast ADC值,用以判断肝癌氩氦刀冷冻术后的坏死灶、残留灶或新发灶。若病灶信号均匀、ADC值高于周围肝实质或绝对值>1.5×10-3 mm2/s,考虑坏死,诊断为坏死灶;若有常规扫描信号可疑区域,该处ADC值< 1.0×10-3 mm2/s,则判断病灶仍有活性部分,诊断为残留灶;术后出现的新发病灶,且ADC值< 1.0×10-3 mm2/s,诊断为新发灶;ADC值为(1.0~1.5)×10-3 mm2/s,需结合临床综合诊断,由3位副高以上职称专家单独阅片判读。IVIM模型以b值增高至1 000 s/mm2时病灶仍呈高信号判断为残留灶;病灶与周围组织等信号判断为坏死灶;随访中新增病灶且为高信号判断为新发灶。
1.6 统计学方法采用SPSS 17.0分析软件进行数据分析。定量资料以x±s表示。肝癌治疗后残留灶、坏死灶、新发灶间ADC值、Slow ADC值、Fast ADC值及f值的比较采用单因素方差分析;ADC值与Slow ADC值比较、ADC值与f值比较采用配对t检验。以P < 0.05为差异有统计学意义。ADC值、Slow ADC值、CT净增值对活性病灶评估的敏感度及特异度采用诊断实验的ROC曲线分析。
2 结果 2.1 一般情况TACE序贯氩氦刀冷冻治疗40例,原发病灶46个;术后1个月CT及MRI共发现病灶46个;术后4个月CT及MRI共发现病灶54个。不同影像学检查对病灶性质判断能力见图 4。
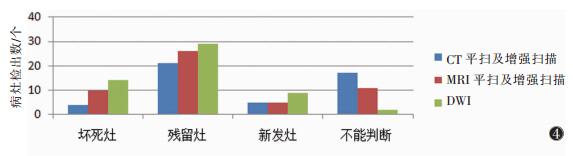 |
| 图 4 不同影像学检查对肝癌治疗后病灶检出柱形图(单位:个) |
术后4个月CT平扫加增强扫描共发现病灶47个,MRI平扫加增强扫描共发现病灶52个。CT平扫加增强扫描与MRI平扫加增强扫描在肝癌TACE序贯氩氦刀治疗后病灶数目检出方面差异无统计学意义(P=0.076)。
将影像学检查所见病灶性质分为可判断(坏死灶+残留灶+新发灶)与无法判断2组。CT平扫加增强扫描发现47个病灶,其中性质可判断30个,无法判断17个;IVIM-DWI发现病灶54个,其中性质可判断52个,无法判断2个。经检验不符合方差齐性,采用非参数Kruskal-Wallis检验,IVIM-DWI与CT平扫加增强扫描在判断病灶性质方面差异有统计学意义(P=0.000)。
2.2 各组间单指数模型DWI及IVIM-DWI各参数比较 2.2.1TACE序贯氩氦刀冷冻消融治疗后肝癌活性残留灶、坏死灶、新发灶的4项参数,均符合正态分布且符合方差齐性。单因素方差分析结果显示,3组间ADC值、Slow ADC值、f值差异均具有统计学意义(均P < 0.05),Fast ADC值差异均无统计学意义(均P < 0.0)(表 1)。
| 表 1 治疗后不同病灶各参数均值及单因素方差分析(x±s) |
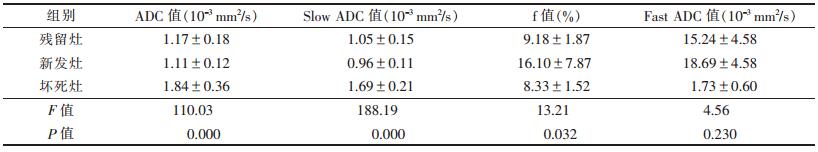 |
2.2.2
3组间进一步两两比较,新发灶与残留灶的Slow ADC值、ADC值差异无统计学意义(均P>0.05),坏死灶与残留灶及新发灶的ADC及Slow ADC间比较差异均有统计学意义(均P < 0.01)(表 2)。
| 表 2 肝癌治疗后不同病灶各参数两两比较结果 |
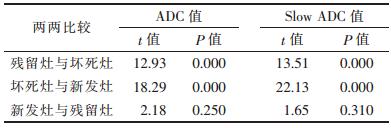 |
2.3 IVIM-DWI与单指数模型DWI及CT净增值诊断敏感度、特异度比较
临床以病理学检查或6个月以上随诊及连续2次以上影像学检查为标准确定病灶有无活性,分别将活性病灶(残留灶及新发灶)与无活性病灶(坏死灶)的ADC值及Slow ADC与临床标准为对比,绘制ROC曲线(表 3)。结果显示,IVIM-DWI的Slow ADC值测定在敏感度、特异度上均高于单指数模型DWI的ADC值及CT净增值测定。
| 表 3 ADC值与Slow ADC值ROC曲线下面积、敏感度、特异度及界值 |
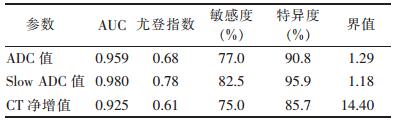 |
3 讨论 3.1 肝癌治疗后疗效评估
肝癌治疗后疗效评估方法主要有3种:生存分析法、血清AFP监测和影像学检查。生存分析需大样本、长期间随访,不适合介入术后短期个体化评估。血清AFP是评估肝癌活性的重要指标之一,但AFP短期波动性大,阳性率低,特异度不高,35%的肝细胞癌患者AFP检测呈假阴性(包括肝内胆管癌、低分化肝细胞癌、部分高分化肝细胞癌或肝细胞癌已坏死液化者),仅靠单纯AFP检测不能有效诊断[12]。影像学检查因简单易行、图像直观,广泛应用于肝癌介入治疗后疗效评估。
MRI能有效、清晰、直观地反映病灶特征,已成为肝癌介入术后常规检查方法,并已成为共识[13-16]。本研究也证实,IVIM-DWI的Slow ADC值测定在敏感度、特异度上均高于单指数模型DWI的ADC值及CT增强扫描中CT净增值。DWI作为一种功能性成像技术,无需注射对比剂,可在分子水平对生物体的组织结构及功能状态进行无创检查,在鉴别坏死与活性肿瘤组织上具有明显优势[17]。
3.2 IVIM-DWI扫描技术及呼吸门控技术本研究中,为了尽量忽略血流、微循环等对弥散产生的影响,在多b值DWI中,采用7个b值(0、50、100、200、400、800、1 000 s/mm2),b=1 000 s/mm2时图像质量仍较清晰(图 4),与报道[7, 18]推荐使用8个b值(0、25、50、75、100、200、500、800 s/mm2)有一定差异,分析与本研究MRI扫描加用呼吸门控技术有关。
3.3 IVIM-DWI的局限性① 本研究已经证实,IVIM- DWI在肝癌治疗后活性病灶评估中具有较高的特异度,但单纯使用IVIM-DWI会遗漏直径 < 0.5 cm病灶,使用DSA可证实病灶。②部分病灶在消融术后1个月内信号不稳定,判断病灶活性存在困难。③各研究中心采用的IVIM-DWI参数及后处理软件有差距,得出的界定良恶性病灶的ADC值或Slow ADC值也存在一定差距[18-20]。因此,在具体临床实践中需总结经验,结合多种影像学检查及血清AFP检测等。
总之,IVIM-DWI所得到的参数能对肝癌氩氦刀冷冻消融术后残留灶、坏死灶及新发灶进行有效评估。且IVIM-DWI扫描技术评估肝癌TACE序贯氩氦刀治疗的疗效价值,明显优于单指数模型DWI及CT增强扫描,对肝癌的临床治疗及预后判断具有重要意义,可指导临床后续治疗方案的制订,值得推广应用。
| [1] |
国家卫生计生委办公厅.原发性肝癌诊疗规范(2017年版)[S/OL]. 2017-06-02.http://www.moh.gov.cn/yzygj/s7659/201706/80abf02a86c048fcb130e5e298f7aeee.shtml.
|
| [2] |
程瑞文, 邓梨平, 李平, 等. TACE联合氩氦刀冷冻消融术治疗原发性肝癌后血小板变化观察[J]. 中国中西医结合影像学杂志, 2016, 14(2): 206-208. DOI:10.3969/j.issn.1672-0512.2016.02.028 |
| [3] |
庄炜钊, 黄晨, 姬智艳, 等. TACE联合氩氦刀冷冻消融治疗中晚期肝癌的疗效分析[J]. 医学影像学杂志, 2016, 26(12): 2247-2250. |
| [4] |
中国抗癌协会肝癌专业委员会, 中华医学会肝病学分会肝癌学组, 中国抗癌协会病理专业委员会, 等. 原发性肝癌规范化病理诊断指南(2015版)[J]. 临床与实验病理学杂志, 2015, 31(3): 241-246. |
| [5] |
孙燕. 内科肿瘤学[M]. 北京: 人民卫生出版社, 2001: 648-649.
|
| [6] |
石明, 陈继安, 林小军, 等. 肝动脉栓塞化疗不同化疗方案治疗不可切除肝癌的前瞻性随机对照研究[J]. 中国肿瘤临床, 2009, 36(1): 9-13. DOI:10.3969/j.issn.1000-8179.2009.01.003 |
| [7] |
Woo S, Lee JM, Yoon JH, et al. Intravoxel incoherent motion di ffusion-weighted MR imaging of hepatocellular carcinoma:correl ation with enhancement degree and histologic Grade[J]. Radiol ogy, 2014, 270: 758-767. DOI:10.1148/radiol.13130444 |
| [8] |
叶伟东, 纪建松, 涂建飞, 等. 氩氦刀冷冻消融联合肝动脉栓塞化疗术治疗中晚期肝癌的疗效分析[J]. 介入放射学杂志, 2015, 24(5): 392-395. DOI:10.3969/j.issn.1008-794X.2015.05.007 |
| [9] |
庄广义, 任伟新, 迪里木拉提·巴吾冬, 等. 原发性肝癌TACE术后CT和DSA随访对比分析[J]. 介入放射学杂志, 2009, 18(12): 942-945. DOI:10.3969/j.issn.1008-794X.2009.12.018 |
| [10] |
罗泽. 多层螺旋CT增强扫描对肝脏占位性病变的诊断价值[J]. 临床医学, 2018, 38(8): 56-58. |
| [11] |
Yu JS, Kim JH, Chung JJ, et al. Added value of diffusion-weig hted imaging in the MRI assessment of perilesional tumor re currence after chemoembolization of hepatocellular carcinomas[J]. J MagnReson Imaging, 2009, 30: 153-160. |
| [12] |
蒋智, 张建淮, 屠道远. 肝癌肿瘤标志物的研究进展[J]. 中国临床研究, 2018, 31(2): 270-273. |
| [13] |
肖安岭, 王海涛, 张芃芃, 等. 磁共振动态增强联合弥散加权成像对原发性肝癌的诊断及其临床价值研究[J]. 临床和实验医学杂志, 2018, 17(14): 1526-1529. DOI:10.3969/j.issn.1671-4695.2018.14.019 |
| [14] |
林静, 张贤龙, 游建, 等. 磁共振成像对肝细胞癌患者经导管动脉化疗栓塞联合射频消融的疗效及预后评估价值[J]. 肝脏, 2018, 23(6): 522-524. DOI:10.3969/j.issn.1008-1704.2018.06.021 |
| [15] |
宋达. 磁共振功能成像对肝癌介入术后评估的进展[J]. 影像研究与医学应用, 2018, 2(12): 45-46. DOI:10.3969/j.issn.2096-3807.2018.12.025 |
| [16] |
侯毅斌, 王忠富, 施裕新, 等. 磁共振弥散加权成像联合动态增强在评估肝癌TACE术后病灶残留及随访中的应用价值[J]. 中国CT和MRI杂志, 2018, 16(1): 108-110. DOI:10.3969/j.issn.1672-5131.2018.01.033 |
| [17] |
朱正, 赵心明, 周纯武, 等. 体素内不相干运动扩散加权成像在肝癌介入治疗预后中的价值[J]. 肿瘤影像学, 2018, 27(2): 82-87. DOI:10.3969/j.issn.1008-617X.2018.02.004 |
| [18] |
王倩倩, 刘新疆. IVIM-DWI在肝脏局灶性病变中的应用进展[J]. 磁共振成像, 2018, 9(4): 312-315. |
| [19] |
丁士申. 磁共振扩散加权成像对肝癌的诊断及鉴别诊断作用[J]. 影像研究与医学应用, 2018, 2(8): 89-90. DOI:10.3969/j.issn.2096-3807.2018.08.052 |
| [20] |
凌公豪, 范晨虹, 龙清云, 等. 体素内不相干运动扩散加权成像定量参数在肝脏良恶性病变诊断中的价值[J]. 临床放射学杂志, 2018, 37(3): 536-540. |
 2019, Vol. 17
2019, Vol. 17


