| 超声造影联合影像融合导航技术在特殊部位小肝癌微波消融治疗中的价值 |
1b. 广东省广州市第八人民医院普外科,广东广州510060;
2. 广东省广州市第一人民医院放射科,广东 广州 510180;
3. 广东省人民医院检验科,广东 广州 510060
肝癌是常见的恶性肿瘤,恶性程度高,进展快。临床消融治疗技术在其治疗中发挥重要作用,肝癌消融技术,特别是微波消融术治疗小肝癌的临床疗效与手术相当,且更安全[1]。一些小肝癌生长位置特殊,如长在肝包膜下、肝门区或靠近大血管、胆囊和膈肌等位置,超声定位较困难,易漏诊,无法行超声引导下治疗;还有一些病灶与周围肝实质回声差异小,且周围实质回声杂乱,超声检查病灶显示困难,易漏诊。超声造影(contrast enhanced ultrasound,CEUS)联合影像融合导航技术集中了超声扫查实时性、CEUS高敏感性、CT/MRI视野广的优势,有助于解决上述难题。本研究应用该技术对特殊部位的小肝癌行微波消融治疗,探讨其安全性、可行性及临床应用价值。
1 资料与方法 1.1 一般资料选择2015年12月至2017年11月在广州市第八人民医院诊断为肝癌,并自愿接受消融治疗的患者30例。纳入标准:①均经CT或MRI引导穿刺活检病理证实为肝癌;②病灶位于特殊部位(肝包膜下、肝门区、大血管、胆囊、右肝近膈顶附近),病灶在CT或MRI图像上显示清晰;③使用影像融合技术辅助后,CEUS能清晰显示病灶;④无手术禁忌证;⑤患者知情同意且自愿接受CEUS联合影像融合导航辅助微波消融治疗。30例(38个特殊部位小肝癌病灶)中,男24例,女6例;年龄32~64岁,平均(51.8±15.2)岁。所有患者一般情况良好,无微波消融禁忌证,Karnofsky(卡氏)评分标准≥60分;肝功能Child-Pugh分级:A级8例,B级22例;有肝硬化背景20例;血清AFP 11.62~684.59 μg/L,平均386.75 μg/L,其中AFP升高22例。病灶长径0.8~2.9 cm,平均(1.63±0.79)cm。病灶位于肝左叶9个(其中左肝近膈顶处6个,靠近第二肝门3个),肝右叶27个(其中14个位于肝包膜下,右肝近膈顶处7个,胆囊旁6个),尾状叶2个(位于包膜下)。本研究经广州市第八人民医院医学伦理委员会同意。
1.2 仪器与方法 1.2.1 仪器采用Esaote Mylab 90彩色多普勒超声仪,CA431探头;内置于超声仪内Virtual Navigator一体化工作站的实时虚拟导航系统;Philips 64排螺旋CT及GE Signa 1.5 TLX MRI仪进行检查。
1.2.2 影像融合导航定位病灶所有患者术前均行CT/MRI检查,得到薄层DICOM格式影像数据资料;应用PACS用U盘或光盘把数据资料导入虚拟导航系统,选择病灶与血管同时显示较清晰的CT/MRI时相,后在CT/MRI上标记病灶边缘;病灶定标完成后将其进行三维渲染显示;应用血管走行或轮廓将实时超声图像与CT/MRI图像进行注册与微调,实现两者之间的联动,并不断进行不同切面上对应解剖结构的影像融合验证,如有错位则进行微调;应用影像融合导航,通过CT/MRI上的病灶信息确定病灶在实时超声图像中的位置(图 1,2)。
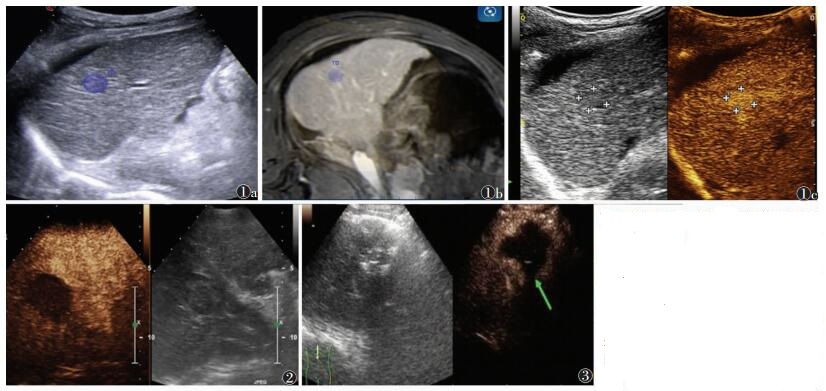 |
| 图 1 男,46岁 图 1a 超声示右肝近膈顶处小肝癌 图 1b 应用影像融合导航,通过CT/MRI上的病灶信息确定病灶在实时超声图像中的位置 图 1c 应用超声造影(CEUS)明确病灶的具体部位、范围及其与周边重要脏器的解剖位置关系 图 2 男,43岁,肝包膜下小肝癌,完全消融CEUS示“空洞征” 图 3 男,39岁,胆囊旁小肝癌,局部残留。CEUS示消融灶“空洞”边缘异常片状增强回声(箭头) |
1.2.3 CEUS明确病灶
通过虚拟导航确定病灶定位后,选择病灶显示最清晰的切面,固定该切面位置;经肘部静脉快速团注2.4 mL对比剂,后用5.0 mL生理盐水冲管,并实时观察超声图像上相应病灶部位的血流灌注变化;进一步明确病灶的具体部位、范围及其与周边重要脏器的解剖位置关系(图 3)。
1.2.4 微波消融治疗采用南京亿高ECO-100A1微波治疗仪,频率2 450 MHz,功率0~100 W。使用1%利多卡因进行皮下局部麻醉,术中加用舒芬太尼静脉镇痛。在CEUS下联合影像融合导航技术引导下定位同时显示病灶,后使用微波聚能针穿刺入病灶,使微波针针头位于病灶中心部位,设置微波仪功率40~80 W,时间15~20 min,进行微波消融。直径≤3 cm的病灶采用单针次消融策略,>3 cm的病灶采用双针重叠的消融策略[2]。消融过程中,使用超声对病灶消融情况进行实时监测,监测消融区内回声变化,消融范围达到病灶周边0.5 cm。
1.3 疗效评估及随访所有患者分别于术后30 min行CEUS,术后1个月行CT对比增强扫描或MRI检查,评定消融范围及效果,并观察术后1个月血清AFP变化。
微波消融后30 min行CEUS检查,具体步骤同上。融合影像评估以超过原来病灶周边0.5 cm范围的血流灌注情况作为消融治疗结果的评定标准,重点观察原病灶区动脉期有无强化来评价消融效果[3]。完全消融是指原目标病灶及其周边0.5 cm范围内肝组织动脉期的增强显影消失;局部残留是指原目标病灶或其周边0.5 cm范围内肝组织动脉期出现增强显影。
微波消融后1个月行CT对比增强扫描或MRI检查。以CT对比增强扫描或MRI图像上原病灶各期完全无强化,且超过原来病灶周边0.5 cm范围内无新发病灶为完全消融的诊断标准。否则为局部有残留。
2 结果30例(38个病灶)共行微波消融治疗42次,34个病灶术后30 min行CEUS,术后1个月行CT对比增强扫描或MRI检查均显示完全消融,完全消融CEUS呈“空洞征”(图 2);3个病灶术后30 min CEUS示有局部残留,局部残留CEUS呈现消融灶“空洞”边缘异常片状增强回声(图 3),立即行微波消融再次治疗,补充消融15~20 min,术后CEUS均显示完全消融,术后1个月CT对比增强扫描或MRI检查显示完全消融;1个病灶术后30 min CEUS显示消融完全,术后1个月CT对比增强扫描或MRI检查示有局部残留,再次行微波消融治疗后达到完全消融。术后随访提示AFP升高22例中,20例降至正常水平(≤25 μg/L),1例略下降(86.37 μg/L),1例略上升(58.57 μg/L)。2例因病灶位于肝尾状叶包膜下出现术后疼痛较明显,加用舒芬太尼静脉镇痛,约8 h后疼痛缓解。术后发热15例,体温均 < 39 ℃,持续2~7 d。30例微波消融治疗均未出现与治疗相关的出血等严重并发症。
3 讨论超声引导下微波消融治疗肝癌是利用2 450 MHz高频电磁波的热效应原理,将针状电极插入瘤体内将微波能量释放使局部温度达到60~100 ℃,以杀灭肿瘤细胞[4-5]。小肝癌是指体积较小的肝癌,即肝细胞癌中单个癌结节最大直径不超过3 cm或2个癌结节直径之和不超过3 cm的肝癌。近年来,微波消融术治疗肝癌发展较快,特别是小肝癌的治疗效果尤其明显[6]。临床已证实,微波消融对直径 < 3 cm的肝肿瘤一次完全消融率可达80%~90%,对直径≤3 cm的Ⅰa期小肝癌,近期临床效果优于手术,甚至可达到根治性效果[7-10]。
临床工作中常利用超声多角度、多切面实时扫查的特点,对病灶进行定位及引导穿刺治疗。但由于超声扫查视野局限,一些特殊部位小肝癌,如位于肝包膜下、肝门区或靠近大血管、胆囊和膈肌等的小肝癌,仅依靠超声切面上找到相应病灶较困难;还有一些病灶由于与周围肝组织回声差异较小,或周围组织回声杂乱,超声检查难以直观显示病灶,不能准确定位并引导穿刺及消融。影像融合技术是一种新兴的计算机处理技术,能将CT/MRI图像与超声图像融合在一起,将CT/MRI空间高分辨力、视野全面、无盲区的特点与超声实时性的特点有机结合,可用于:①根据CT/MRI图像中相应切面上病灶的位置实现精确定位;②超声与CT/MRI图像融合扫查,实时显示肝三维解剖切面;③评估病灶消融疗效、消融范围及实时监控消融全过程。应用影像融合导航技术能有效克服超声扫查的局限性,显著提高穿刺的准确率、安全性及完全消融的成功率[11-13]。CEUS是继二维超声、CDFI和多普勒之后的超声影像第三次革命。近年来,随着CEUS技术的迅猛发展,其肝内病灶的显示和诊断能力也逐步提高,肝癌消融术后的疗效评估也取得显著效果,CEUS对肿瘤消融疗效的评估准确率可达92.3%~93.2%,与CT增强扫描或MRI基本接近[14-20]。微波消融术前对特殊部位小肝癌病灶行CEUS检查,可再次明确病灶性质、部位及范围,也增强介入治疗的信心。
借助CEUS与影像融合导航技术,本研究中所有患者均成功行经皮穿刺微波消融治疗,在消融过程中超声实时监测消融区内的回声变化,术后评估疗效。本组30例(38个病灶)共行微波消融治疗42次。其中3个病灶术后30 min CEUS显示有局部残留,立即行微波消融治疗;1个病灶术后30 min CEUS显示消融完全,术后1个月CT对比增强扫描或MRI检查显示有局部残留,再次行微波消融治疗后完全消融。发生局部残留的2个为原发性肝癌,2个为转移性肝癌;2个病灶位于右肝膈顶处,2个位于肝尾叶包膜下。局部残留4个病灶均位于肝边缘,病灶与周围脏器距离较近,为防止周围脏器被损伤,术中应用PTC针穿刺到病灶与周围脏器之间,注入生理盐水形成“水墙”隔开。术前AFP升高22例中,术后随访提示20例降至正常水平,1例略下降,1例略升高。所有患者均未出现与治疗相关的严重并发症。
综上所述,CEUS联合影像融合导航技术在微波消融治疗特殊部位小肝癌中具有较高的安全性、可行性,对特殊部位小肝癌病灶准确定位、引导穿刺和监控治疗有显著效果,值得临床推广应用。
| [1] |
Chen MS, Li JQ, Zheng Y, et al. A prospective randomized trial comparing percutaneous local ablative therapy and partial hepat-ectomy for small hepatocellular carcinoma[J]. Ann Surg, 2006, 243: 321-328. DOI:10.1097/01.sla.0000201480.65519.b8 |
| [2] |
吕明德, 陈俊伟, 谢晓燕, 等. 超声引导瘤内高温治疗肝细胞癌[J]. 中华外科杂志, 2001, 39(7): 502-504. |
| [3] |
吕明德, 谢晓燕, 陈俊伟, 等. 超声引导消融治疗肝癌微波与射频的比较[J]. 中华超声影像学杂志, 2002, 1(2): 7-9. |
| [4] |
王洪武, 杨仁杰. 肿瘤微创治疗技术[M]. 北京: 北京科学技术出版社, 2007, 285-294.
|
| [5] |
梁萍, 董宝玮, 于小玲, 等. 超声引导下经皮微波凝固治疗肝癌的临床应用[J]. 中华肿瘤杂志, 1997, 19(6): 448-450. |
| [6] |
周兵, 汪正伟, 牛坚, 等. 腹腔镜与开放性肝切除术治疗小肝癌的近期疗效比较[J]. 中国普通外科杂志, 2013, 22(7): 862-866. DOI:10.7659/j.issn.1005-6947.2013.07.009 |
| [7] |
陈敏山, 李锦清, 梁惠宏, 等. 经皮射频消融与手术切除治疗小肝癌的疗效比较[J]. 中华医学杂志, 2005, 85(2): 80-83. |
| [8] |
Doi K, Beppu T, Ishiko T, et al. Laparoscopic and thoracoscopic thermal ablation for hepatocellular carcinoma[J]. J Microwave Surg, 2013, 30: 225-230. |
| [9] |
吴盂超. 原发性肝癌的诊断及治疗进展[J]. 中国医学科学院学报, 2008, 30(4): 363-365. |
| [10] |
Dong J, Li W, Zeng Q, et al. CT-guided percutaneous step-by-step radiofrequency ablation for the treatment of carcinoma in the caudate lobe[J]. Medicine, 2015, 94: 1594. DOI:10.1097/MD.0000000000001594 |
| [11] |
Iuchi H, Horiike N, Masumoto T, et al. Specially designed need-le-guide for intercostal puncture of hepatocellular carcinoma seen on computed tomography and not visualized on ultrasonography[J]. Hepatol Res, 2003, 25: 319-328. DOI:10.1016/S1386-6346(02)00278-4 |
| [12] |
Hertzberg BS, Kliewer MA, Bowie JD, et al. Physician training requirements in sonography:how many cases are needed for competence?[J]. AJR Am J Roentgenol, 2000, 174: 1221-1227. DOI:10.2214/ajr.174.5.1741221 |
| [13] |
郑荣琴, 苏中振. CT/MR-超声融合成像新技术在肝癌局部消融中的应用[J]. 实用医学杂志, 2013, 29(21): 3449-3451. |
| [14] |
Zheng SG, Xu HX, Lu MD, et al. Role of contrast-enhanced ultrasound in follow-up assessment after ablation for hepatocellular carcinoma[J]. World J Gastroenterol, 2013, 19: 855-865. DOI:10.3748/wjg.v19.i6.855 |
| [15] |
Chen MH, Yang W, Yan K, et al. The role of contrast-enhanced ultrasound in planning treatment protocols for hepatocellular carcinoma before radiofrquency ablation[J]. Clin Radiol, 2007, 62: 752-760. DOI:10.1016/j.crad.2006.12.013 |
| [16] |
Stang A, Keles H, von Seydewitz C, et al. Percutanous and intraoperative ultrasound-guided radiofrequency ablation of hepatic tumours[J]. Ultra Schall Med, 2007, 28: 181-188. DOI:10.1055/s-2006-927263 |
| [17] |
秦建民, 顾新刚, 张敏, 等. 肝脏实时超声造影在肝癌微波消融治疗中的应用[J]. 肝胆胰外科杂志, 2013, 25(1): 27-30. |
| [18] |
李劲松, 娄可新, 韩亮, 等. 超声造影引导下微波消融治疗晚期肝脏恶性肿瘤的临床观察[J]. 中国医药导报, 2016, 13(17): 82-85. |
| [19] |
李凯, 袁树芳, 郑荣琴, 等. 虚拟导航超声造影与常规超声造影定位检测肝局灶性病变的比较[J]. 中华超声影像学杂志, 2011, 20(5): 390-392. |
| [20] |
袁强, 王毅军, 经翔, 等. 微波消融治疗肝脏恶性肿瘤的临床价值[J]. 中国肿瘤临床, 2012, 39(15): 1104-1107. DOI:10.3969/j.issn.1000-8179.2012.15.027 |
 2018, Vol. 16
2018, Vol. 16


