| DWI对足月新生儿缺氧缺血性脑病预后的评估价值 |
2. 湖北省十堰市人民医院 湖北医药学院附属人民医院放射影像中心,湖北 十堰 442000;
3. 武汉大学中南医院影像科,湖北 武汉 430071
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是指围生期各种窒息因素引起的脑组织缺氧及脑血流减少,从而导致新生儿脑损伤的一种常见疾病。HIE发病率高,是造成新生儿死亡和神经发育障碍的主要原因[1]。低温治疗是HIE的主要治疗方法之一[2],但仍有约45%的患儿可能死亡或有神经发育方面的障碍[3-4]。因此,对HIE患儿的预后进行评估非常重要[5]。DWI对水分子的活动敏感,不仅在HIE的早期诊断方面有重大价值,且在其预后评估方面也有重要价值和应用前景。本研究采用贝利婴幼儿发展量表(bayley scales of infant development,BSID)[6]对HIE患儿预后情况进行分组,并结合初次DWI检查结果,探讨DWI对足月新生儿HIE预后的评估价值。
1 资料与方法 1.1 一般资料收集2014年1月至2019年1月在湖北医药学院附属人民医院诊断为HIE的足月新生儿71例,其中男32例,女39例;胎龄37~42周。在患儿8个月时采用BSID进行发育评分,并根据评分结果分为预后良好组和预后不良组。预后良好组40例,男18例,女22例;预后不良组31例,男14例,女17例。2组一般资料比较差异无统计学意义(P > 0.05)。本研究均经患儿家属同意,并经医院伦理委员会批准。
1.2 纳入及排除标准纳入标准:①足月儿,37周≤胎龄 < 42周;②符合新生儿HIE诊断标准;③入院后行常规MRI及DWI扫描。排除标准:①合并遗传性代谢性疾病;②宫内感染;③先天畸形;④低血糖、高胆红素血症及产伤性颅内出血。
1.3 仪器与方法应用GE 1.5 T超导MRI扫描仪和8通道正交头线圈行MRI扫描。扫描序列及参数:①头颅平扫序列包括T1WI、T2WI、T2 FLAIR,层厚4 mm,层距1 mm,视野200 mm×200 mm;T1WI TR 1 800 ms,TE 24 ms;T2WI TR 3 980 ms,TE 102 ms;T2 FLAIR TR 8 600 ms,TE 120 ms。②DWI采用平面回波序列(EPI),TR 6 000 ms,TE 40 ms,层厚4 mm,层距1 mm,视野200 mm×200 mm,b值取0、1 000 s/mm2。所有患儿行颅脑MRI前20~30 min给予15%水合氯醛口服或灌肠,待其熟睡后,佩戴耳塞或隔音耳机,耳外可用2层内凹海绵固定以降低运动伪影。扫描时由医师、患儿家属陪同,并密切观察患儿的心率、呼吸等状况。
1.4 图像处理DWI序列扫描结束后,图像自动传到GE 1.5 T MRI后处理工作站进行后处理。利用T1WI,将解剖图像与功能图像融合,得到可分辨解剖结构的ADC图。由3名主治及以上职称的放射科医师分别阅片,并在ADC图像上手动勾画ROI,ROI选择半卵圆中心层面、放射冠层面深部白质、尾状核、豆状核、内囊前肢、内囊后肢、内囊膝部及背侧丘脑。采用镜像的方法勾画对侧部位的ROI,大小平均(10±5)mm2。ROI均放置于所测量解剖位置的中央,尽量避开静脉窦、静脉、脑脊液。测量ROI及其对侧ROI的ADC值,每个ROI测量3次后取其平均值(双侧ADC值的平均值)。
1.5 统计学分析应用SPSS 22.0软件进行分析,计量资料以x±s表示,采用独立样本t检验比较2组的ADC值;应用ROC曲线对各ROI的诊断效能进行分析,计算AUC、敏感度、特异度及约登指数,确定预测HIE预后最敏感解剖部位。以P < 0.05为差异有统计学意义。
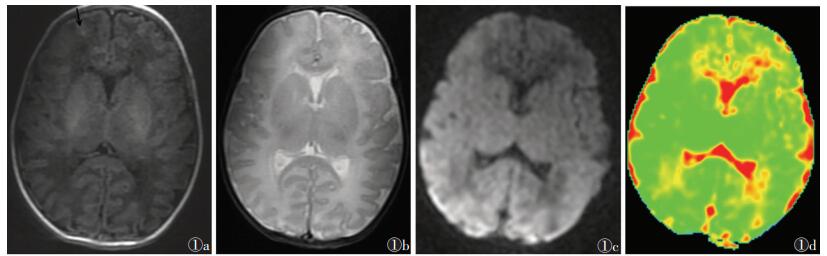
2 结果2组均获得满意的T1WI、T2WI、DWI、ADC图,见图 1,2。
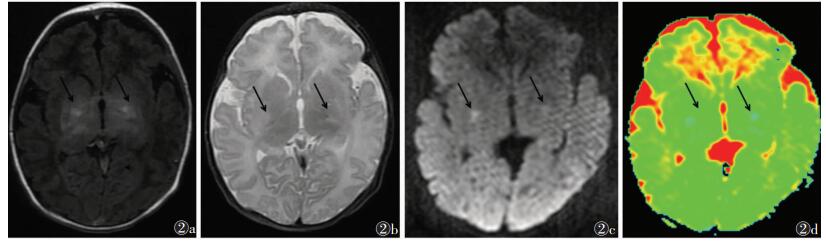 |
| 图 2 女,3 d,预后不良者图 2a~2d分别为T1WI、T2WI、DWI及ADC图。T1WI示双侧内囊可见片状高信号,T2WI上双侧内囊可见片状高信号,DWI示双侧内囊可见明显高信号,ADC图示双侧内囊弥散明显受限(箭头) |
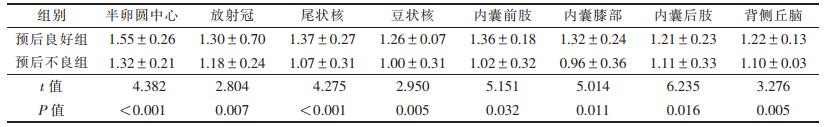
2组ROI的ADC值比较见表 1。71例半卵圆中心层面、放射冠层面深部白质、尾状核、豆状核、内囊前肢、内囊膝部、内囊后肢、背侧丘脑8个ROI的ADC值进行比较,预后良好组ADC值均高于预后不良组(均P < 0.05)。
| 表 1 2组各ROI的ADC值比较(×10-3 mm2/s,x±s) |
 |
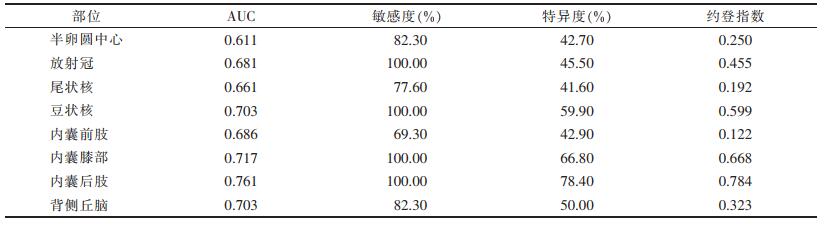
ADC值评估HIE预后的ROI曲线见表 2。8个ROI中,内囊后肢的AUC值最大,对预测HIE预后敏感度最高,差异有统计学意义(P < 0.05)。
| 表 2 ADC值评估HIE预后的ROC曲线 |
 |
3 讨论
DWI是一种在活体内探测分子扩散及显像的技术,图像的信号强度随水分子的运动变化发生相应变化,ADC值即利用这种信号强度变化来计量。研究[7-8]证明,DWI对新生儿HIE的脑损伤改变非常敏感,对其预后评估有重要价值。
本研究发现,预后不良组半卵圆中心层面、放射冠层面深部白质、尾状核、豆状核、内囊前肢、内囊膝部、内囊后肢、背侧丘脑的ADC值较预后良好组低。MAHER等[7]研究发现,预后不良患儿ADC值降低,病情越严重,ADC值下降越明显。这与HIE的病理生理变化密切相关,当发生缺氧、缺血时,Na+/K+-ATP酶功能受限,水分子从细胞外间隙进入胞内,引起细胞毒性水肿,水分子弥散受限,ADC值降低。随着病情进展,其缺氧、缺血程度加重,细胞内外水分子弥散受限也随之增加,ADC值进一步降低。
AUC越大,诊断效能越高,AUC≤0.7诊断效能较低,0.7 < AUC≤0.9诊断效能中等,AUC > 0.9诊断效能较高[9]。本研究发现内囊后肢的AUC在各ROI中最大,表明其预后评估的效能较其他部位高。有研究[10-11]显示,HIE患儿存活者中内囊后肢的ADC值较死亡者高,这可能是因为患儿发生缺氧时,内囊后肢脑代谢较其他部位更旺盛,更易受到损伤;还可能与新生儿中枢神经系统髓鞘化有关,新生儿髓鞘化是从尾侧到头侧、背侧到腹侧、中心到外周的[12],因此内囊后肢较其他部位髓鞘化更早,髓鞘发育更成熟,较其他部位更敏感。故内囊后肢是较理想的评估预后的监测部位。
DWI对HIE患儿预后进行评估时,也存在不足:①ADC值假正常化,HIE早期,ADC值降低,随后可恢复至正常水平,出现“假正常化”现象。此时ADC值不能准确反映患儿情况[13-14]。这可能是由于细胞毒性水肿缓解和血管源性水肿加重所致。有学者[15]认为,ADC值的量化有助于HIE的预后评估,但ADC值在第1周后会发生假正常化,其应用应限制在1周内才有实用价值。②假阴性,新生儿脑组织含水量较成人高,缺血所致的水分子扩散受限在新生儿ADC图上表现不明显,且DWI图像空间分辨力较低,对小病灶不够敏感。③低估损伤程度,DWI可能低估患儿损伤的范围和程度[8, 16],这可能与发生窒息的急、慢性期,损伤部位及机制不同有关。有学者[17]认为,出生24 h内发生的HIE在DWI上均呈异常高信号,且异常信号所在区域及损伤形式与围生期窒息程度密切相关;发生急性全面性窒息时,能量需求较高的区域易受损伤,包括基底节区域、背侧脑干、外侧膝、丘脑等中心灰质区及皮层区等。发生轻度慢性窒息时,颅内脑白质区较易受损伤,特别是在分水岭区的白质。因此,DWI适合于早期诊断,应在出生后1周内进行,且需结合其他MRI检査结果及临床资料综合分析。
| [1] |
DU PLESSIS A J. Neurology of the newborn infant. Preface[J]. Clin Perinatol, 2009, 36(4): XI-XIII. DOI:10.1016/j.clp.2009.09.001 |
| [2] |
JACOBS S E, HUNT R, TARNOW-MORDI W O, et al. Cooling for newborns with hypoxic ischaemic encephalopathy[J]. Cochrane Database Syst Rev, 2013, 30(1): 120-123. |
| [3] |
AZZOPARDI D, STROHM B, MARLOW N, et al. Effects of hypothermia for perinatal asphyxia on childhood outcomes[J]. NEngl J Med, 2014, 371(2): 140-149. DOI:10.1056/NEJMoa1315788 |
| [4] |
PAPPAS A, SHANKARAN S, MCDONALD S A, et al. Cognitive outcomes after neonatal encephalopathy[J]. Pediatrics, 2015, 135(3): E624-E634. DOI:10.1542/peds.2014-1566 |
| [5] |
FERRIERO D M, BONIFACIO S L. The search continues for the elusive biomarkers of neonatal brain injure[J]. J Pediatr, 2014, 164(3): 438-440. DOI:10.1016/j.jpeds.2013.11.042 |
| [6] |
易受蓉, 罗学荣, 杨志伟, 等. 贝利婴幼儿发展量表在我国的修订(城市版)[J]. 中国临床心理学杂志, 1993, 1(2): 71-75. |
| [7] |
MAHER S E, EI-MAZARY A M, MOHAMED G E, et al. Diffusion-weighted MRI and urinary Activin-A are potential predictors of severity in neonates with hypoxic ischemic encephalopathy[J]. Egypt Pediatr Assoc Gaz, 2017, 65(4): 101-107. DOI:10.1016/j.epag.2017.11.003 |
| [8] |
HAYAKAWA K, KOSHINO S, TANDA K, et al. Diffusion pseudonormalization and clinical outcome in term neonates with hypoxic-ischemic encephalopathy[J]. Pediatr Radiol, 2018, 48(6): 865-874. DOI:10.1007/s00247-018-4094-z |
| [9] |
SWETS J A. Measuring the accuracy of diagnostic systems[J]. Science, 1988, 240(4857): 1285-1293. DOI:10.1126/science.3287615 |
| [10] |
HUNT R W, NEIL J J, COLEMAN L T, et al. Apparent diffusion coefficient in the posterior limb of the internal capsule predicts outcome after perimasphyxia[J]. Pediatrics, 2004, 114(4): 999-1003. DOI:10.1542/peds.2003-0935-L |
| [11] |
VERMEULEN R J, VAN SEHIE P E, HENDRIKX L, et al. Diffusion weighted and conventional MR imaging in neonatal hypoxic ischemia:two-year follow-up study[J]. Radiology, 2008, 249(2): 631-639. DOI:10.1148/radiol.2492071581 |
| [12] |
MOON W J, PROVENZALE J M, SARIKAYA B, et al. Diffusiontensor imaging assessment of white matter maturation in childhood and adolescence[J]. AJR Am J Roentgenol, 2011, 197(3): 704-712. DOI:10.2214/AJR.10.6382 |
| [13] |
GUPTA D, RANA D. Spectrum of magnetic resonnce imaging abnormalities of hypoxic ischemic encephalopathy in preterm and full-term patients at tertiary care hospital in india[J]. J Evol Med Dent Sci, 2018, 7(51): 5460-5465. DOI:10.14260/jemds/2018/1208 |
| [14] |
ZHANG F Y, LIU C L, QIAN L L, et al. Diffusion tensor imaging of white matter injury caused by prematurity-induced hypoxicischemic brain damage[J]. Med Sci Monit, 2016, 22: 2167-2174. DOI:10.12659/MSM.896471 |
| [15] |
MERHAR SL, CHAU V. Neuroimaging and other neurodiagnostic tests in neonatal encephalopathy[J]. Clin Perinatol, 2016, 43(3): 511-527. DOI:10.1016/j.clp.2016.04.009 |
| [16] |
IMAI K, DE VRIES L S, ALDERLIESTEN T, et al. MRI changes in the thalamus and basal ganglia of full-term neonates with perinatal asphyxia[J]. Neonatology, 2018, 114(3): 253-260. DOI:10.1159/000489159 |
| [17] |
RANA L, SOOD D, CHAUHAN R, et al. MR Imaging of hypoxic ischemic encephalopathy--distribution patterns and ADC value correlation[J]. Eur J Radiol Open, 2018, 5: 215-220. DOI:10.1016/j.ejro.2018.08.001 |
 2020, Vol. 18
2020, Vol. 18