| 国人乳腺癌腋窝淋巴结转移相关超声征象的Meta分析 |
乳腺癌是发生于乳腺上皮或导管上皮的恶性肿瘤,早期肿瘤局限于乳腺内,出现腋窝淋巴结转移说明疾病已进入中晚期。超声检查对乳腺癌的早期发现、治疗和预后有重要作用。术前超声评估腋窝淋巴结状态,尤其是前哨淋巴结的状态,对判断乳腺癌分期及手术术式的选择,都有重大意义。本研究对乳腺癌发生腋窝淋巴结转移患者的超声图像行Meta分析,以提高腋窝淋巴结转移的检出率。
1 材料与方法 1.1 文献采集与检索计算机检索自建库至2020年9月14日超声诊断为乳腺癌腋窝淋巴结转移的中英文文献。检索数据库有:PubMed、Embase、Cochrane图书馆、中国知网、万方数据库(万方)、维普网、中国生物医学文献数据库、Web of Science。中文检索词包括:“乳腺肿瘤”“淋巴转移”“前哨淋巴结”“超声”和“危险因素”;英文检索词包括:主题词“breast neoplasms”“lymphatic metastasis”“sentinel lymph node”“ultrasonic”“risk factors”及其自由词。
1.2 文献纳入与排除标准纳入标准:①均为病例-对照研究;②转移组为病理诊断为乳腺恶性结节伴腋窝淋巴结转移患者,对照组为病理诊断为乳腺恶性结节未转移患者;③统计方法正确;④数据完整,报告了可供Meta分析的疗效数据;⑤通过了纽卡斯卡-渥太华质量评价表(Newcastle-Ottawa Scale,NOS)评分。排除标准:①重复报道文献;②综述、系统评价、评论、离体实验等文献;③国外病例;④研究内容不吻合、干预措施不一致或结局指标不一致的文献;⑤数据不全的文献。
1.3 质量评价根据NOS对病例-对照研究进行质量评价。评价标准包括病例选择、可比性、暴露、数据等方面。总分9分,≥6分为文献质量可靠。2名评价者独立评价文献,意见分歧时通过讨论或由第3名研究人员协助解决。
1.4 资料提取根据纳入及排除标准筛选文献,并提取基本资料,包括第一作者、发表年份、研究类型、病例数、对照数、对照来源、相关因素。
1.5 统计学方法采用RevMan 5.3软件进行Meta分析,计算比值比(OR)值及95%CI。异质性检验行I2检验,当I2<50%且Q检验的P > 0.1,提示研究间异质性无统计学意义,采用固定效应模型进行分析;当I2 > 50%或Q检验的P<0.1,提示研究间存在较强异质性,则可进行敏感性分析寻找异质性来源,若找到原因,还应尽量采用固定效应模型进行分析。使用漏斗图对文献纳入研究进行发表偏倚分析,若漏斗图呈大致对称分布,则说明无明显发表偏倚,若不对称,则表示存在发表偏倚。
2 结果 2.1 文献检索结果文献筛选流程及结果见图 1,共纳入13篇文献[1-13]。总样本量为3 090例,其中,乳腺癌腋窝淋巴结转移1 491例,未转移1 599例。
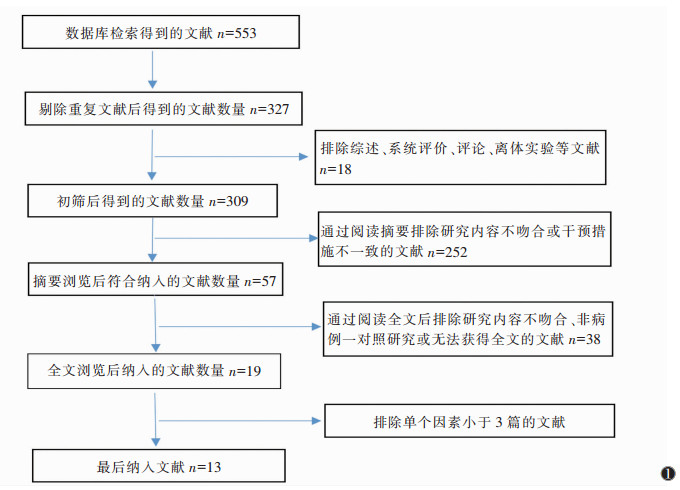 |
| 图 1 文献筛选流程图 |
2.2 纳入文献的基本信息及NOS质量评分情况(表 1)
| 表 1 纳入文献基本信息及NOS质量评分情况 |
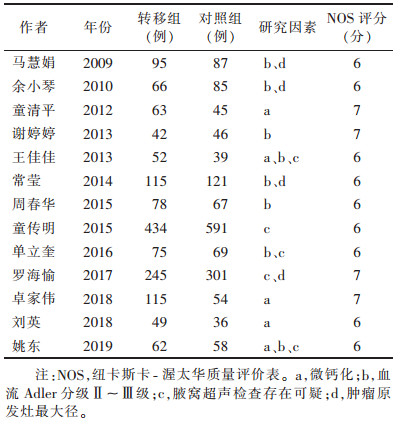 |
13篇文献均为病例—对照研究,对照来源均为未转移的乳腺癌患者。入选的13篇文献均通过了NOS质量评分。
2.3 Meta分析结果 2.3.1 异质性检验5篇文献报道了乳腺癌腋窝淋巴结转移的微钙化因素[3, 5, 11-13],4篇文献报道了肿瘤原发灶最大径因素[1-2, 6, 10],8篇文献报道了肿瘤内血流分级Ⅱ~Ⅲ级因素[1-2, 4-9, 13],5篇文献报道了腋窝超声检查存在可疑因素[5, 8-10, 13]。经过异质性检验,微钙化因素I2=0%且P=0.54,肿瘤内血流分级Ⅱ~Ⅲ级因素I2=19%且P=0.28,提示研究结果间无异质性,采用固定效应模型进行分析。肿瘤原发灶最大径因素I2=86%且P<0.1,腋窝超声检查存在可疑因素I2=50%且P=0.09,提示两因素研究选择的文献之间存在较强异质性,可选择随机效应行Meta分析。
2.3.2 敏感性分析将纳入文献逐一剔除,对剩余文献进行分析,探讨某一文献对整个结果的影响。结果显示,微钙化因素无任何一篇文献对Meta分析结果造成很大干扰,提示研究具有较好稳定性。
对肿瘤原发灶最大径4篇文献进行敏感性分析,文献[10]对Meta分析结果造成很大干扰,剔除此文献后,经过异质性检验I2=0%,且Q检验的P=0.41,提示3篇文献之间无异质性,可选择固定效应进行Meta分析。
肿瘤内血流分级Ⅱ~Ⅲ级因素中文献[1]和[4]对Meta分析结果造成很大干扰,剔除2篇文献后,I2=0%且P=0.76,结果较稳定,表明研究具有较好稳定性。
腋窝超声检查存在可疑因素中文献[5]对Meta分析结果造成很大干扰,剔除该篇文献后,I2=0%且P=0.49,故选择固定效应进行分析,剔除后结果较稳定,表明研究具有较好稳定性。
2.3.3 固定效应的Meta分析微钙化因素的5篇文献汇总的OR值为2.59,95%置信区间(95%CI)(1.99~3.36)。肿瘤原发灶最大径3篇汇总的OR值为6.44,95%CI(4.00~10.37)。肿瘤内血流分级Ⅱ~Ⅲ级因素中6篇汇总的OR值为4.13,95%CI(2.75~6.19)。腋窝超声检查存在可疑因素中4篇文献汇总的OR值为4.31,95%CI(3.49~5.32)。且上述研究均有统计学意义(P<0.05),最终得出微钙化、肿瘤原发灶最大径、肿瘤内血流Ⅱ~Ⅲ级、超声检查发现腋窝淋巴结可疑是乳腺癌腋窝淋巴结转移的危险因素(图 2~5)。
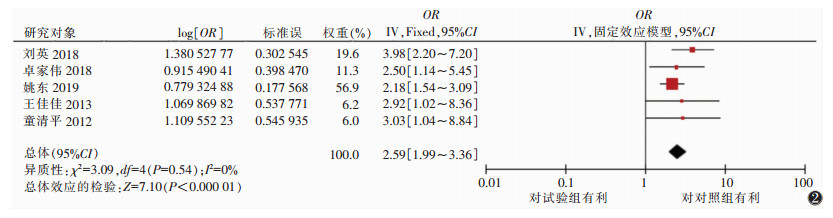 |
| 图 2 微钙化因素森林图 |
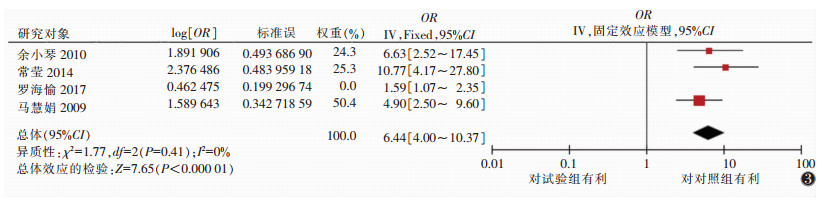 |
| 图 3 肿瘤原发灶最大径因素森林图 |
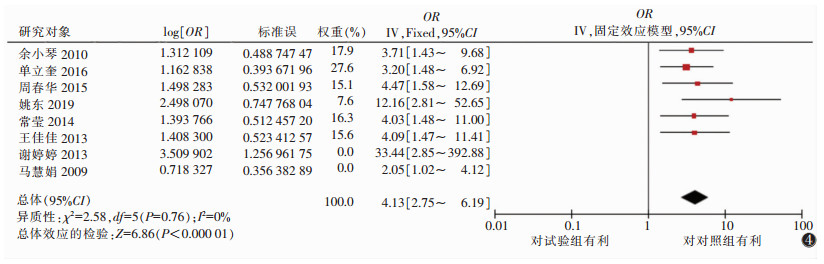 |
| 图 4 肿瘤内血流分级Ⅱ~Ⅲ级因素的森林图 |
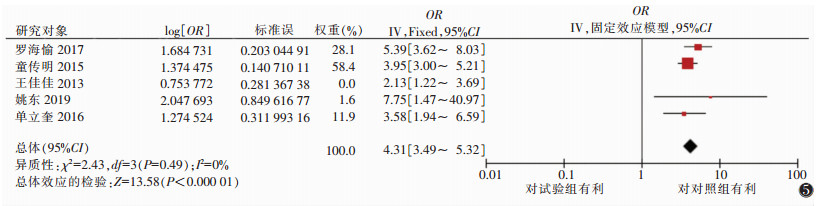 |
| 图 5 腋窝超声检查存在可疑因素的森林图 |
2.3.4 发表偏倚检验
通过绘制漏斗图考察是否存在发表偏倚,漏斗图对称意味着不存在发表偏倚(图 6~9)。
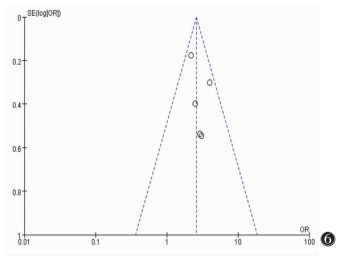 |
| 图 6 微钙化漏斗图 |
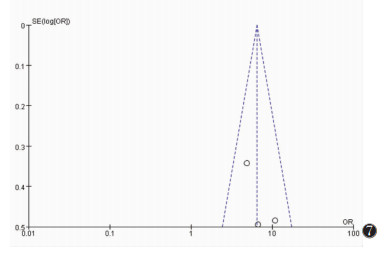 |
| 图 7 肿瘤原发灶最大径漏斗图 |
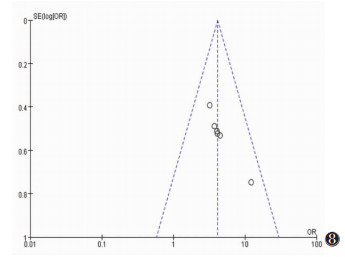 |
| 图 8 乳腺肿瘤内血流分级Ⅱ~Ⅲ级漏斗图 |
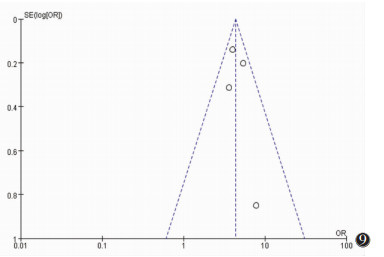 |
| 图 9 腋窝超声检查存在可疑因素的漏斗图 |
3 讨论
腋窝淋巴结是评价乳腺癌患者治疗与预后的重要指标,超声不但可早期诊断和鉴别乳腺癌患者腋窝淋巴结状态,且经济、无辐射、可重复检查。明确乳腺癌腋窝淋巴结转移的超声相关因素可提高诊断准确率,提早发现转移灶,为患者争取治疗时机。
3.1 微钙化钙化是乳腺癌常见的超声表现,一般分为3种:①微钙化,钙化点直径<1 mm,呈针尖样簇状钙化点,后方无声影;②粗大钙化,直径 > 1 mm的强光团,后方伴声影;③弧状钙化,环状或半环状强光带,后方伴声影。
微钙化的形成机制尚不完全明确,可能与细胞代谢异常、细胞坏死、细胞变性有密切相关。乳腺良性肿瘤及恶性肿瘤中均可出现钙化,但恶性肿瘤的发生概率更高。有研究指出,乳腺微钙化病理结果是恶性病变的13%~51%[14]。本研究乳腺癌超声图像出现微钙化时的腋窝淋巴结转移风险是未出现微钙化的2.59倍。
3.2 肿瘤原发灶最大径乳腺肿瘤原发灶的大小是最能反映肿瘤侵袭能力的指标,原发灶越大,发生腋窝淋巴结转移的概率越高。有文献报道,把肿瘤原发灶最大径2 cm作为临界值判断有无淋巴结转移的敏感度62.9%,特异度85.1%[15]。本研究综合3篇文献,得出乳腺原发灶最大径增加导致腋窝淋巴结转移风险增加6.44倍。
3.3 乳腺肿瘤内血流分级血流分级判定标准按照Adler的血流半定量法[16],分为:0级,病灶内无血流;Ⅰ级,少量血流,病灶内可见1~2个点状或细棒状血管;Ⅱ级,中量血流,可见3~4个点状血管或1条重要血管,其长度可接近或超过病灶半径;Ⅲ级,丰富血流,可见5个以上点状血管或2条较长血管。
乳腺癌组织中的微血管密度及血管内皮生长因子的表达与肿瘤的转移密切相关,新生血管是肿瘤生长、侵袭的必要条件,肿瘤一旦进入血管生成期,其转移的潜能迅速出现[14]。有研究表明,乳腺癌血流显像的相关因素主要有肿块大小、分化程度和患者年龄,肿块越大,血流越丰富;分化越差,血流越丰富;随年龄增加,血流减少[17]。
本研究表明,乳腺肿瘤内血流分级Ⅱ~Ⅲ级发生腋窝淋巴结转移的概率是其他血流分级肿瘤的4.13倍。
3.4 腋窝超声检查正常情况下,淋巴结中心部呈高回声,为淋巴门或称髓质部,其主要由动静脉、脂肪及淋巴窦所组成;周边为均匀一致的低回声包绕髓质部分的皮质部,一般由淋巴小结所构成;正常淋巴结回声均匀、门样结构显示清晰,横径与纵径比值> 2.0、无钙化、血流为淋巴门型。转移性淋巴结早期图像为皮质部分局部隆起或偏向性改变,随着癌细胞进一步增殖,淋巴结皮质部分逐渐增厚,淋巴门部分或完全消失,形成了较圆的低回声结节,横径与纵径比值<2.0;期间伴随的肿瘤新生血管形成可能是形成非门性皮质血流特点的一个重要原因[18]。本研究表明,腋窝淋巴结回声异常时,乳腺癌腋窝淋巴结转移风险增加了4.31倍。
总之,乳腺癌腋窝淋巴结转移的超声图像相关因素为肿瘤内微钙化、肿瘤原发灶最大径、肿瘤内血流Ⅱ~Ⅲ级、超声检查发现可疑腋窝淋巴结。
| [1] |
马慧娟, 冷振鹏, 陈莉. 乳腺浸润性导管癌淋巴结转移超声相关因素分析[J]. 临床超声医学杂志, 2009, 11(5): 299-301. DOI:10.3969/j.issn.1008-6978.2009.05.004 |
| [2] |
余小琴, 高军喜, 姚兰辉, 等. 乳腺癌超声征象与淋巴结转移关系的单因素及多因素分析[J]. 中华超声影像学杂志, 2010, 19(4): 317-320. DOI:10.3760/cma.j.issn.1004-4477.2010.04.016 |
| [3] |
童清平, 毛萍, 王佳佳, 等. 超声多参数预测乳腺癌腋窝淋巴结转移的意义[J]. 中华超声影像学杂志, 2012, 21(6): 484-487. DOI:10.3760/cma.j.issn.1004-4477.2012.06.009 |
| [4] |
谢婷婷. 乳腺癌超声声像图表现结合免疫组化与腋窝淋巴结转移的相关研究[D]. 乌鲁木齐: 新疆医科大学, 2013.
|
| [5] |
王佳佳. Logistic回归及ROC曲线评估超声多参数与乳腺癌腋窝淋巴结转移关系[D]. 合肥: 安徽医科大学, 2013.
|
| [6] |
常莹, 杨敬春, 冷振鹏. 彩色多普勒超声对乳腺癌腋窝淋巴结转移的预测价值[J]. 中国医药, 2014, 9(12): 1797-1801. DOI:10.3760/cma.j.issn.1673-4777.2014.12.020 |
| [7] |
周春华. 超声弹性成像联合二维超声、CDFI多元分析超声的预测乳腺癌腋窝淋巴结转移价值[D]. 桂林: 广西医科大学, 2015.
|
| [8] |
童传明, 郑荆州, 吴高松. 乳腺癌患者腋窝淋巴结转移与免疫组化及彩超改变的相关性分析[J]. 临床医学, 2015, 35(6): 1-3. |
| [9] |
单立奎, 何年安, 隋秀芳, 等. 乳腺癌超声表现与腋窝淋巴结转移的相关性分析[J]. 安徽医药, 2016, 20(5): 932-933. DOI:10.3969/j.issn.1009-6469.2016.05.032 |
| [10] |
罗海愉. 临床病理及超声多参数评估乳腺癌腋窝淋巴结转移的价值[D]. 汕头: 汕头大学, 2017.
|
| [11] |
卓家伟, 何以敉, 张美恋, 等. 乳腺癌常规超声及剪切波弹性成像表现与淋巴结转移关系的研究[J]. 中华超声影像学杂志, 2018, 27(8): 709-713. DOI:10.3760/cma.j.issn.1004-4477.2018.08.017 |
| [12] |
刘英. 乳腺癌超声特征与腋下淋巴结转移的相关性分析[J]. 临床医药实践, 2018, 27(12): 928-930. |
| [13] |
姚东. 乳腺癌发生腋窝淋巴结转移与多项超声特征的关系[D]. 衡阳: 南华大学, 2019.
|
| [14] |
王立芝, 桂建伟, 廖丽珍. 乳腺肿块微钙化超声显示诊断乳腺癌的临床分析[J]. 世界临床医学, 2016, 10(21): 13-15. |
| [15] |
孙岭, 徐勇, 张晟, 等. 超声对乳腺癌腋窝淋巴结的诊断价值[J]. 中华超声影像学杂志, 2007, 16(10): 886-888. DOI:10.3760/j.issn:1004-4477.2007.10.018 |
| [16] |
ADLER D D, CARSON P L, RUBIN J M, et al. Doppler ultrasound color flow imaging in the study of breast cancer: preliminary findings[J]. Ultrasound Med Biol, 1990, 16(6): 553-559. DOI:10.1016/0301-5629(90)90020-D |
| [17] |
朱庆莉, 姜玉新, 孙强, 等. 乳腺癌彩色多普勒血流显像的多因素分析[J]. 中华超声影像学杂志, 2006, 15(2): 109-112. |
| [18] |
林周谊, 张群霞, 冉海涛, 等. 乳腺癌腋窝淋巴结转移影像学诊断的研究进展[J]. 中国医学影像学杂志, 2018, 26(7): 552-555. DOI:10.3969/j.issn.1005-5185.2018.07.020 |
 2022, Vol. 20
2022, Vol. 20


