| CT、MRI多模态检查对颅内原发性中枢神经系统淋巴瘤的诊断价值 |
2. 山东省济宁市中西医结合医院影像科,山东 济宁 272100
原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma,PCNSL)属于非霍奇金淋巴瘤,是指由淋巴细胞起源、无中枢神经系统以外淋巴瘤的结外非霍奇金淋巴瘤。PCNSL总体发病率低,约占原发性肿瘤的6.6%,占全部淋巴瘤的1%。近年来,随着艾滋病、器官移植、恶性肿瘤、长期大量应用激素及先天免疫缺陷人群的增加,其发病率呈上升趋势。本研究应用CT、MRI等多模态成像手段对PCNSL进行诊断和鉴别诊断。
1 资料与方法 1.1 一般资料收集2008年1月至2015年9月山东省肿瘤医院、济宁医学学院附属医院及济宁骨伤医院,经病理证实的颅内PCNSL 35例,其中,男14例,女21例,年龄31~76岁。病程1周~10个月,平均2个月。其中单发33例,包括大脑脑叶16例、小脑2例、基底节10例、丘脑2例、胼胝体3例;脑内多发2例。临床表现为头痛、恶心、视物模糊、视乳头水肿等颅内高压症状25例;肢体偏瘫10例;言语不利8例;共济失调3例;记忆力下降、意识情感障碍9例;癫痫发作3例;颅神经受损,如视力下降、听力下降等5例。所有患者均无其他部位淋巴系统肿瘤病史,其中2例人类免疫缺陷病毒(HIV)检测结果为阳性。
1.2 仪器与方法35例均行MRI及CT检查,19例行1H-MRS检查。采用GE Optima 520 Pro 16层螺旋CT及GE Lightspeed 64层螺旋CT扫描机。患者取仰卧位,行前后、上下方位中心定位,以听眦线为基线,扫描范围起自颅顶到枕骨大孔下缘。扫描参数:120 kV,200 mA,颅脑轴位常规平扫后行增强扫描,层厚、层距均为5 mm,矩阵512×512,对比剂为碘海醇或优维显80 mL,使用高压注射器经肘前静脉快速推注,流率3.5 mL/s。
采用Siemens 3.0 T超导型MRI诊断仪行多平面、多序列扫描。扫描序列及参数:SE T1WI(TR 400 ms,TE 13 ms),TSE T2WI(TR 4 000 ms、TE 110 ms),反转恢复水抑制(T2 FLAIR)序列。经肘静脉注射Gd-DTPA(剂量0.1 mmol/kg体质量),获取轴位、冠状位、矢状位的T1WI序列增强图像。DWI采用EPI序列,TR 6 000~9 000 ms,TE 80~90 ms,b值为0及1 000 s/mm2,成像时间为48 s。层厚5.0 mm,层距0.5 mm。通过单体素1H-MRS TR 1 400 ms,TE 40 ms,多体素1H-MRS TR 1 400 ms,TE 140 ms进行采集,感兴趣容积(VOI)区选择在病灶实性强化区。所有图像均由2名资深医师独立分析。
1.3 统计学分析采用SPSS 13.0统计软件,计量资料以x±s表示,多组间比较用方差分析;计数资料采用率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果35例共检出39个病灶,3例多发。CT平扫:38个病灶呈等或高密度,32个呈均匀密度。MRI平扫:38个病灶T1WI、T2WI呈等或稍低信号。27个病灶DWI呈均匀高信号,ADC值降低。多数病灶呈轻至中度水肿和占位效应。CT和MRI增强扫描多为均匀强化,“缺口征”、“尖突征”的出现具有特异性,少数病灶呈环形强化。PWI表现为低灌注,脑血容量(CBV)、脑血流量(CBF)降低,平均通过时间(MTT)、达峰时间(TTP)延长。
CT示PCNSL 19例,占54.3%;MRI示PCNSL 23例,占65.7%;CT联合MRI多模态检查示PCNSL 28例,占80.0%(图 1~3),较单纯CT组和MRI组差异均有统计学意义(均P<0.01)。
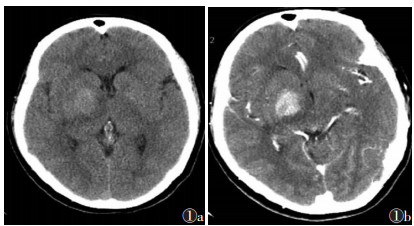 |
| 图 1 女,54岁,原发性中枢神经系统淋巴瘤(PCNSL) 图 1a CT平扫示右侧基底节区类圆形略高密度肿块,密度较均匀,周围有少量低密度水肿带,有轻度占位效应 图 1b 增强扫描肿块明显强化,见“缺口征” |
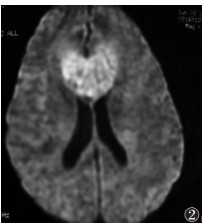 |
| 图 2 女,61岁,胼胝体区PCNSL,呈“蝴蝶样”向两侧生长,DWI呈明显高信号 |
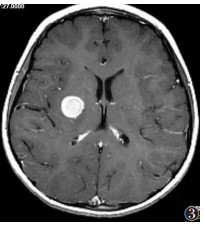 |
| 图 3 男,48岁,PCNSL。右侧基底节区圆形肿块,边缘规则,增强扫描后显著强化,周缘水肿不明显 |
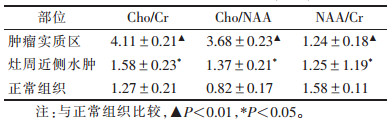
19例行多体素1H-MRS检查,肿瘤实质区、灶周近侧水肿区及正常组织代谢物相对定量分析见表 1。肿瘤实质区均出现胆碱(Cho)峰升高,15例肌酸(Cr)峰、N-乙酰天门冬氨酸(NAA)峰不同程度降低,7例病灶中出现脂质(Lip)峰;在灶周近侧水肿区均未见Lip峰(图 4)。
| 表 1 肿瘤实质区、灶周近侧水肿区及正常组织代谢物相对定量分析(x±s) |
 |
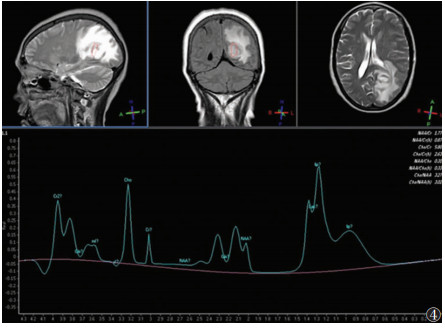 |
| 图 4 女,51岁,PCNSL。左侧顶枕叶占位性病变,明显强化,周围见重度水肿,1H-MRS检查示强化病灶中心胆碱(Cho)峰升高,N-乙酰天门冬氨酸(NAA)峰消失,可见脂质(Lip)峰,符合PCNSL表现 |
3 讨论
PCNSL是一种起源于神经系统,主要累及脑组织、脊膜、颅神经及脊神经,不伴全身其他部位浸润,具有高度侵袭性的恶性肿瘤,发生于脑实质及脑膜的称之为颅内PCNSL,免疫功能正常和免疫缺陷人群均可发生。近几年,PCNSL发病率呈上升趋势,按其细胞起源可分为B细胞型、T细胞型和NK细胞型3类,以B细胞型多见[1]。
3.1 PCNSL的CT、MRI检查目前的MSCT技术较成熟,最小空间分辨率已达到亚毫米级,并能在后处理工作站行薄层重组及实时MPR。本组PCNSL在CT平扫上多表现为结节或团块状等、稍高密度灶,钙化及出血罕见,能用CT值量化病灶的密度变化,并在薄层重组及MPR上发现“握拳征、缺口征、脐凹征、尖角征”的特征性表现。CT存在检查指标单一、无法提供更多、更有效的信息,本组CT示PCNSL 19例,占54.3%。
随着神经影像学(主要是MRI)技术的不断发展,MRI不仅可清晰显示脑组织大体解剖形态学改变,对病灶进行定性诊断,还能提供更多代谢、功能等方面的信息,有助于治疗计划的制订和治疗效果的监测。高场MRI,除拥有极高的密度分辨力和多平面成像特点外,DWI及1H-MRS分析对PCNSL的诊断有很大帮助[2]。本组多表现为DWI高信号、ADC值降低及1H-MRS中Cho峰明显升高、Cr峰降低、NAA峰明显降低或缺失、Cho/NAA、Cho/Cr的比值明显升高。本组MRI提示PCNSL 23例,占65.7%。
近年来,随着各项影像检查技术迅速发展,CT、MRI及各项功能成像、PET、PET与CT、MRI联合应用,明显提高了对疾病的诊断及鉴别诊断水平[3]。本研究发现,CT联合MRI多模态检查提示PCNSL 28例,占80.0%,明显高于单一模态检查。
3.2 PCNSL的主要影像学表现① 病变位置较深,邻近室管膜及脑室周围;位置较表浅,位于大脑表面,病灶多单发,多发病变有聚集现象。②病灶多呈类圆形,密度(信号)较均匀,边缘较清晰,免疫正常患者内部少见缺血、坏死、出血,钙化罕见。③CT平扫病灶大多呈均匀的等或稍高密度影;MRI一般表现为T1WI与脑灰质信号相似,T2WI一般呈等或稍低信号,FLAIR呈高信号。④CT增强扫描呈中度以上强化,并有渐进性增强趋势;MRI增强扫描明显强化,尖突征、握拳征、脐凹征可作为强烈提示诊断征象。⑤DWI呈稍高或高信号,ADC值降低(0.5~1.7),PWI表现为低灌注,CBV、CBF降低,MTT、TTP延长。⑥1H-MRS常出现Cho峰升高、Cr峰降低、NAA峰明显降低或缺失,并出现高耸的Lip峰,肿瘤实质区的Cho/NAA、Cho/Cr的比值明显增加。⑦免疫低下患者,病灶中心可见坏死、出血,增强扫描病灶呈环形强化。
3.3 不典型PCNSL的影像学特点PCNSL的术前影像诊断符合率较低,与其影像表现不典型有关,主要为发病部位不典型。根据发病部位,PCNSL可分为:血管中心性淋巴瘤、弥漫性脑白质病变、硬脑膜淋巴瘤、脊髓淋巴瘤[4]。①血管中心性淋巴瘤,又称成血管细胞淋巴瘤,是指分布在毛细血管、小静脉或小动脉周围的淋巴细胞肿瘤,肿瘤未或极少扩散到邻近的薄壁组织;主要表现为脑实质深部散在的线状、点状及不完整强化,有时累及脑膜,可出现脑膜线样或结节样强化;患者可能出现不明原因的急性精神错乱、痴呆、中风样症状。②原发性硬脑膜淋巴瘤,又称脑膜淋巴瘤,是PCNSL的一种罕见类型[5];常继发于全身淋巴瘤,表现为原发的脑膜淋巴瘤,可位于大脑凸面,大脑镰、小脑幕及脊神经根。③PCNSL中,脊髓淋巴瘤的发病率较低,可表现为脊髓圆锥或马尾神经明显强化伴轻度扩张的多发病灶,无特征性表现。因此,对于脊髓病变对比增强的病灶应考虑脊髓淋巴瘤的可能。
PCNSL的不典型表现为病灶密度或信号不均匀,可为囊变、坏死、出血、钙化,以囊变、坏死最多见。瘤内囊变是由于肿瘤生长过快、血供相对不足,致使瘤内发生缺血、坏死,进一步液化、囊性改变,并有逐步扩大的趋势。不典型PCNSL可合并出血,表现为瘤体卒中,大多临床症状突然加重,影像表现可因出血时期不同而不同,多因肿瘤新生血管的血管壁结构不完善,造成血管破裂出血。钙化出现概率较少,多认为是肿瘤局部包裹造成。
近年来,有学者[6-8]发现极少数PCNSL患者病灶强化并不明显,无论免疫正常还是免疫力受损患者均可出现,原因仍不清楚。
综上所述,CT与MRI技术的联合应用,能明显提高PCNSL的诊断及鉴别诊断水平。经CT或MRI辅助的立体定位活检,活检区选择在CT或MRI的肿块强化实质区,能明显提高临床诊断符合率。同时在PCNSL的治疗过程中,通过CT、MRI跟踪观察病灶的密度(信号)变化、强化幅度、弥散受限的程度变化及1H-MRS波峰的分析可调整放化疗方案,特别在巩固缩野放疗的选择及照射剂量的调整方面有一定价值。
| [1] |
马新星, 陈铟铟, 王中领, 等. 原发性中枢神经淋巴瘤与胶质瘤的DWI对比研究[J]. 放射学实践, 2012, 27(5): 493-497. |
| [2] |
吴珂. 原发性中枢神经系统淋巴瘤MRI与DWI及1H-MRS表现[J]. 中国实用神经病杂志, 2013, 17(4): 42-44. |
| [3] |
曹波, 陈自谦, 张俊祥, 等. 原发性中枢神经系统淋巴瘤多模态MRI与病理学对照分析[J]. 中国CT和MRI杂志, 2012, 10(6): 8-11. |
| [4] |
DeAngelis LM, Seiferheld W, Schold SC, et al. Combination chemotherapy and radiotherapy for primary central nervous system lymphoma:Radiation Therapy Oncology Group Study 93-10[J]. J Clin Oncol, 2002, 20: 4643-4648. DOI:10.1200/JCO.2002.11.013 |
| [5] |
Smith JR, Braziel RM, Paoltti SJ, et al. Expression of B-cell-at-tracting chemokine 1(CECL13) by malignant lymphocytes and vascular endothelium in primary central nervous system lymphoma[J]. Blood, 2003, 101: 815-821. DOI:10.1182/blood-2002-05-1576 |
| [6] |
Zhang D, Hu LB, Henning TD, et al. MRI findings of primary CNS lymphoma in 26 immunocompetent patients[J]. Korean J Radiol, 2010, 11: 269-277. DOI:10.3348/kjr.2010.11.3.269 |
| [7] |
Küker W, Nagele T, Korfel A, et al. Primary central nervous system lymphomas (PCNSL):MRI features at presentation in 100 patients[J]. Neurooncol, 2005, 72: 169-177. DOI:10.1007/s11060-004-3390-7 |
| [8] |
Lachenmayer ML, Blasius E, Niehusmann P, et al. Non-enhancing primary CNS lymphoma[J]. Neurooncol, 2011, 101: 343-344. DOI:10.1007/s11060-010-0258-x |
 2018, Vol. 16
2018, Vol. 16


