| MSCT肠道造影在活动性溃疡性结肠炎诊断及病情评估中的应用价值 |
溃疡性结肠炎(ulcerative colitis,UC)又称特发性UC,是一种病因尚不十分明确的慢性非特异性肠道炎症性疾病,多发生于青壮年,无明显性别差异[1],病变主要累及直肠、结肠的黏膜和黏膜下层,以慢性肠道炎症反复发作、缓解为特点,临床主要表现为反复或持续腹痛、腹泻、黏液脓血便等症状。目前,UC缺乏诊断的金标准,需结合临床症状及体征、肠镜检查、病理结果、影像检查综合分析。合理治疗方案的选择依赖于对病情活动性严重程度和病变累及范围的准确评估。MSCT肠道造影(MSCT enterography,MSCTE)具有简便、快速、无创等优点,通过MPR、MIP及CPR等多种后处理方式,能清晰显示肠壁及肠外病变情况。本研究通过分析活动性UC的CT表现,探讨MSCTE在活动性UC诊断及病情评估中的应用价值。
1 资料与方法 1.1 一般资料收集我院2014年9月至2018年10月经临床、肠镜检查、病理及影像确诊的66例活动性UC的MSCTE资料,其中男37例,女29例;年龄16~77岁,平均44岁。临床主要表现为腹痛、腹泻、黏液脓血便,部分伴发热、夜间盗汗。MSCTE检查均于结肠镜检查1周前后进行。采用改良Truelove和Witts疾病严重程度分型(表 1[1]),将66例分为轻度组(16例)、中度组(21例)及重度组(29例)。
| 表 1 改良Truelove和Witts疾病严重程度分型 |
 |
1.2 仪器与方法
患者检查前禁食12 h以上,检查当日口服2.5%甘露醇溶液2 000 mL,分6次口服,间隔15 min,前2次口服400 mL,后4次口服300 mL,最后一次口服对比剂前5 min肌注山莨菪碱10 mg抑制肠蠕动,对比剂服用后5 min行CT扫描。采用GE Lightspeed VCT 64排MSCT扫描仪,扫描范围自膈顶至耻骨联合水平。扫描参数:120 kV,300 mA,螺距0.984,层厚5 mm,重建层厚0.625 mm。平扫后用高压注射器经肘前静脉注入非离子型对比剂碘佛醇(320 mgI/mL),以3.5 mL/s流率快速团注,剂量80~100 mL,分别延迟25~28 s和60~70 s行动脉期、静脉期扫描。
1.3 图像分析由2名从事CT诊断工作10年以上放射科医师采用双盲法阅片,意见不一致时,经协商达成共识。观察指标:①肠壁增厚(肠管扩张良好情况下,肠壁厚度≥4 mm[2]);②肠壁分层;③肠壁黏膜强化(与相邻正常肠道黏膜比较);④肠壁黏膜下气泡;⑤结肠袋消失;⑥肠腔狭窄;⑦肠系膜小血管增生;⑧肠系膜淋巴结肿大(短径≥5mm);⑨直肠周围脂肪沉积;⑩病变范围。
1.4 统计学方法采用SPSS 19.0统计软件对数据进行处理,UC各组MSCTE表现用(%)表示,采用χ2检验、Fisher确切概率检验进行比较,各组间差异比较采用χ2分割法,以P<0.05为差异有统计学意义。
2 结果MSCTE显示病变区肠壁增厚,增强扫描黏膜强化,病变范围仅累及直肠2例,累及左半结肠(直肠至结肠脾曲以远)20例,累及广泛结肠(直肠至结肠脾曲以近乃至全结肠)44例。
MSCTE表现为肠壁增厚65例(98.5%),呈连续均匀性增厚,厚度4~13 mm,平均7.6 mm;增强扫描肠壁黏膜强化66例(100.0%),肠壁分层33例(50.0%)(图 1),肠壁黏膜下气泡45例(68.2%)(图 2),病变结肠袋消失34例(51.5%)(图 3),病变肠腔狭窄24例(36.4%)(图 4),肠系膜小血管增生58例(87.9%)(图 5),肠系膜淋巴结肿大56例(84.8%)(图 6),直肠周围脂肪沉积19例(28.8%)。轻度组与中度组黏膜下气泡、结肠袋消失、肠管狭窄发生率差异均有统计学意义(均P<0.05),中度组与重度组肠壁分层、肠系膜淋巴结肿大发生率差异有统计学意义(均P<0.05);肠系膜血管增生在3组间差异均有统计学意义(均P<0.05);肠壁增厚、黏膜强化程度及直肠周围脂肪沉积在3组间差异均无统计学意义(均P>0.05)(表 2)。
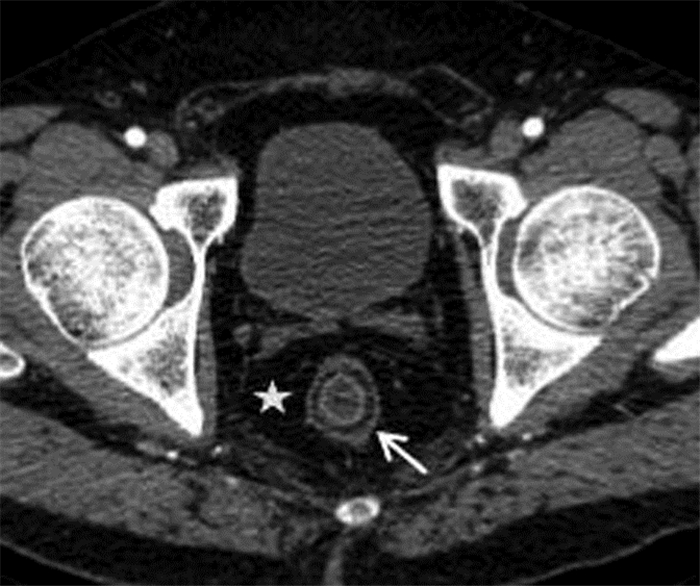 |
| 图 1 男,45岁,重度活动性溃疡性结肠炎(UC)。MSCT肠道造影(MSCTE)示直肠壁增厚,肠壁分层(箭头),黏膜强化,直肠周围脂肪沉积(五角星) |
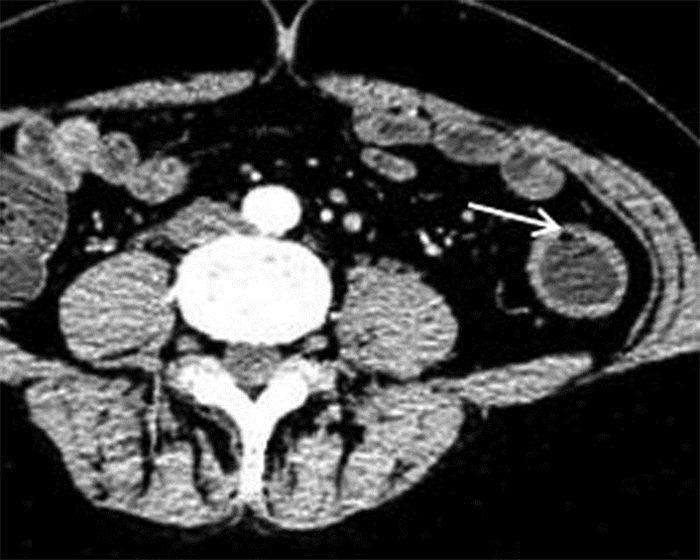 |
| 图 2 女,48岁,中度活动性UC。MSCTE示肠壁增厚,黏膜下气泡(箭头) |
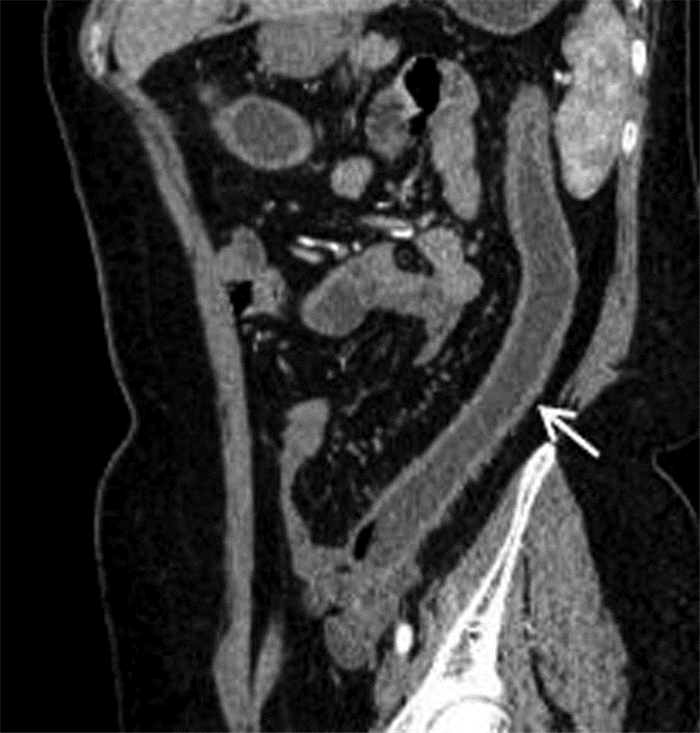 |
| 图 3 女,48岁,中度活动性UC。MSCTE示降结肠壁增厚,黏膜强化,结肠袋消失(箭头) |
 |
| 图 4 女,50岁,中度活动性UC。MSCTE示横结肠壁增厚,黏膜强化,管腔变窄(箭头) |
 |
| 图 5 男,47岁,重度活动性UC。MSCTE示乙状结肠、直肠壁增厚,周围肠系膜小血管增生(箭头) |
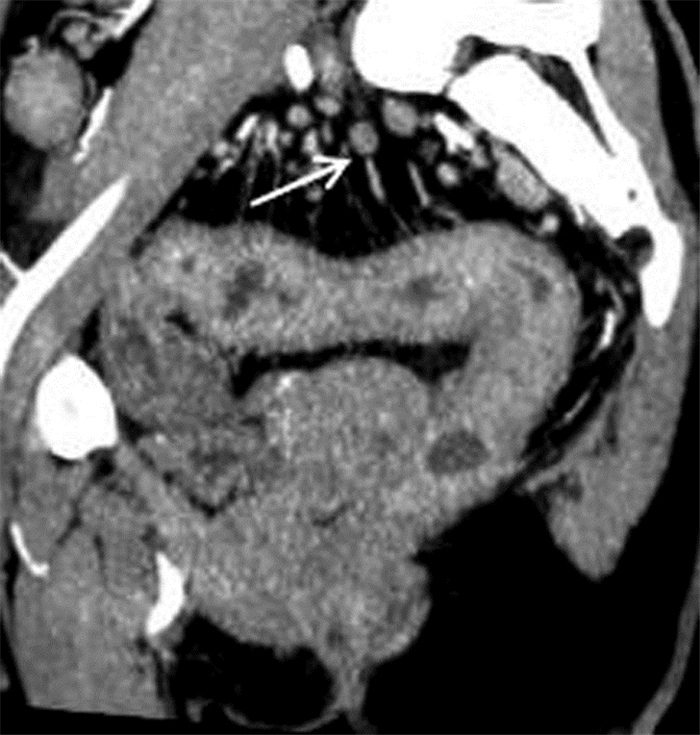 |
| 图 6 女,29岁,重度活动性UC。MSCTE示乙状结肠、直肠壁增厚,周围肠系膜小血管增生、淋巴结肿大(箭头) |
| 表 2 3组MSCTE表现对比 |
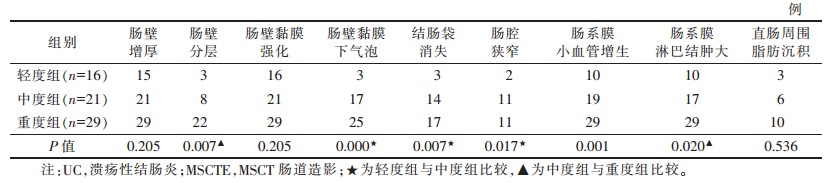 |
3 讨论
UC为炎症性肠病之一,是欧美国家常见病,流行病学资料[3]调查显示,UC在其国家发病率及患病率分别为(8~14)/10万和(120~200)/10万,而我国大陆地区UC的患病率约116/10万[4]。近10年来其患病人数上升了3.08倍[5]。UC常持续或反复发作、迁延不愈,给患者造成了极大的身心痛苦和经济负担,严重影响患者生存质量,被称之为“绿色癌症”[6]。早期正确诊断、全面评价病情对临床选择合适的治疗方案具有重要意义。
传统的X线结肠气钡双对比造影能直观、全面显示UC的黏膜变化、病变范围,但缺乏特异性,且对判断肠外病变灵敏度低。结肠镜是当前诊断UC的主要手段,结肠镜检查联合病理分析是UC病情评估的参考标准,可评估疾病的活动性、严重程度以及筛选大肠癌[7],但结肠镜属侵入性检查方法,且对黏膜下及肠外情况无法评估,对于严重的UC患者,可能增加结肠穿孔的风险[8],因此结肠镜在UC患者病情全面评估中存在一定的局限性。MSCTE是评估肠道炎性病变的标准影像学检查之一[9],近年来广泛应用于临床,已成为UC诊治过程中的重要检查方法。
MSCTE是通过口服对比剂充盈肠道后,由静脉注入对比剂,行MSCT双期扫描,再行MPR、MIP及CPR等多种后处理。MSCTE成功的重要因素在于选择合适的对比剂充盈肠道并使其充分扩张,甘露醇溶液能有效降低肠道对液体的吸收,使肠道充分扩张,有利于清晰显示肠道黏膜皱襞、肠壁及肠管的扩张情况;扫描前肌内注射山莨菪碱(654-2)10mg可减少肠蠕动引起的伪影,延缓肠道内对比剂的排泄;良好的图像及多种后处理方式可多方位、多角度清晰地显示病变肠壁及肠外情况,对病变范围、严重程度作出全面、准确的评价。
UC病变主要累及直肠、结肠黏膜和黏膜下层,以连续性、弥漫性病理进展为特点,起自直肠,逆行向近段发展,甚至累及全结肠及末段回肠。其病理表现依发展的不同阶段而异,早期阶段主要为黏膜充血水肿,黏膜下淋巴细胞浸润,形成多发小脓肿,融合破溃后形成浅表小溃疡,肌层未受累及,MSCTE表现为轻度、均匀、连续性肠壁增厚、黏膜强化,但难以显示肠壁黏膜轻度炎症及浅表小溃疡等[10];进展期溃疡扩大、加深,破入肌层,致肠壁弹力减低,甚者可穿孔或形成瘘管,MSCTE除上述表现外可见黏膜下气泡征,表现为肠壁黏膜下类圆形小气泡,是UC较为特异性的征象之一[11];晚期阶段,黏膜下层充血水肿、黏膜肌层纤维增生、慢性脂肪沉积,而黏膜肌层纤维增生可导致肠腔狭窄、肠管缩短,MSCTE表现为肠壁分层、结肠袋消失、肠管狭窄、肠管缩短等征象,肠管狭窄、肠管缩短为UC患者晚期的特征性表现,但发生率较低[12];肠系膜充血、反复炎性刺激致肠系膜血管增多、肠系膜淋巴结肿大[13]。
全面评估UC的活动程度对于临床治疗至关重要,中、重度UC患者须立即住院治疗,以避免决策延误所致的围术期并发症和死亡[14]。本研究根据改良Truelove和Witts疾病严重程度分型将66例分为轻、中、重度3组,结果显示肠壁增厚、黏膜强化出现率分别为98.5%、100.0%,提示肠壁增厚和黏膜强化是几乎所有病例的基本特征;轻度组以肠壁增厚和黏膜异常强化为主要表现,若同时出现黏膜下气泡、结肠袋消失、肠管变窄则提示中度UC可能性大,除以上表现外,同时显示肠壁分层、淋巴结肿大则提示重度UC可能性大;肠系膜血管增生随病情程度加重而增加;直肠周围脂肪沉积在各组间差异无统计学意义(P>0.05),与病情严重程度无关,推测其可能与病程长短及个体差异有关。本研究显示,UC的MSCTE表现与疾病的发展阶段具有一定的相关性,随着疾病进展,患者的病情有逐渐加重趋势,MSCTE表现出相应的影像特征;因此MSCTE对UC活动期的诊断及临床分度的判断均具有较高的价值。
UC的MSCTE表现具有一定的特征性,但仍需与以下疾病鉴别:①克罗恩病,多表现为节段性、跳跃性分布,肠壁增厚以肠系膜侧为主,而UC肠壁增厚程度较轻,且具连续、对称、均匀的特点,是两者鉴别的关键[15]。②肠结核,表现为肠壁不规则环形或偏心性增厚(增生型),肠管变形、狭窄,典型者肿大肠系膜淋巴结因中心干酪性坏死而呈环形强化,这与UC有所区别。③结直肠癌,肠壁呈局限性、不规则增厚,管壁僵硬,管腔偏心性狭窄,晚期突破浆膜侵犯周围组织,而UC呈连续、均匀增厚,浆膜面光滑。
综上所述,MSCTE能较好显示结肠病变部位、形态改变及肠外并发症,在活动性UC诊断及病情评估中具有重要临床价值,可作为结肠镜检查的补充手段。其不足之处在于对肠道准备要求较高,空间分辨力不足,对于浅小溃疡及瘘管显示不满意;同时存在辐射及剂量大的问题,尤其是对青少年[16]。
| [1] |
中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012年·广州)[J]. 胃肠病学, 2012, 17(12): 763-781. DOI:10.3969/j.issn.1008-7125.2012.12.013 |
| [2] |
Panes J, Bouhnik Y, Reinisch W, et al. Imaging techniques for assessment of inflammatory bowel disease:joint ECCO and ESGAR evidence-based consensus guidelines[J]. J Crohns Colitis, 2013, 7: 556-585. DOI:10.1016/j.crohns.2013.02.020 |
| [3] |
Shimoda M, Horiuchi K, Sasaki A, et al. Epithelial cell-derived a disintegrin and metalloproteinase-17 confers resistance to colonic inflammation through EGFR activation[J]. Ebiomedicine, 2016, 5: 114-124. DOI:10.1016/j.ebiom.2016.02.007 |
| [4] |
刘笃佳, 王媛媛, 马旭. 溃疡性结肠炎的流行病学研究进展[J]. 中国烧伤创疡杂志, 2017, 29(3): 214-217. DOI:10.3969/j.issn.1001-0726.2017.03.014 |
| [5] |
杨红, 张慧敏, 金梦, 等. 溃疡性结肠炎诊断与鉴别诊断要点解析[J]. 临床荟萃, 2016, 31(8): 813-816. |
| [6] |
钟捷, 顾于蓓. 炎症性肠病发病机制与诊治新进展[J]. 内科理论与实践, 2017, 12(3): 157-158. |
| [7] |
常泰, 王浩源, 李民, 等. 评价溃疡性结肠炎的CECT表现与临床、肠镜之间的相关性[J]. 医学影像学杂志, 2017, 27(7): 1311-1317. |
| [8] |
Tran DQ, Rosen L, Kim R, et al. Actual colonoscopy:what are the risks of perforation?[J]. Am Surg, 2001, 67: 847-848. |
| [9] |
耿小川, 许建荣.炎症性肠病影像学诊断的现状和展望[J/CD].中华临床医师杂志(电子版), 2013, 7(23): 1-5.
|
| [10] |
陈冰心, 陈卫昌. CTE在炎症性肠病中应用的初步研究[D].苏州: 苏州大学, 2012.
|
| [11] |
陈光文, 宋彬, 吴苾, 等. 多层螺旋CT对非肿瘤性肠壁增厚的应用价值[J]. 中国普外基础与临床杂志, 2009, 16(2): 164-169. |
| [12] |
陈晓娟, 邓长生, 黄梅芳, 等. 167例溃疡性结肠炎临床和内镜检查分析[J]. 医学新知杂志, 2004, 14(1): 48-49. DOI:10.3969/j.issn.1004-5511.2004.01.020 |
| [13] |
Jia Y, Li C, Yang X, et al. CT Enterography score:a potential predictor for severity assessment of active ulcerative colitis[J]. BMC Gastroenterol, 2018, 18: 173. DOI:10.1186/s12876-018-0890-z |
| [14] |
梁洁, 周林, 沙素梅, 等. 炎症性肠病诊断与治疗的共识意见(2012年·广州)溃疡性结肠炎诊断部分解读[J]. 胃肠病学, 2012, 17(12): 712-720. DOI:10.3969/j.issn.1008-7125.2012.12.003 |
| [15] |
成芳, 钟唬. 炎症性肠病的影像学诊断[J]. 诊断学理论与实践, 2008, 7(1): 89-92. |
| [16] |
张亚男, 常泰. 溃疡性结肠炎的影像检查进展[J]. 医学影像学杂志, 2016, 26(6): 1106-1110. |
 2020, Vol. 18
2020, Vol. 18


