| 乳腺叶状肿瘤与纤维腺瘤高频超声特征的对比分析 |
2. 上海中医药大学附属岳阳中西医结合医院乳腺病科,上海 200437
乳腺叶状肿瘤属于少见的纤维上皮性肿瘤,而乳腺纤维腺瘤是最常见的乳腺良性肿瘤[1],乳腺叶状肿瘤的临床表现、影像学表现、组织病理学特征均与纤维腺瘤有类似之处[2],尤其是超声声像图表现相似,易误诊为纤维腺瘤。良恶性乳腺叶状肿瘤均有复发和转移可能,手术是治疗首选,且手术时需扩大切除范围[3-4]。纤维腺瘤多采取观察随访或肿块单纯手术切除。因此,术前两者的影像鉴别诊断对临床诊治有重要意义。现收集我院2008年8月至2016年12月术前行高频彩色多普勒超声检查、并经手术病理证实的48例乳腺叶状肿瘤和128例乳腺纤维腺瘤患者的超声声像图和临床资料,探讨超声鉴别两者的声像图特征,为临床诊断提供依据。
1 资料与方法 1.1 一般资料乳腺叶状肿瘤48例,均为女性;年龄27~64岁,平均(44.25±9.03)岁。40岁以上30例;均以发现肿块为主诉就诊,其中1例有10余年乳房肿块病史,近期肿块迅速增大;位于右侧乳腺23例,左侧乳腺25例。按照WHO分类标准[5],分为良性29例,交界性(低度恶性)17例,恶性2例。纤维腺瘤128例,均为女性;年龄20~72岁,平均(40.32±12.88)岁。
1.2 仪器与方法使用Siemens Sequoia 512彩色多普勒超声诊断仪,探头频率7.5~13.0 MHz。选择仪器内设置乳腺检查软件进行检查。患者取仰卧位,充分暴露双侧乳腺部位。行乳腺常规超声连续扫查,仔细观察乳腺各层解剖结构,肿瘤的位置、大小、形态、边界、内部回声、无回声区、钙化、后方回声等指标。
参照Adler等[6]提出的半定量法对血流丰富程度进行分级,即将肿物血流最丰富切面的血流形态和数量分为4个等级:0级,肿块内未见血流信号;Ⅰ级,少量血流信号,可见1~2处点状血流信号或短棒状血流;Ⅱ级,中等血流信号,可见3~4处点状血流信号或1条清晰血管;Ⅲ级,丰富血流信号,可见4处以上点状血流信号或2条以上清晰血管。
1.3 统计学方法应用SPSS 20.0统计软件。计量资料以x±s表示;2组超声声像图特征计数资料比较采用χ2检验。检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果 2.1 病理结果48例乳腺叶状肿瘤中良性29例,横径0.9~10.0 cm,纵径0.6~6.0 cm;交界性17例,横径1.7~9.1 cm,纵径1.1~4.7 cm;恶性2例,横径3.7~10.7 cm,纵径2.2~8.4 cm;11例叶状肿瘤伴纤维腺瘤(良性10例,交界性1例);横径均大于纵径。128例纤维腺瘤横径0.7~57.0 cm,纵径0.5~32.0 cm;横径均大于纵径。
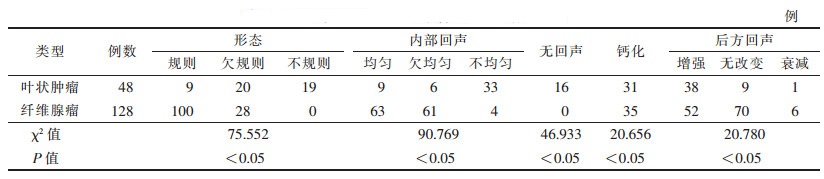
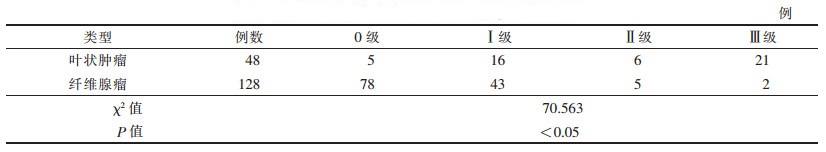
2.2 2组高频彩色多普勒超声声像图特征比较2组肿块在形状、内部回声、有无钙化及无回声区、后方回声、血流信号分级方面,差异均有统计学意义(均P<0.05)(表 1,2)。2组肿块均边界清晰,差异无统计学意义(P>0.05)。
| 表 1 乳腺叶状肿瘤与纤维腺瘤二维超声特征比较 |
 |
| 表 2 乳腺叶状肿瘤与纤维腺瘤彩色血流信号分级比较 |
 |
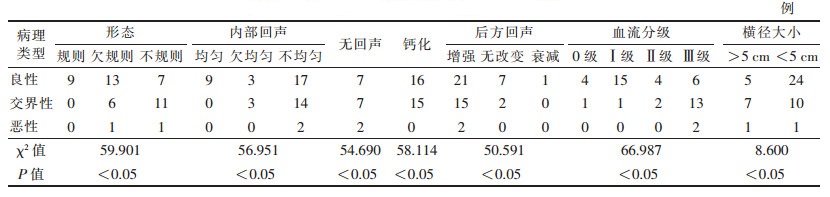
乳腺叶状肿瘤的3种病理类型的声像图特征比较分析显示(表 3):三者在肿瘤大小、形状、内部回声、有无钙化及无回声区、后方回声、血流信号分级方面,差异均有统计学意义(均P<0.05)。
| 表 3 乳腺叶状肿瘤3种病理类型的声像图特征 |
 |
3 讨论
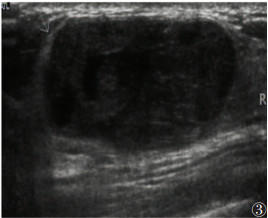
乳腺叶状肿瘤首先由Muller[7]在1838年报道描述为“叶状囊肉瘤”,其后有关报道不断增多[5, 8]。叶状肿瘤好发于中年女性[3],本研究中乳腺叶状肿瘤患者平均年龄为44.25岁。在临床上,叶状肿瘤可能发生在任何年龄段。Akhil等[9]报道了1例9岁女孩左侧乳腺交界性叶状肿瘤手术治疗的罕见病例。本研究均为女性。Jung等[10]报道了1例极其罕见的男性乳腺交界性叶状肿瘤。Ray等[11]报道了1例孕期证实的交界性叶状肿瘤。由此提示,乳腺叶状肿瘤虽是少见的乳腺肿瘤病变,但其临床发病具有多样性。
本研究2例复发,其中1例52岁患者1年前在外院手术病理证实为乳腺良性叶状肿瘤,近期发现乳腺肿块在我院手术治疗,病理证实为良性叶状肿瘤复发。另1例58岁患者6年前手术病理证实为良性叶状肿瘤,近期发现乳腺肿块在我院手术治疗,病理证实为交界性叶状肿瘤。乳腺叶状肿瘤可从良性发展为交界性或恶性肿瘤[12-13]。有研究[12, 14-17]报道乳腺恶性叶状肿瘤的复发和转移,其主要转移部位有肺、骨、脑、肝脏、小肠等。Hassan等[18]报道了1例11岁女孩右侧乳腺恶性叶状肿瘤术后复发并发生肺、肝脏和骨骼转移的案例。
本研究乳腺叶状肿瘤中肿块形态不规则或欠规则39例(图 1)(占81.25%),规则9例(占18.75%);乳腺纤维腺瘤中肿块形态欠规则28例(占21.88%),规则100例(占78.12%),2组差异均有统计学意义(均P<0.05)。乳腺叶状肿瘤中肿块内部回声不均匀33例(占68.75%),纤维腺瘤4例(占3.12%),2组差异有统计学意义(P<0.05)。这也与文献[19-20]报道一致。
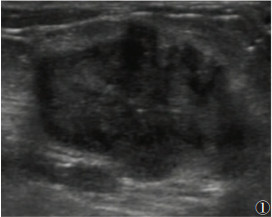 |
| 图 1 女,64岁,左侧乳腺内上象限见不均质回声区,大小3.3 cm×1.8 cm,形态不规则,内见点状强回声及线状血流信号,RI 0.80。病理为乳腺交界性叶状肿瘤 |
文献[21-22]报道乳腺叶状肿瘤中钙化较少,而本研究乳腺叶状肿瘤的肿块内部可见钙化31例(占64.58%)(图 1);纤维腺瘤表现为内部钙化35例(占27.34%),差异有统计学意义(P<0.05)。乳腺叶状肿瘤的肿块内部钙化呈点状、短线状高回声,可能与在乳腺腺体组织超声检查中不易被观察到有关。本研究中钙化的增多可能与例数较前增多等有关。
本研究叶状肿瘤肿块后方回声增强38例(占79.17%)(图 2);纤维腺瘤52例(占40.62%),差异有统计学意义(P<0.05)。Suzuki-Uematsu等[23]研究表明,乳腺叶状肿瘤与恶性肿瘤后方回声衰减规律不一致,其多表现为后方回声增强。
 |
| 图 2 女,34岁,右侧乳腺乳头外侧见低回声区,大小2.8 cm×1.5 cm,局部形态不规则,内部回声欠均匀,内见点状、短线状高回声,后方回声增强,内见线状血流信号,RI 0.70。病理为交界性叶状肿瘤 |
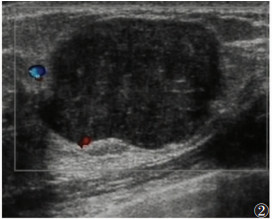
文献[24]报道,乳腺叶状肿瘤部分肿块内有囊腔、出血坏死,而囊腔出血坏死在超声声像图上表现为无回声区,提示乳腺叶状肿瘤的病理特征与声像图特征相符。本研究中,乳腺叶状肿瘤的肿块内部见无回声区16例(占33.33%)(图 3),与文献报道一致。实际上超声声像图显示的复杂的囊性肿瘤有多种可能病变,如血肿、脓肿、纤维腺瘤囊性变、脂肪坏死、乳头状肿瘤坏死、黏液癌、髓样癌、淋巴瘤等,需结合病史或者其他检查等进行鉴别诊断。
 |
| 图 3 女,50岁,右侧乳腺外侧见实质为主混合性回声区,大小3.6 cm×1.7 cm,局部形态欠规则,内见无回声区,实质内见血流信号,RI 0.57~0.61。病理为交界性叶状肿瘤 |
本研究显示,乳腺叶状肿瘤呈Ⅰ级血流16例(占33.33%),Ⅱ或Ⅲ级血流27例(占56.25%)(图 4),未见血流信号5例(图 5),乳腺叶状肿瘤肿块血液供应较丰富者所占比例较高,与文献[25]报道类似。而乳腺纤维腺瘤的表现为Ⅰ级血流43例(占33.59%),Ⅱ或Ⅲ级血流7例(占5.47%),未见血流信号78例(图 6)。2组彩色血流信号分级比较差异有统计学意义(P<0.05)。
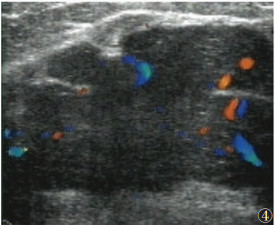 |
| 图 4 女,57岁,左侧乳腺外下象限见低回声区,大小4.4 cm×3.7 cm,局部形态欠规则,内见点状强回声,实质内见血流信号较丰富,RI 0.76~0.79。病理为交界性叶状肿瘤 |
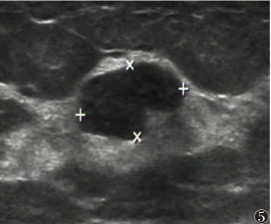 |
| 图 5 女,53岁,左侧乳腺乳头上方见低回声区,大小1.5 cm×0.8 cm,局部形态不规则、呈角状,内部未见血流信号。病理为良性叶状肿瘤 |
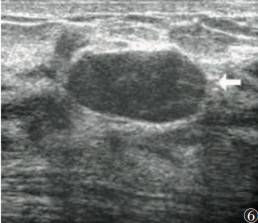 |
| 图 6 女,27岁,右侧乳腺乳头上方见低回声区,大小2.1 cm×0.9 cm,形态规则,内未见血流信号(箭头)。病理为纤维腺瘤 |
本研究提示,乳腺叶状肿瘤的超声特征:①形态欠规则或不规则;②内部呈低回声或不均质低回声;③内部见钙化;④内部见无回声区;⑤后方回声增强;⑥彩色血流信号较丰富。这几项指标联合有助于提高超声对乳腺恶性叶状肿瘤的诊断,但确诊还需依靠病理组织学检查[26]。
| [1] |
蔡文俊, 彭伟国. 乳腺纤维腺瘤80例彩色多普勒超声结果分析[J]. 基层医学论坛, 2010, 14(22): 733-734. DOI:10.3969/j.issn.1672-1721.2010.22.045 |
| [2] |
Lawton TJ, Acs G, Argani P, et al. Interobserver variability by pathologists in the distinction between cellular fibroadenomas and phyllodes tumors[J]. Int J Surg Pathol, 2014, 8: 695-698. |
| [3] |
Mishra SP, Tiwary SK, Mishra M, et al. Phyllodes tumour of breast:a review article[J]. ISRN Surg, 2013, 10: 361469. |
| [4] |
Jennifer LG, Richelle TW, Katherine YM, et al. Utilization of radiotherapy for malignant phyllodes tumors:analysis of the National Cancer Data Base, 1998-2009[J]. Ann Surg Oncol, 2014, 4: 1222-1230. |
| [5] |
Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62: 10-29. DOI:10.3322/caac.20138 |
| [6] |
Adler DD, Carson PL, Rubin JM, et al. Doppler ultrasound color flow imaging in the study of breast cancer:preliminary findings[J]. Ultrasound Med Biol, 1990, 16: 553-559. DOI:10.1016/0301-5629(90)90020-D |
| [7] |
Muller J. Uber den feineren Ban und Die Formen der Krankaften Geschwulste[M]. Berlin: G Reimer, 1838, 54-57.
|
| [8] |
Tavassoli FA, Devilee P. World Health Organization classification of tumors. Pathology and genetics tumors of the breast and female genital organs[M]. Lyon: IARC Press, 2003, 10.
|
| [9] |
Akhil K, Ishwar C, Mukesh KS, et al. Borderline phyllodes tumor of breast in a premenarchal girl:a relatively common tumor at an uncommon age[J]. Int J Cancer Ther Oncol, 2016, 4: 10. |
| [10] |
Jung GK, Shin YK, Hae YJ, et al. Extremely rare borderline phyllodes tumor in the male breast:a case report[J]. Clin Imaging, 2015, 39: 1108-1111. DOI:10.1016/j.clinimag.2015.07.025 |
| [11] |
Ray S, Basak S, Das S, et al. Malignant phyllodes tumor of breast in a pregnant woman with coincidental nulliparous vaginal prolapse[J]. Iran J Med Sci, 2011, 36: 315-317. |
| [12] |
Spitaleri G, Toesca A, Botteri E, et al. Breast phyllodes tumor:a review of literature and a single center retrospective series analysis[J]. Crit Rev Oncol Hematol, 2013, 88: 427-436. DOI:10.1016/j.critrevonc.2013.06.005 |
| [13] |
Kim S, Kim JY, Kim DH, et al. Analysis of phyllodes tumor recurrence according to the histologic grade[J]. Breast Cancer Res Treat, 2013, 141: 353-363. DOI:10.1007/s10549-013-2684-x |
| [14] |
Lightner AL, Shurell E, Dawson N, et al. A single-center experience and review of the literature:64 cases of phyllodes tumors to better understand risk factors and disease management[J]. Am Surg, 2015, 81: 309-315. |
| [15] |
Al-Rabiy FN, Ali RH. Malignant phyllodes tumor with osteosarcomatous differentiation metastasizing to small bowel and causing intestinal obstruction[J]. Diagn Histopathol, 2015, 46: 165-168. |
| [16] |
Singer A, Tresley J, Velazquez-Vega J, et al. Unusual aggressive breast cancer:metastatic malignant phyllodes tumor[J]. J Radiol Case Rep, 2013, 7: 24-37. |
| [17] |
Rowe JJ, Prayson RA. Metastatic malignant phyllodes tumor involving the cerebellum[J]. J Clin Neurosci, 2015, 22: 226-227. DOI:10.1016/j.jocn.2014.09.004 |
| [18] |
Hassan S, Ud DN, Kayani N. Malignant phyllodes tumor in an 11-year-old girl with fatal clinical outcome. A case report[J]. Breast Dis, 2016, 36: 61-64. DOI:10.3233/BD-150193 |
| [19] |
Adamietz BR, Kahmann L, Fasching PA, et al. Differentiation between phyllodes tumor and fibroadenoma using real-time elastography[J]. Ultraschall Med, 2011, 32: 75-79. DOI:10.1055/s-0031-1282024 |
| [20] |
Adam S, Jonathan T, Jose V, et al. Unusual aggressive breast cancer:metastatic malignant phyllodes tumor[J]. J Radiol Case Rep, 2013, 7: 24-37. |
| [21] |
王玉霞. 乳腺分叶状肿瘤的超声表现与病理对照分析[J]. 中国中西医结合影像学杂志, 2014, 12(5): 490-491. |
| [22] |
董晓燕, 薛晓红, 王萍, 等. 乳腺叶状肿瘤的超声特征与病理结果对比分析[J]. 中国介入影像与治疗学, 2011, 8(5): 394-397. |
| [23] |
Suzuki-Uematsu S, Shiraishi K, Ito T, et al. Malignant phyllodes tumor composed almost exclusively of a fibrosarcomatous component:a case report and review of malignant phyllodes tumors with metastases[J]. Breast Cancer, 2010, 17: 218-224. DOI:10.1007/s12282-009-0099-7 |
| [24] |
Tan H, Zhang S, Liu H, et al. Imaging findings in phyllodes tumors of the breast[J]. Eur J Radiol, 2012, 81: 62-69. DOI:10.1016/j.ejrad.2011.01.085 |
| [25] |
汤兵辉, 瞿伟. 乳腺叶状肿瘤19例高频超声特征[J/CD]. 中华医学超声杂志(电子版), 2006, 3(3): 175-177.
|
| [26] |
李慧敏, 李明慧, 贺玲. 超声萤火虫成像技术与X线钼靶在乳腺微钙化的检测的对照研究[J]. 中国医药导刊, 2017, 19(1): 1-2. |
 2018, Vol. 16
2018, Vol. 16


