| MRI在评价剖宫产瘢痕缺损中的应用 |
剖宫产瘢痕缺损(cesarean scar defect,CSD)的发生率随剖宫产率的增加而增加,据报道[1],约50%的剖宫产患者可检出该病。CSD超声表现为子宫肌层前一次剖宫产瘢痕处的三角形低回声缺损。CSD多无症状,但可能导致异常子宫出血、不孕、盆腔疼痛等症状,以及瘢痕异位妊娠及子宫破裂的不良妊娠结局[2-4]。目前,关于该病的临床报道越来越多,大多CSD是在流产、瘢痕妊娠和异常子宫出血时经阴道超声诊断的[3]。在孕妇中,由于CSD中充满羊水,经阴道超声可提示缺损区存在液性暗区,因此对CSD的检测高度精确。MRI因价格昂贵通常不用于对异常子宫出血等的检查,因此关于CSD的MRI报道并不多见;此外,由于放射科医师对CSD的临床意义不甚了解,妇科医师要求的MRI扫描往往不能被放射科医生发现和诊断[4]。在MRI图像上CSD定义为子宫前下段子宫肌层变薄的病灶区域[5]。现回顾性分析我院2017年1月至2018年12月行盆腔MRI平扫的121例女性患者的临床及影像学表现,以评估CSD的MRI特征,以便对CSD进行更大样本的回顾性或前瞻性研究。
1 资料与方法 1.1 一般资料121例,年龄19~44岁,平均(28.6±11.0)岁,均无异常子宫出血、盆腔疼痛等表现。本研究经我院伦理委员会批准,患者知情同意。
1.2 仪器与方法使用Siemens 3.0 T Avanto超导MRI扫描仪,腹部相控阵线圈。扫描范围从子宫底部至耻骨联合下缘。患者取仰卧位,FOV(300~360)mm×(300~360)mm,矩阵256×256,先行常规序列扫描:横断位T1WI(TR 400.0 ms,TE 8.0 ms)及T2WI脂肪抑制序列(TR 245.0 ms,TE 6.9 ms),层厚5 mm;矢状位T2WI序列(TR 3 374.0 ms,TE 100.0 ms),层厚3 mm;初步观察图像后,行多时相动态增强扫描,层厚3 mm,对比剂为Gd-DTPA,剂量0.1 mmol/kg体质量。
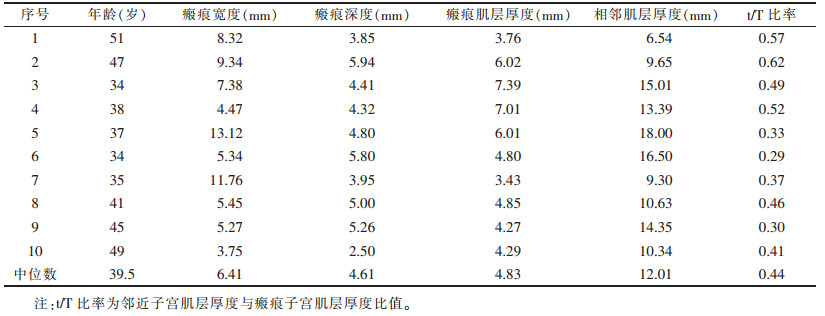
1.3 图像处理及分析分析子宫矢状位T2WI图像是否有瘢痕缺损,即剖宫产瘢痕部位低信号区,深度至少为1 mm。通过深度(缺损底部和顶点之间的垂直距离)、宽度(缺损底部的距离)和剩余的瘢痕肌层(子宫浆膜表面至缺损底部的距离)测量瘢痕缺损区,在缺损底部剩余瘢痕肌层(t)附近测量邻近的子宫肌层总厚度(T/mm)(图 1),各测量值取中位数,并计算t/T。CSD的矢状位形态大致分为裂隙状、三角状、凹陷状及小囊状[5]。
 |
| 图 1 动态增强矢状位T1WI脂肪抑制序列图像上,剖宫产瘢痕缺损(CSD)的MRI测量(d=缺损深度;w=缺损宽度;t=瘢痕子宫肌层厚度;T=邻近子宫肌层厚度) |
1.4 统计学分析
数据收集在excel电子表格(Microsoft. Redmond,WA,USA)中,并由SPSS 13.0统计软件计算中位数。
2 结果121例中10例(8.3%)通过盆腔MRI扫描检测到CSD,测量结果见表 1。瘢痕中位数宽度为6.41 mm,中位数深度为4.61 mm,瘢痕肌层厚度为4.83 mm,瘢痕邻近子宫肌层厚度中位数为12.01 mm,t/T中位数为0.35。MRI诊断CSD的形状为裂隙状(30.0%,3/10)、三角状(60.0%,6/10)、凹陷状(10.0%,1/10)(图 2~5)。
| 表 1 10例剖宫产瘢痕缺损患者的MRI测量结果 |
 |
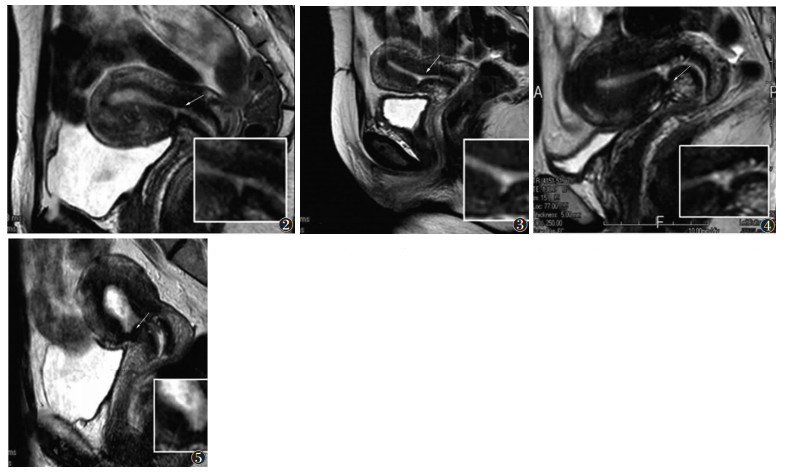 |
| 图 2 图 2~5 CSD的矢状位T2WI图像 图 2 女,34岁,裂隙状CSD(箭头) 图 3 女,38岁,裂隙状CSD(箭头) 图 4 女,37岁,三角状CSD(箭头) 图 5 女,51岁,凹陷状CSD(箭头) |
3 讨论
CSD主要是指剖宫产术后子宫切口愈合过程中子宫内膜和肌层部分或全部的不连续,并在切口处形成一个与宫腔相通的憩室。随着择期剖宫产手术的增加和经阴道超声对瘢痕缺损检测水平的提高,CSD越来越常见[6]。CSD常引起痛经、盆腔疼痛、月经期阴道不规则流血等,部分可引起瘢痕妊娠或不孕,严重影响女性的身体健康和生活质量。以往采用内分泌药物治疗,但效果不理想,现采用经腹腔镜下或经阴道子宫瘢痕缺损切除+子宫修补术,效果显著。
经阴道超声是一种简单、低成本、无创的检查方法,可作为CSD筛选的首选影像学方法。Tower等[7]认为,子宫超声造影诊断CSD也可定义为子宫前下段子宫肌层的三角形低回声缺损。使用经阴道超声根据瘢痕处子宫肌层厚度(t)与邻近子宫肌层厚度(T)之比,可定义瘢痕缺损的严重程度(即t/T≤50%);Osser等[9]则将大缺损定义为瘢痕子宫肌层厚度≤2.2 mm(普通超声)和(或)≤2.5 mm(超声造影)。然而,操作者缺乏经验或超声分辨力低时均可能会漏诊。Surapaneni等[10]将CSD定义为子宫峡部或宫颈管的缺损,在其对148例既往剖宫产和不孕患者的研究中,89例有子宫峡部缺损,其中58例(65.2%)缺损为局灶性,31例(34.8%)为细线性。本研究121例中仅8.3%检出CSD,远低于文献报道。
经阴道超声由于探头直接贴近宫颈,不受肠气和腹壁脂肪的干扰,也不会因膀胱充盈过度或不佳使子宫显示不清,但该检查须于月经干净后数天内进行;经腹部超声不易发现或无法清晰显示子宫内部的特异性结构,腹部脂肪较厚时更易漏诊。MRI空间分辨力和软组织分辨力高,可清晰显示盆腔结构,常规平扫即能较好显示CSD,并能了解其各径线大小、测量残余肌层厚度或CSD距离浆膜层的距离;动态增强扫描可使CSD与宫壁之间形成明显的信号差异,有利于小病灶的检出。另外,MRI无创、无辐射、无检查“时间窗”,以往使用的直肠及阴道线圈已被体部靶线圈及相控阵线圈所代替,检查时无需插入阴道,患者易接受。
前瞻性的MRI研究可更清楚地了解有剖宫产史人群或不同人群中CSD的发病率,以便进行调查。这是因为MRI能准确地定义瘢痕缺损。超声诊断CSD瘢痕缺损的敏感性则取决于探查时的技巧和对缺损的仔细观察。根据我们的数据,当使用Ofili-Yebovi等[8]的相同标准时,以瘢痕处子宫肌层厚度与相邻子宫肌层厚度之比<50%定义为严重缺损,本研究中有70%的严重CSD患者。当使用瘢痕子宫肌层厚度≤2.2 mm(普通超声)和(或)≤2.5 mm(超声造影)定义为大缺损时[9],本研究中无一例。
综上所述,MRI是检测和定义CSD的有效方法,希望通过大样本回顾性研究MRI测量CSD相关数据能够关联和预测临床症状及其妊娠结局,这也将有助于未来CSD的诊断及最佳治疗方案的制订。
| [1] |
Pedraszewski P, Wlazlak E, Panek W, et al. Cesarean scar pregnancy-a new challenge for obstetricians[J]. J Ultrason, 2018, 18: 56-62. DOI:10.15557/JoU.2018.0009 |
| [2] |
Roy MM, Radfar F. Management of a viable cesarean scar pregnancy:a case report[J]. Oman Med J, 2017, 32: 161-166. DOI:10.5001/omj.2017.29 |
| [3] |
Dosedia E, Calda P. Outcomes of laparoscopic treatment in women with cesarean scar syndrome[J]. Med Sci Moni, 2017, 23: 4061-4066. DOI:10.12659/MSM.902720 |
| [4] |
Ravi Selvaraj L, Rose N, Ramachandran M. Pitfalls in ultrasound diagnosis of cesarean scar pregnancy[J]. J Obstet Gynecol India, 2018, 68: 164-172. DOI:10.1007/s13224-016-0956-1 |
| [5] |
Bij de Vaate AJ, Brolmann HA, van der Voet LF, et al. Ultrasound evaluation of the Cesarean scar:relation between a niche and postmenstrual spotting[J]. Ultrasound Obstet Gynecol, 2011, 37: 93-99. DOI:10.1002/uog.8864 |
| [6] |
Youssef, Talaat A. Intrauterine arterial pseudoaneurysm, a rare cause of per vaginal bleeding[J]. J Ultrasound, 2018, 21: 1-5. DOI:10.1007/s40477-018-0282-9 |
| [7] |
Tower AM, Frishman GN. Cesarean scar defects:an underrecognized cause of abnormal uterine bleeding and other gynecologic complications[J]. J Minimally Invasive Gynecol, 2013, 20: 562572. |
| [8] |
Ofili-Yebovi D, Ben-Nagi J, Sawyer E, et al. Deficient lower-segment cesarean section scars:prevalence and risk factors[J]. Ultrasound Obstet and Gynecol, 2008, 31: 72-77. DOI:10.1002/uog.5200 |
| [9] |
Osser OV, Jokubkiene L, Valentin L. High prevalence of defects in cesarean section scars at transvaginal ultrasound examination[J]. Ultrasound Obstet Gynecol, 2009, 34: 8. |
| [10] |
Surapaneni K, Silberzweig JE. Cesarean section scar diverticul-um:appearance on hysterosalpingography[J]. AJR Am J Roent-genol, 2008, 190: 870-874. DOI:10.2214/AJR.07.2916 |
 2019, Vol. 17
2019, Vol. 17


