| 彩色多普勒超声对甲状腺功能亢进患者术前碘准备期甲状腺体积和血流变化的评估 |
原发性甲状腺功能亢进症(简称甲亢)表现为甲状腺腺体增生、体积增大、血管扩张、血流速度加快、血流量增多等一系列结构和功能改变,手术是常用的治疗方案。术前常服用碘剂以抑制甲状腺激素合成及减少甲状腺激素释放入血,同时减少甲状腺的血流量,腺体也随之缩小、变硬,能够避免术中大量出血和并发症的发生[1]。术前一般服用碘剂2~3周,使用时间较长会出现“脱逸”现象[2],因此,术前及时评估甲状腺结构和血流状态对确定手术时机有一定帮助。本研究收集我院2017年1—12月行甲亢手术治疗的患者86例,监测其甲状腺体积和血流变化,从而为临床手术时间的选择提供客观依据。
1 资料与方法 1.1 一般资料86例均经甲状腺功能测定和临床表现诊断为原发性甲亢,并经术后病理证实;其中男21例,女65例;年龄25~63岁,中位年龄35.4岁。术前口服抗甲状腺碘物(丙硫氧嘧啶或甲巯咪唑)至甲状腺功能正常或接近正常时,改口服复方碘化钾溶液,第1天3次,5滴/次,逐日每次增加1滴,至15滴/次后维持至手术当日晨,术前口服碘剂时间2~3周。出现心动过速时给予口服心得安每日3次,每次10 mg。
1.2 仪器与方法86例口服碘剂前1 d、口服碘剂后第7、14天行甲状腺彩色多普勒超声检查。采用Philips IU22彩色多普勒超声诊断仪,探头L12-5,频率12~18 MHz。检查顺序:①测量甲状腺体积,先扫查甲状腺横切面,测量双侧甲状腺的横径和前后径,以及峡部的横径和前后径;然后分别扫查甲状腺纵切面,测量双侧甲状腺的上下径;沿甲状腺峡部正中纵切,测量甲状腺峡部的上下径。根据公式,计算甲状腺实质的体积[3]:每叶体积(cm3)=π/6×上下径(cm)×前后径(cm)×左右径(cm)。总腺体体积(cm3)=左叶体积+右叶体积+峡部体积。②评估甲状腺实质血流分级,按血流信号丰富程度分为0~3级[4-5],0级,甲状腺实质内无血流信号,仅较大血管分支可见彩色血流显示;1级,甲状腺实质内散在分布点状、条状和小斑片状彩色血流信号,多无融合,彩色面积<1/3;2级,甲状腺实质内散在分布斑片状血流信号,部分融合成大片彩色镶嵌状,彩色面积为1/3~2/3;3级,甲状腺内布满彩色血流信号,成大片融合五彩镶嵌状,彩色面积>2/3,包括“火海征”。甲状腺血流分级评估由2位有经验医师独立完成,不一致时由高年资医师会诊得出结果。彩色增益以无杂波干扰为准,血流标尺为8 cm/s。③测量甲状腺上动脉血流速度,包括收缩期最大血流速度(PSV)、舒张末期血流速度(EDV)及RI。测量部位为甲状腺上级处,测量时嘱患者屏气以减少甲状腺位移,声束与血流校正夹角<60°,取样容积宽1.5 mm;合格的测量图像以录得3个以上连续、稳定、清晰的脉冲频谱为准,测量3个心动周期,取平均值。
1.3 统计学分析采用SPSS 22.0统计软件行数据分析,计量资料以x ±s表示,多组间比较行单因素方差分析,方差齐时行LSD检验比较组内差异,方差不齐时采用Tamhane检验比较组内差异;率的比较行Fisher精确检验。以P<0.05为差异具有统计学意义。
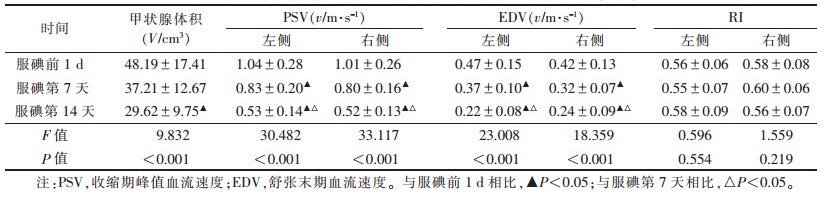
2 结果 2.1 服碘前后甲状腺体积变化及甲状腺上动脉血流动力学变化(表 1)服用碘剂治疗后,甲状腺体积逐渐缩小,第14天体积与服碘前1 d相比,差异有统计学意义(P<0.05)。服碘前1 d、服碘后第7、14天,左侧甲状腺上动脉的PSV、EDV与右侧比,差异均无统计学意义(均P>0.05);服碘后与服碘前1 d比较,甲状腺上动脉PSV、EDV均明显降低(均P<0.05)。服碘前1 d、服碘第7、14天RI差异无统计学意义(P>0.05)。
| 表 1 服碘前后甲状腺体积变化及甲状腺上动脉血流动力学变化(x±s) |
 |
2.2 服碘前后甲状腺实质血流分级变化
口服碘剂前,甲状腺实质血流以3级为主(图 1a),占76.74%(66/86),1级占5.81%(5/86),2级占17.44%(15/86);口服碘剂后甲状腺实质血流逐渐减少,第7天1级血流比例上升至20.93%(18/86),2级血流(图 1b)比例上升至52.33%(45/86),3级血流比例降至26.74%(23/86);口服碘剂第14天,1级血流(图 1c)比例上升至72.09%(62/86),2级血流比例降低至19.77%(17/86),3级血流比例降低至7.00%(6/86),1例为0级血流(1.16%)。服碘前1 d、服碘后第7、14天甲状腺实质血流分级比较,差异有统计学意义(χ2=67.703,P<0.001)。
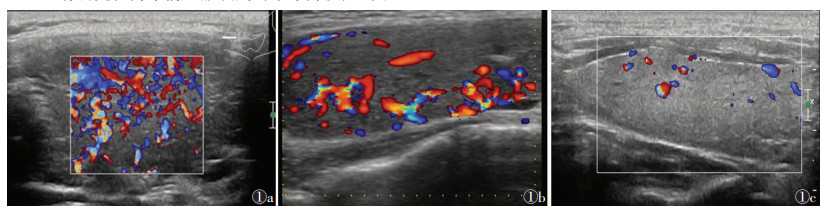 |
| 图 1 女,45岁,甲状腺功能亢进患者口服碘剂前后甲状腺实质的彩色多普勒超声声像图 图 1a 服碘前,3级血流 图 1b 服碘后第7天,2级血流 图 1c 服碘后第14天,1级血流 |
3 讨论
甲亢患者手术并发症的出现与术前是否充分准备密切相关,术前碘准备不仅可调节甲状腺激素的合成和释放,还能抑制血管生成、降低甲状腺内血管密度。口服大剂量碘可通过钠/碘同向转运体使细胞内的碘浓度显著升高,抑制H2O2、血小板生成素活性,减少甲状腺激素的合成[6]。细胞内高浓度碘还能抑制甲状腺细胞内的蛋白水解酶,减少甲状腺球蛋白的分解,从而阻碍甲状腺素释放入血[7]。甲亢患者甲状腺激素水平与甲状腺上动脉血流有很好的相关性,血清游离三碘甲腺原氨酸(FT3)与PSV、EDV、甲状腺上动脉内径呈正相关,促甲状腺素(TSH)则与之呈负相关。实验[8]证实,血管内皮细胞(vascular endothelial cell,VEC)也受碘离子的双向调节,细胞内低浓度碘离子可促进VEC的增殖,高浓度碘离子可使VEC内出现中毒颗粒、细胞形态发生改变甚至死亡,此为抑制作用。其作用机制可能与血管内皮生长因子受体-2(VEGFR-2)磷酸化及Raf-MEK-ERK信号通路激活有关。ERBIL等[9]观察2组毒性弥漫性甲状腺肿(Graves病)患者服用碘剂(每日3次,每次10滴,连续口服10 d)和未服用碘剂进行手术的区别,服用碘剂组甲状腺上动脉血流量明显低于未服碘剂组(51.5 mL/min vs. 74.7 mL/min,P<0.05),术中出血量也明显减少(54.4 mL vs. 108.7 mL,P<0.05)。HUANG等[10]观察25例Graves病患者服用碘剂10 d后,甲状腺上动脉血流量较服碘前减少了60%(117 mL/min vs. 294 mL/min,P<0.05),VEGF也降低了55%(76.7 pg/mL vs. 169.8 pg/mL,P<0.05)。本研究发现,服碘后第7天,甲状腺上动脉PSV、ESV与服碘前相比差异均有统计学意义(均P<0.05),但甲状腺体积与服碘前相比差异无统计学意义(P>0.05);服碘第7天与第14天相比,甲状腺上动脉PSV、ESV继续降低,差异均有统计学意义(均P<0.05),但甲状腺体积比较差异无统计学意义(P>0.05);仅服碘第14天与服碘前相比甲状腺体积差异有统计学意义(P<0.05)。结果提示,服碘后甲状腺血流更早出现变化,而甲状腺体积变化则较慢。
也有研究认为术前口服碘剂对手术并发症的影响较小,YABUTA等[11]对113例Graves病患者进行对比研究,口服碘剂和未口服碘剂情况下手术切除甲状腺,术中出血量差异无统计学意义。分析原因为电刀快速止血、胸腔镜微创手术等手术技术的改进使得术中出血已不是主要问题[12]。也有学者[13]指出服用碘剂后甲状腺血流减少,但甲状腺质地变硬、变脆,不利于术中保护甲状旁腺,因此进行Graves病患者未服用碘剂情况下甲状腺切除的研究,研究表明甲状腺全切和近全切除术后,喉返神经暂时性及永久性损伤的概率分别是7.9%和2.4%,甲状旁腺暂时性及永久性功能低下的发生率是25.5%及3.7%,与服用碘剂进行甲状腺全切和近全切的发生率相近。
综上所述,目前甲亢患者服用碘剂进行术前准备仍是主要选择。服碘2~3周后由手术医师触摸甲状腺大小、硬度判断甲状腺内血流丰富程度,并参考患者心率、基础代谢率等指标决定何时手术。而彩色多普勒超声能准确评估甲状腺的体积和血量丰富程度,可为手术时机的选择提供重要的参考价值。
| [1] |
INOUE S, NAKASE H, MATSUURA M, et al. The effect of proteasome inhibitor MG132 on experimental inflammatory bowel disease[J]. Clin Exp Immunol, 2009, 156(1): 172-182. DOI:10.1111/j.1365-2249.2008.03872.x |
| [2] |
叶有强, 邹劲林, 林志东, 等. 甲亢术前不同碘物准备对甲状腺血流动力学影响[J]. 中国现代应用碘学, 2012, 29(9): 857-859. |
| [3] |
韩久海, 符海, 杜金英. 甲状腺动脉血流量在甲状腺功能亢进中的诊断价值[J]. 海南医学, 2005, 16(9): 48-49. DOI:10.3969/j.issn.1003-6350.2005.09.025 |
| [4] |
吕彦利. 彩超联合超声弹性成像诊断弥漫性甲状腺肿(Graves病)和桥本氏甲状腺炎(HT)的价值[J]. 中国超声医学杂志, 2013, 29(11): 961-964. |
| [5] |
丛淑珍, 梁婷, 甘科红, 等. 采用红细胞指数评价甲状腺实质内血流[J]. 中国医学影像技术, 2012, 28(3): 457-460. |
| [6] |
CALISSENDORFF J, FALHAMMAR H. Lugol 's solution and other iodide preparations:perspectives and research directions in Graves'disease[J]. Endocrine, 2017, 58(3): 467-473. DOI:10.1007/s12020-017-1461-8 |
| [7] |
LEUNG A M, BRAVERMAN L E. Consequences of excess iodine[J]. Nat Rev Endocrinol, 2013, 10: 136-142. |
| [8] |
滕飞, 祖茂衡, 华浅近, 等. 碘离子对血管内皮细胞表达bcl-2/bax蛋白的影响及布加综合征隔膜形成机制[J]. 当代医学, 2013, 19(17): 3-6. DOI:10.3969/j.issn.1009-4393.2013.17.002 |
| [9] |
ERBIL Y, OZLUK Y, GIRIS M, et al. Effect of lugol solution on thyroid gland blood flow and microvessel density in the patients with Graves' disease[J]. J Clin Endocrinol Metab, 2007, 92(6): 2182-2189. DOI:10.1210/jc.2007-0229 |
| [10] |
HUANG S M, LIAO W T, LIN C F, et al. Effectiveness and mechanism of preoperative lugol solution for reducing thyroid blood flow in patients with euthyroid Graves' disease[J]. World J Surg, 2016, 40(3): 505-509. DOI:10.1007/s00268-015-3298-8 |
| [11] |
YABUTA T, ITO Y, HIROKAWA M, et al. Preoperative admini stration of excess iodide increases thyroid volume of patients with Graves' disease[J]. Endocr J, 2009, 56(3): 371-375. DOI:10.1507/endocrj.K08E-240 |
| [12] |
付言涛, 孙辉. 甲状腺功能亢进病人围手术期碘准备临床进展[J]. 中国实用外科杂志, 2018, 38(6): 630-634. |
| [13] |
MERCIER F, BONAL M, FANGET F, et al. Does surgery without Lugol's solution pretreatment for Graves' disease increase surg ical morbidity?[J]. World J Surg, 2018, 42(7): 2123-2126. DOI:10.1007/s00268-017-4443-3 |
 2020, Vol. 18
2020, Vol. 18


