| 胃肠道间质瘤的MSCT表现与病理危险程度分级的关系 |
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是一种来源于胃肠道间叶组织的非定向分化肿瘤。2008年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[1]指出手术切除是主要治疗手段,并推荐MSCT作为间质瘤常规检查及随访项目,但术前准确判断其潜在的恶性程度、侵袭性及有无转移,对GIST治疗方案的选择、判断预后、降低复发转移等具有重要意义。GIST的MSCT表现具有一定特征性[2-3],但其与病理学危险度分级之间的关系需进一步研究。为此,本文回顾性分析我院手术治疗的48例胃肠道间质瘤的患者临床病理及MSCT资料,探讨GIST的MSCT特征及与病理危险程度分级的关系,为选择合理的治疗方案、判断疗效、监测复发或转移提供依据。
1 资料与方法 1.1 一般资料48例中男21例, 女27例; 年龄40~73岁, 平均(56.93±9.43)岁。15例出现反酸、嗳气、恶心、呕吐, 3例呕血, 4例黑便, 5例腹痛或腹部不适, 7例腹部包块, 14例为健康查体中偶然发现。
1.2 仪器与方法采用Philips 256层iCT扫描系统进行检查。检查前禁食8 h, 扫描前口服白开水500~1 000 mL。患者取仰卧位, 先行全腹部CT平扫, 扫描范围自膈顶至耻骨联合水平。扫描参数: 120 kV, 300 mA, 螺距1.0, 层厚、层距均为5 mm, 矩阵512×512, 重建层厚5 mm。增强扫描用高压注射器经肘正中静脉团注碘海醇80~100 mL, 流率2.5~3.0 mL/s, 行动脉期(25~30 s)、静脉期(55~60 s)、平衡期(120 s)扫描。所有图像均采用软组织重建算法行0.625 mm间隔的薄层重建, 并将原始图像和重建图像传至工作站, 行冠状位和矢状位MPR, 软组织窗观察。
1.3 观察指标和评价标准由2名高年资影像学医师采用盲法分别对图像进行观察, 记录病灶的生长部位、生长方式、最大径、形态、实性成分密度、实性部分强化程度(采用3期增强扫描中最大峰值CT值与平扫CT值对照, CT值上升幅度 < 20 HU为轻度, 20~40 HU为中度, >40 HU为显著强化), 以及病灶与周围组织之间的关系和转移情况, 意见分歧时经协商达成统一。采用2008年美国国立卫生研究院(NIH)修订的关于GIST危险度分级方法, 将肿瘤分为极低危险组、低度危险组、中度危险组、高度危险组[1]。本研究将极低度危险组纳入低度危险组中。将CT结果及免疫组化Ki-67增殖指数与病理学危险度分级进行对照。
1.4 统计学分析采用SPSS 24.0软件进行统计分析。肿瘤的最大径、部位、形态、生长方式、实性部分密度及强化程度、Ki-67增殖指数与病理危险度分级的组间比较采用秩和检验, 以P <0.05为差异有统计学意义, 并对差异有统计学意义的结果进行两两比较。进一步对肿瘤的大小、强化程度及Ki-67增殖指数与病理危险度分级进行相关性分析, 采用Spearman秩相关分析法, P < 0.05表示存在相关性, ρ为正数即正相关, 反之则为负相关, |ρ |>0.7即高度相关, 0.4≤| ρ |≤0.7即中度相关, |ρ | < 0.4即低度相关。
2 结果 2.1 病理、免疫组化与CT结果(表 1)| 表 1 胃肠道间质瘤的CT特征与病理危险程度的关系 |
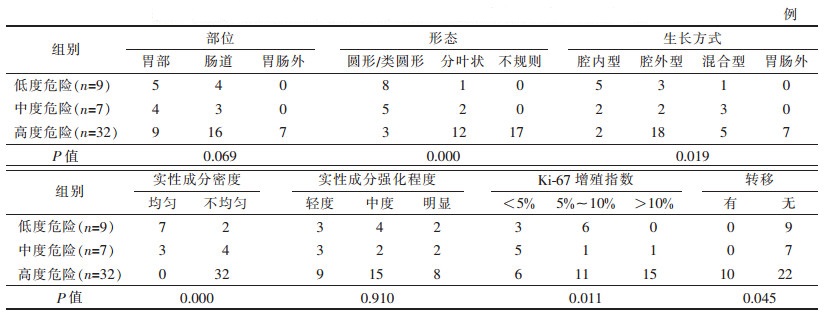 |
48例中, 发生在胃部18例(图 1), 肠道23例, 其中十二指肠3例, 小肠15例, 结肠3例, 直肠2例; 胃肠道外7例。胃肠道41例肿瘤生长方式:腔内型9例(图 1), 腔外型23例, 混合型9例(图 2)。肿瘤形态呈圆形或类圆形16例, 分叶状15例, 不规则形17例。瘤体密度均匀10例(图 1a), 不均匀者38例, 内可见坏死、囊变及溃疡区(图 2a), 其中5例与胃肠道相通内见气-液平面影, 6例见条状、斑片状钙化(图 2a)。测量CT值增强峰值, 并与平扫CT值对照, 肿瘤实性部分呈轻度至明显强化, 轻度强化15例(图 1), 中度强化21例, 明显强化12例(图 2b, 2c), 10例动脉期实质部分见强化血管影(图 2b); 10例发生远处转移, 其中肝脏4例, 脾脏2例, 腹膜1例, 肠系膜2例, 腹壁1例, 转移灶强化方式与原发病灶相似。病理以梭形细胞和上皮样细胞为主(图 1d), 低度危险组9例, 中度危险组7例, 高度危险组32例(图 2)。免疫组化均不同程度表现为CD117及CD34、DOG-1表达阳性特征(图 1e, 2d), 其中Ki-67 < 5%者14例, Ki-67 5%~10%者18例, Ki-67>10%者16例。
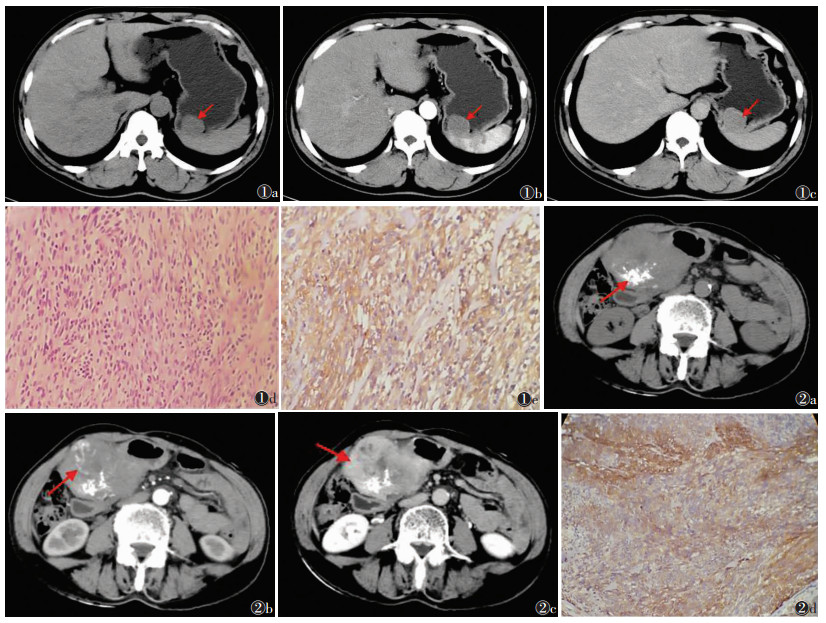 |
| 图 1 男,49岁,查体发现胃占位性病变图 1a~1c分别为CT平扫、动脉期及平衡期示胃底处一类圆形软组织结节(箭头),大小约29 mm× 28 mm,边界清晰,密度均匀,增强扫描均匀轻度强化图 1d手术病理:胃底肿物隆起于黏膜面,切面灰白质中,梭形细胞和上皮样细胞,核分裂象 < 5/50 HPF,低度危险(HE×200)图 1e免疫组化:CD117(+)、CD34(+)、DOG-1(+)、SMA灶(+)、S-100(-)、ki-67(< 5%)(HE×400)图 2女,73岁,查体发现右上腹软组织肿块图 2a CT平扫见胃窦部向腔内外生长软组织肿块影,大小130 mm×67 mm,其内见多发低密度影及点片状钙化影(箭头)图 2b动脉期呈不均匀明显强化,并见强化血管影(箭头)图 2c平衡期呈持续性强化,内低密度影未见强化图 2d结合HE形态及免疫表型,符合胃间质瘤,梭形细胞型,核分裂象 < 5/50 HPF,高度危险。免疫组化:CD34(+),DOG-1(+),CD117(+),SMA(-),S-100(-),Ki-67(< 5%)(HE×400) |
2.2 危险程度分级与CT表现及Ki-67关系(表 1)
最大径:低度危险组(4.60±2.48) cm; 中度危险组(8.71±4.22) cm, 高度危险组(12.88±4.06) cm, 不同危险程度分级的肿瘤最大径差异均有统计学意义(均P < 0.05)。不同危险程度肿瘤的发生部位及其实性部分强化程度差异均无统计学意义(均P>0.05), 而肿瘤生长方式、形态、实性成分密度及是否发生转移差异均有统计学意义(均P < 0.05);免疫组化Ki-67增殖指数差异有统计学意义(P < 0.05)。且肿瘤的最大径和Ki-67增殖指数均与病理学危险度分级之间的相关性呈中度正相关(ρ=0.594, ρ=0.406, 均P < 0.05)。进一步两两分析显示(表 2), 低度危险组与中度、高度危险组肿瘤的最大径差异均有统计学意义(均P < 0.05);高度危险组与低、中度危险组的肿瘤的形态、实性成分密度、Ki-67增殖指数差异均有统计学意义(均P < 0.05);低度危险组与高度危险组肿瘤的生长方式差异有统计学意义(P < 0.05);低度危险组与中度危险组肿瘤的转移情况差异有统计学意义(P < 0.05)。
| 表 2 病理学危险程度与间质瘤CT特征及Ki-67增殖指数的两两比较P值 |
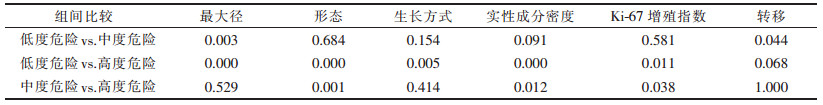 |
3 讨论 3.1 GIST的临床表现及发病机制
从食管到肛门的任何部位均可发生GIST, 少数发生于网膜、肠系膜、腹膜及腹膜后等部位, 称为胃肠道外型间质瘤。临床上以50~60岁中老年人多见, 40岁以前的青中年较少见, 无明显性别差异。Soreide等[4]报道间质瘤好发于胃和小肠, 其中胃部约占55.6%, 小肠约占31.8%, 结直肠6.0%, 食管0.7%, 其他部位或多部位同时发生为5.5%[5]。本研究中发生于胃部18例, 十二指肠3例, 小肠15例, 结肠3例, 直肠2例, 胃肠道外7例, 可能与病例的选取有关。由于GIST是一种潜在恶性肿瘤, 部分可伴远处转移, 以肝脏转移最常见, 其次是腹腔、腹膜后转移, 淋巴结转移少见[6]。临床表现与肿瘤发生部位、病变大小及肿瘤的危险程度有关, 以腹部不适、腹痛或腹部肿块较多见, 临床上很少发生肠梗阻。1983年前, GIST曾与平滑肌瘤、平滑肌母细胞瘤和平滑肌肉瘤一同归为平滑肌源性肿瘤, 随着电子显微镜等设备和免疫组织化学技术的进步, 现已知GIST是胃肠道Cajal间质细胞来源的非上皮肿瘤[7], 是一种在与酪氨酸激酶受体(c-kit)基因或血小板源性生长因子受体α基因(PDGFRA)中具有种系突变的疾病, 其可能的发病机制为c-kit基因功能突变和(或)血小板源PDGFRA突变, 酪氨酸激酶活化后受体持续活化、磷酸化, 引起细胞增殖分化失控和正常凋亡抑制, 最终导致肿瘤的形成[8]。
3.2 GIST的病理及免疫组化特点大多数GIST表现为圆形或类圆形、分叶状或不规则形的膨胀性生长、边界清楚的孤立性软组织肿块, 偶可见多发; 质地较柔软, 切面呈灰白色或淡红色, 由于其血供丰富, 常出现坏死、出血等继发性改变[7]。细胞形态包括长梭形细胞、短梭形细胞、上皮样细胞、多边形细胞、类圆形细胞等, 主要由梭形细胞和上皮样细胞构成[9]。CD117、CD34和DOG-1等是GIST最具诊断价值的免疫组化标记物, 三者联合用于GIST的诊断具有较好的互补性, 尤其对CD117阴性的患者DOG-1具有较大优势, 但CD117、CD34和DOG-1在鉴别GIST危险程度方面意义不大[10-11]。Ki-67是一种反映细胞分裂和增殖活力的标志物, 可用于肿瘤良恶性的诊断、侵袭行为和判断预后[12]。Ki-67的表达水平反映肿瘤细胞增殖活性, 增殖性越强, 则肿瘤危险度越高。本组不同危险程度GIST的Ki-67的表达水平差异有统计学意义(P < 0.05), 与文献[12]报道一致, 且两者之间呈正相关, 说明Ki-67越呈阳性表达, 则肿瘤体积越大、核分裂象计数越多、危险程度分级越高。
3.3 不同病理危险程度分级GIST的CT表现研究[13-15]表明, GIST的危险程度分级与CT表现之间存在一定的相关性。本研究显示, 不同危险程度分级GIST肿瘤的发生部位及其实性部分强化程度差异均无统计学意义(均P>0.05), 而肿瘤最大径、生长方式、形态、实性成分密度及是否发生转移差异均有统计学意义(均P < 0.05)。根据GIST生长方式, 分为腔内型、腔外型、混合型及胃肠道外型, 以腔外型最常见[16], 本研究中, 低、中度危险组GIST以腔内生长为多, 高度危险组中向腔外或混合生长为多, 差异有统计学意义(P=0.019), 与以往文献[15, 17]报道一致。本研究高度危险组肿瘤多呈分叶状、不规则形, 而低、中度危险组常呈圆形或类圆形, 差异有统计学意义(P=0.000)。本研究48例中大于10 cm者25例, 其中21例为高度恶性, 4例为中度危险度, 其最大径在不同危险程度中的分布差异有统计学意义(P=0.000), 且呈正相关, 表明肿瘤体积越大, 其恶性程度越高。低度危险组GIST一般较均匀, 边界较清楚、光整, 即使较大的肿块, 与周围组织的分界亦相对较清; 中、高度危险组多数密度不均, 与邻近结构界限模糊时提示浸润[18], 这与瘤体较大、生长较快、肿瘤中心得不到足够的血供而发生坏死、囊变及溃疡有关, 坏死大多呈偏心性可与胃肠道相通, 当肿瘤内出现气-液平面影即"Torri-celli-Bernoulli征"时高度提示为高危险度的间质瘤[18]。本研究中不同病理分级肿瘤实质部分强化程度差异无统计学意义(P>0.05)。48例中溃疡、出血及钙化均少见, 而国内外相关研究对于以上征象是否能成为GIST危险程度分级的指标尚存在争议, 还需扩大样本数量进一步探讨[19]。部分病灶内部增强扫描可见供血动脉及引流静脉, 研究[20]表明供血动脉及引流静脉为危险程度分级的独立影响因素。本研究10例出现远处转移, 肝转移4例, 脾转移2例, 腹膜转移1例、肠系膜转移2例、腹壁转移1例, 均发生于高度危险组, 差异有统计学意义(P < 0.05), 出现转移提示GIST恶性风险高。值得注意的是, 本研究中所有胃肠道外型间质瘤均为高度危险组, MSCT多表现为恶性征象, 可对判断间质瘤的恶性程度起辅助作用。
总之, MSCT表现能反映GIST的发生部位、病灶最大径、形态、生长方式、实性成分密度、实性部分强化程度与病理不同危险程度分级关系密切, 有助于判断肿瘤恶性程度, 为肿瘤的治疗方案选择、疗效评估、复发或转移监测提供重要依据。
| [1] |
Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J]. Hum Pathol, 2008, 39: 1411-1419. DOI:10.1016/j.humpath.2008.06.025 |
| [2] |
侯毅斌, 王忠富, 陈志军, 等. 胃肠道间质瘤的影像学表现与恶性判定依据标志分析[J]. 中国CT和MRI杂志, 2015, 13(7): 78-91. DOI:10.3969/j.issn.1672-5131.2015.07.024 |
| [3] |
韦永春. 胃间质瘤的CT诊断及危险度的分析[J]. 中国CT和MRI杂志, 2015, 13(9): 99-102. DOI:10.3969/j.issn.1672-5131.2015.09.031 |
| [4] |
Soreide K, Sandvik OM, Soreide JA, et al. Global epidemiology of gastrointestinal stromal tumours (GIST):A systematic review of population-based cohort studies[J]. Cancer Epidemiology, 2016, 40: 39-46. DOI:10.1016/j.canep.2015.10.031 |
| [5] |
方仕旭, 林彬, 王峰, 等. 胃肠道间质瘤影像学诊断的最新进展[J]. 医学理论与实践, 2018, 31(12): 1742-1744. |
| [6] |
谢超, 柏刚, 张文君, 等. 32例胃肠道间质瘤超声和CT资料分析[J]. 山东医药, 2015, 55(22): 57-59. DOI:10.3969/j.issn.1002-266X.2015.22.022 |
| [7] |
Lee SJ, Hwang CS, Kim A, et al. Gastrointestinal tract spindle cell tumors with interstitial cells of Cajal:Prevalence excluding gastrointestinal stromal tumors[J]. Oncol Lett, 2016, 12: 1287-1292. DOI:10.3892/ol.2016.4758 |
| [8] |
任萍, 丁长青, 刘文. 21例胃肠道间质瘤临床、病理及影像分析[J]. 中国当代医药, 2017, 24(19): 4-10. DOI:10.3969/j.issn.1674-4721.2017.19.002 |
| [9] |
刘海龙, 刘金丰, 黄培楷, 等. 胃部胃肠间质瘤的CT征象与恶性程度的关系[J]. 广州医学院学报, 2017, 45(1): 36-40. DOI:10.3969/j.issn.2095-9664.2017.01.10 |
| [10] |
孙雪莲. 胃肠道间质瘤影像表现及免疫组化分析[J]. 中国中西医结合影像学杂志, 2016, 14(2): 204-206. DOI:10.3969/j.issn.1672-0512.2016.02.027 |
| [11] |
郑铭, 江淑萍, 何毅辉, 等. 胃肠道间质瘤组织中DOG1与CD117、CD34的表达及意义[J]. 中国老年学杂志, 2012, 32(6): 1165-1167. DOI:10.3969/j.issn.1005-9202.2012.06.024 |
| [12] |
王帆荣, 陈芸, 李梅, 等. 胃肠道间质瘤中Ki-67表达及其与临床病理特征、危险度分级的相关性[J]. 临床与实验病理学杂志, 2017, 33(9): 1022-1025. |
| [13] |
詹泽娟, 李雪春, 李传旺, 等. 胃肠道间质瘤CT影像表现与病理危险度的相关性分析[J]. 现代医用影像学, 2017, 26(5): 1259-1261. |
| [14] |
Vernuccio F, Taibbi A, Picone D, et al. Imaging of gastrointestinal stromal tumors:From diagnosis to evaluation of therapeutic response[J]. Anticancer Res, 2016, 36: 2639-2648. |
| [15] |
赵宇, 刘辉, 习羽, 等. 胃间质瘤CT征象与肿瘤危险度分级的关系[J]. 实用放射学杂志, 2016, 32(6): 892-895. DOI:10.3969/j.issn.1002-1671.2016.06.017 |
| [16] |
邱海静, 李晨霞, 俱增武, 等. 间质瘤的影像学表现及诊断价值[J]. 实用放射学杂志, 2014, 30(12): 2001-2003. DOI:10.3969/j.issn.1002-1671.2014.12.013 |
| [17] |
马菊香, 叶兆祥, 李绪斌, 等. 多层螺旋CT检查在胃肠道问质瘤危险度分级中的应用[J]. 中华消化外科杂志, 2015, 14(3): 242-247. DOI:10.3760/cma.j.issn.1673-9752.2015.03.015 |
| [18] |
高芙蓉, 卞巍, 俞丽. 胃肠道间质瘤的MSCT表现[J]. 医学影像学杂志, 2018, 28(3): 422-425. |
| [19] |
蔡伶伶, 杜光烨, 王博成, 等. 不同危险度胃肠道间质瘤CT、MRI影像学特征及分析[J]. 中国医学物理学杂志, 2016, 33(5): 491-495. DOI:10.3969/j.issn.1005-202X.2016.05.012 |
| [20] |
Zhou C, Duan X, Zhang X, et al. Predictive features of CT for risk stratifications in patients with primary gastrointestinal stromal tumour[J]. Eur Radiol, 2015, 26: 1-8. |
 2019, Vol. 17
2019, Vol. 17


