| 黏液样脂肪肉瘤的影像学诊断并文献复习 |
2. 河南省郑州市中心医院放射科, 河南 郑州 450000
脂肪肉瘤是来源于原始间叶组织的恶性肿瘤,占全部恶性肿瘤的1%,占软组织恶性肿瘤的14%~18%[1-2]。黏液样脂肪肉瘤(myxoid liposarcoma,MLS)的发生率在所有脂肪肉瘤中居第2位[3],好发于40~60岁,男性多于女性。目前对该病的影像学诊断报道较少,笔者收集7例MLS,对其流行病学、病理生理机制、影像学特征、鉴别诊断、治疗及预后进行阐述,旨在提高对该病的认识。
1 资料与方法 1.1 一般资料回顾性分析河南省洛阳正骨医院2016年1月至2019年12月经手术病理证实的7例MLS的临床及影像学资料,其中男5例,女2例;年龄17~66岁,中位年龄41岁。7例均无明显诱因发现局部缓慢生长的无痛性肿块,触诊肿块质地中等,无明显局部红、肿、热痛及压痛。
1.2 仪器与方法7例中,4例行超声检查;3例行CT检查,其中2例同时行CT增强扫描;4例行MRI检查,其中3例同时行MRI增强扫描。超声检查采用GE Logiq E9超声诊断仪,高频线阵探头,探头频率5~12 MHz,选用肌骨预设条件。CT检查采用Siemens 64排螺旋CT扫描仪,行横断面扫描,层厚1.25 mm,层距0.9 mm,对原始数据行骨算法及软组织算法重建,后行冠状面及矢状面MPR。MRI检查采用GE Signa Excite 1.5 T超导MRI扫描仪。扫描序列与参数:SE T1WI TR 450~600 ms,TE 11~14 ms;FSE T2WI TR 000~4 500 ms,TE 95~120 ms;行轴位及冠状位、矢状位平扫,同时应用脂肪抑制T2WI;增强扫描对比剂为Gd-DTPA,采用高压注射器注射,剂量0.1 mmol/kg体质量。
1.3 图像分析由2名主治以上诊断医师,分别判断并记录肿瘤的基本信息(部位、形态、大小、回声/密度/信号、边界及其与邻近结构关系、强化方式),经讨论后达成一致意见。
1.4 病理分析由2名主治以上病理科医师分析病理结果,病理学诊断依据为镜下可见诊断性脂肪母细胞和特征性分支状血管,黏液基质明显且圆形细胞比例<10%。
2 结果 2.1 影像学结果7例均为单发,3例位于大腿,1例位于小腿,1例位于腹膜后,2例位于右侧腰部,肿瘤最大径19.5 cm。1例位于腹膜后病灶形态不规则,余6例均为椭圆形病灶。4例行超声检查,表现为边界清楚的团块状稍高回声,形态规则,内回声不均,内可见片状稍低回声(图 1)。3例行CT检查:2例病灶形态规则呈椭圆形,边界清,均表现为低密度肿块伴瘤内纤维分隔;1例腹膜后病灶表现为不规则形软组织密度影及脂肪密度影,边界清,内可见多发分隔,实性成分平扫CT值约20 HU;增强扫描实性部分及分隔强化(图 2)。4例行MRI检查:病灶边界清,形态规则,平扫T1WI病变呈等或稍低信号,3例T2WI以明显高信号为主,1例T2WI呈不均匀稍高信号,3例病灶T1WI内见云絮状或斑片状高信号,脂肪抑制T2WI呈低信号;增强扫描实性部分及分隔明显不均匀强化(图 3,4)。
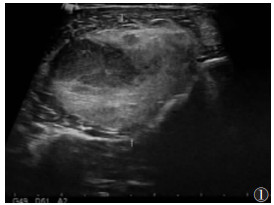 |
| 图 1 女,20岁,右胫骨外侧肌肉层内病灶,超声示呈团块状稍高回声,形态规则,内回声不均,内可见片状稍低回声 |
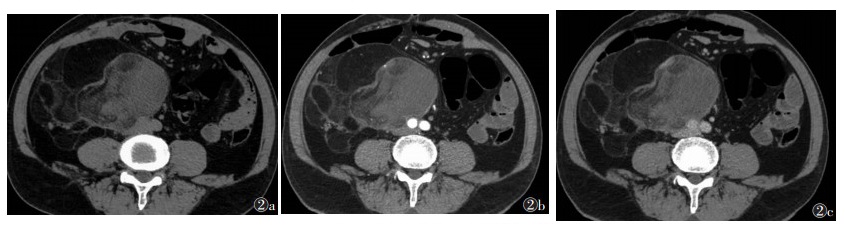 |
| 图 2 男,66岁 图 2a CT平扫示右侧腹膜后巨大肿块,可见多发分隔脂肪密度及软组织密度 图 2b,2c 增强扫描动脉期及延迟期分隔及实性区轻度强化 |
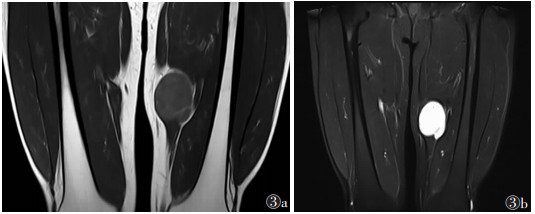 |
| 图 3 男,36岁 图 3a T1WI示左侧股骨内侧肌层内椭圆形占位性病变,呈等信号,内可见絮状高信号 图 3b T2WI呈明显高信号,内可见低信号间隔 |
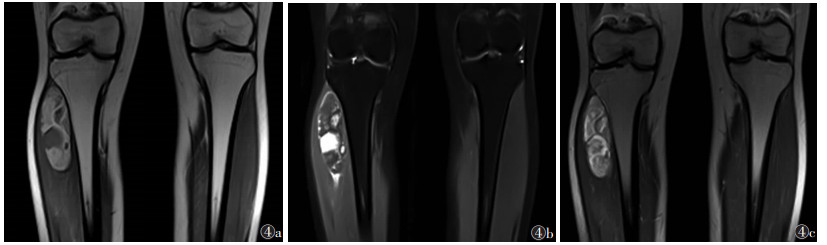 |
| 图 4 女,20岁图 4a T1WI冠状位示右胫骨外侧肌肉层占位性病变,呈高信号,内可见片状低信号 图 4b 脂肪抑制T2WI冠状位示T1WI高信号相应区域、T1WI低信号相应区域呈明显高信号,另可见间隔呈低信号 图 4c T1WI增强扫描示病灶明显强化 |
2.2 手术及病理结果
7例均行手术切除,大体标本质中或质软;有包膜,大部分包膜完整,呈灰黄色、灰红色,切面呈灰红或灰白色胶冻样或鱼肉样。镜下:主要由大量黏液样基质组成,可见梭形细胞、数量不等及不同分化程度的脂肪母细胞及分支状血管,局部胶原纤维聚集呈线状改变。免疫组化结果:CD31(血管+),CD34(血管+),P16(+),S-100(部分+),SOX-10(-),Vimentin(+),MDM2(-/+),Ki67(5%~15%),部分患者CDK4(-/+)。
3 讨论 3.1 流行病学MLS是脂肪肉瘤较常见的一种亚型,发生率居脂肪肉瘤的第2位,占脂肪肉瘤的15%~20%和软组织肉瘤的5%,发病高峰在40~50岁,与其他亚型相比,MLS发病年龄更早,为30~40岁。该病儿童虽少见,却是儿童和青少年最常见的脂肪肉瘤类型[4-5],本研究中位年龄41岁,与文献报道一致。有文献报道男女在发病率上无差异[6],但也有研究者认为男性发病率稍高于女性,约占61%[7]。MLS最常见于下肢软组织深层(75%~80%),超过2/3的患者起源于大腿肌肉组织,也可见于腹膜后(8%)和上肢(5%)[8]。有研究者以个案的形式报道发生于胃、食管等少见部位的MLS[9-10]。本组7例中,3例位于大腿,1例位于小腿,1例位于腹膜后,2例位于腰部。MLS发病原因目前尚不完全清楚,创伤可能是一个病因,但尚无明确证据[11]。
3.2 病理机制与影像学表现95%以上的MLS细胞遗传学特征是t(12;16)(q13;p12)或更罕见的t(12;22)(q13;p11)染色体易位,从而形成FUS-CHOP融合基因[12]。既往研究提示,端粒逆转录酶(TERT)在MLS中表达相对较高,约44%[13-17]。大体病理表现为病灶界限清楚的分叶状胶冻状肿块,镜下可见大量黏液样基质中分布着数量不等的均匀小梭形和椭圆形原始非脂性间充质细胞,以及由细毛细血管网组成的鸡爪样或鱼尾纹特征性分支血管模式[18];在黏液样基质中也存在圆形或椭圆形细胞,血管周围、间隔和肿瘤边缘的细胞较多。MLS分级系统通常将肿瘤体积5%为分界,<5%为低级别,≥5%为高级别。细胞成分的体积越大,表明MLS的级别越高,临床预后越好[19]。
MLS的影像学检查方法目前主要有超声、CT、MRI和发射型计算机断层扫描(ECT)等,常用的主要是前三者。在MRI报告中MLS呈囊性表现者高达22%[20],超声用于初步检查,用来鉴别肿瘤是否为囊性,病灶在超声图像上呈混合回声肿块伴后方回声增强,不符合囊性病变,对MLS的定性诊断作用不大。CT表现为边界清晰、低密度及软组织密度混杂肿块,内可见分隔,与其他脂肪肉瘤亚型相比钙化发生罕见,CT对有钙化存在的病灶敏感。MRI因软组织分辨力高,是MLS首选的影像学诊断方法,对MLS中脂肪成分的检出尤为重要。MLS在MRI上主要表现为T1WI混合信号,T1WI高信号病灶,代表脂肪成分,但本病脂肪含量通常较低,易对诊断造成一定困难。脂肪隔/片絮状T1WI高信号及有时可见的微小灶内结节,在病理上对应脂肪母细胞聚集区,对本病的鉴别具有重要意义。黏液样成分T2WI呈高信号,脂肪成分通常表现为稍高的中等信号,内可见多发T2WI低信号分隔,分隔一般均匀增厚(> 2 mm);增强扫描边缘及分隔轻中度强化,病理证实为增生的纤维组织,黏液区不强化或可见斑片状、片絮状延迟强化。MLS含有少量脂肪成分及大量黏液成分,部分MLS可能在非增强图像上显示为囊性肿块,在T1WI上缺乏局部高信号,使其与大多数其他软组织肿块不易区分。总之,超声在区分囊性病变和实性病变中起着重要作用。如囊性病变表现为壁增厚或内部复杂性(异质信号、结节或厚间隔),则用MRI或CT增强扫描鉴别,如有任何内部强化,应怀疑有实质性病变。
3.3 鉴别诊断MLS脂肪成分含量较少,黏液基质丰富,部分病灶呈囊性表现,上述影像表现给本病诊断带来一定的困难,需与以下病变鉴别:①肌内黏液瘤,好发于中老年男性,CT及MRI平扫表现与囊肿类似,呈水样密度/信号,增强扫描多呈不均匀强化,强化区域占肿瘤体积百分比多小于MLS,肿瘤缺乏完整包膜,多向周围侵犯,引起邻近肌肉组织萎缩,同时不含成熟脂肪成分可与MLS鉴别[21]。②囊肿,MLS约20%与单纯囊肿表现相似,鉴别要点主要在于增强扫描是否有延迟强化,MLS延迟强化的病理基础为黏液基质内散在肿瘤细胞及分支状血管网。③神经源性肿瘤,多发生在神经根走行区,肿瘤推移或包绕神经生长,肿瘤两极可有神经出入征等特征性表现可与MLS区分。
3.4 治疗及预后目前MLS的主要治疗方式仍是手术完整切除,且常与化疗或辅助放射性治疗结合,尤其有不完全和/或边缘切除的病灶,与单纯手术切除相比可减少局部复发的可能性;但放化疗效果存在争议[22]。一项回顾性研究发现,与其他亚型脂肪肉瘤相比,MLS患者存活率显著延长,其10年生存率约77%[23]。有研究认为肿瘤直径超过10 cm的MLS预后差[24]。本病复发率为10.7%~38.0%,其中年龄大于45岁、男性、肿瘤内部出现坏死、P53过度表达、圆形细胞数目增加、肿瘤位置深度和肿瘤大小是MLS已知的不良预后因素[25]。与其他脂肪肉瘤不同,MLS通常在肺实质转移之前,表现出向骨、腹膜后、腋窝和其他软组织部位转移的独特模式[7, 26],由于肿瘤细胞分泌抑制成骨因子导致骨扫描对本病转移灶检出率较低,虽然CT对骨皮质侵犯敏感,但对骨髓受累观察受限,且CT软组织分辨力不高,对软组织内小转移灶检出价值不大。鉴于MLS肺外转移的显著特点,将转移筛查局限于临床随访和胸部成像可能导致大量早期转移瘤漏诊[27],2017年(National Comprehensive Cancer Network,NCCN)指南[28]建议对MLS分期时行胸部成像和腹部/骨盆CT检查及全身MRI检查,MRI无电离辐射危害,同时对早期骨髓浸润敏感,且对发现软组织内微小转移灶具有显著优势。及时诊断复发有助于提高患者生存率和生活质量。近年来关于MLS的相关基因研究认为未来有望通过基因靶点治疗延长患者的生存时间。
| [1] |
PIPERI E, TOSIOS K I, NIKITAKIS N G, et al. Well-differentiated liposarcoma/atypical lipomatous tumor of the oral cavity: report of three cases and review of the literature[J]. Head Neck Pathol, 2012, 6(3): 354-363. DOI:10.1007/s12105-011-0327-2 |
| [2] |
张朝晖, 孟悛非, 张小玲. 四肢黏液样脂肪肉瘤的MRI诊断[J]. 中华放射学杂志, 2007, 41(1): 66-68. DOI:10.3760/j.issn:1005-1201.2007.01.020 |
| [3] |
WORTMAN J R, TIRUMANI S H, JAGANNATHAN J P, et al. Primary extremity liposarcoma: MRI features, histopathology, and clinical outcomes[J]. J Comput Assist Tomogr, 2016, 40(5): 791-793. DOI:10.1097/RCT.0000000000000431 |
| [4] |
OZSEN M, YALCINKAYA U, YAZICI Z, et al. Lipomatous Tumors in Pediatric Patients: a Retrospective Analysis of 50 cases[J]. Turk Patoloji Derg, 2020, 36(1): 1-10. |
| [5] |
MCTIGHE S, CHERNEV I. Intramuscular lipoma: a review of the literature[J]. Orthop Rev (Pavia), 2014, 6(4): 5618. |
| [6] |
FUGLO H M, MARETTY-NIELSEN K, HOVGAARD D, et al. Metastatic pattern, local relapse, and survival of patients with myxoid liposarcoma: a retrospective study of 45 patients[J]. Sarcoma, 2013, 2013: 548-628. |
| [7] |
STEVENSON J D, WATSON J J, COOL P, et al. Whole-body magnetic resonance imaging in myxoid liposarcoma: a useful adjunct for the detection of extra-pulmonary metastatic disease[J]. Eur J Surg Oncol, 2016, 42(4): 574-580. DOI:10.1016/j.ejso.2015.12.011 |
| [8] |
ASANO N, SUSA M, HOSAKA S, et al. Metastatic Patterns of Myxoid/Round Cell Liposarcoma: a Review of a 25-Year Experience[J]. Sarcoma, 2012, 2012: 345161. |
| [9] |
BEN SAFTA Y, SOUAI F, MAATOUK M, et al. Myxoid esophageal liposarcoma: a case report of a rare tumor[J]. Int J Surg Rep, 2019, 60: 69-71. DOI:10.1016/j.ijscr.2019.04.001 |
| [10] |
SONODA A, SAWAYAMA H, MIYANARI N, et al. Giant myxoid liposarcoma of the stomach: report of a case[J]. Int J Surg Rep, 2019, 60: 234-238. DOI:10.1016/j.ijscr.2019.06.025 |
| [11] |
LEMEUR M, MATTEI J C, SOUTEYRAND P, et al. Prognostic factors for the Recurrence of myxoid liposarcoma: 20 cases with up to 8 years follow-up[J]. Orthop Traumatol Surg Res, 2015, 101(1): 103-107. DOI:10.1016/j.otsr.2014.09.024 |
| [12] |
ANTONESCU C R, TSCHERNYAVSKY S J, DECUSEARA R, et al. Prognostic impact of P53 Status, TLS-CHOP fusion transcript structure, and histological grade in myxoid liposarcoma a molecular and clinicopathologic study of 82 cases[J]. Clin Cancer Res, 2001, 7(12): 3977-3987. |
| [13] |
ABARICIA S, HIRBE AC. Diagnosis and treatment of myxoid liposarcomas: histology matters[J]. Curr Treat Options Oncol, 2018, 19(12): 64. DOI:10.1007/s11864-018-0590-5 |
| [14] |
SAITO T, AKAIKE K, KURISAKI-ARAKAWA A, et al. TERT promoter mutations are rare in bone and soft tissue sarcomas of Japanese patients[J]. Mol Clin Oncol, 2016, 4(1): 61-64. DOI:10.3892/mco.2015.674 |
| [15] |
KOELSCHE C, RENNER M, HARTMANN W, et al. TERT promoter hotspot mutations are recurrent in myxoid liposarcomas but rare in other soft tissue sarcoma entities[J]. J Exp Clin Cancer Res, 2014, 33(1): 33. DOI:10.1186/1756-9966-33-33 |
| [16] |
CAMPANELLA N C, PENNA V, ABRAHAO-MACHADO L F, et al. TERT promoter mutations in soft tissue sarcomas[J]. Int J Biol Markers, 2016, 31(1): e62-e67. DOI:10.5301/jbm.5000168 |
| [17] |
FERREIRA M S V, CRYSANDT M, BRAUNSCHWEIG T, et al. Presence of TERT promoter mutations is a secondary event and associates with elongated telomere length in myxoid liposarcomas[J]. Int J Mol Sci, 2018, 19(2): 608. DOI:10.3390/ijms19020608 |
| [18] |
ROH H S, LEE H E, PARK M H, et al. Subcutaneous myxoid and round cell liposarcoma[J]. Ann Dermatol, 2011, 23(3): 338-341. DOI:10.5021/ad.2011.23.3.338 |
| [19] |
MUJTABA B, WANG F, TAHER A, et al. Myxoid liposarcoma with skeletal metastases: pathophysiology and imaging ccharacteristics[J]. Curr Probl Diagn Radiol, 2021, 50(1): 66-73. DOI:10.1067/j.cpradiol.2019.10.008 |
| [20] |
SUNG M S, KANG H S, SUH J S, et al. Myxoid liposarcoma: appearance at MR imaging with histologic correlation[J]. Radiol Graphics, 2000, 20(4): 1007-1019. |
| [21] |
李绪斌, 侯岩, 叶兆祥. 黏液性脂肪肉瘤的CT、MRI表现[J]. 中国医学影像技术, 2013, 29(4): 628-631. |
| [22] |
张琦. 脂肪肉瘤预后相关因素探讨及基因检测的初步报告[D]. 南京: 南京医科大学, 2019.
|
| [23] |
FIORE M, GROSSO F, LO VULLO S, et al. Myxoid/round cell and pleomorphic liposarcomas[J]. Cancer, 2007, 109(12): 2522-2531. DOI:10.1002/cncr.22720 |
| [24] |
LANGMANS C, CORNILLIE J, VAN CANN T, et al. Retrospective analysis of patients with advanced liposarcoma in a tertiary referral center[J]. Oncol Res Treatment, 2019, 42(7-8): 396-404. |
| [25] |
GIMBER L H, MONTGOMERY E A, MORRIS C D, et al. MRI characteristics associated with high-grade myxoid liposarcoma[J]. Clin Radiol, 2017, 72(7): 613.e1-613.e6. DOI:10.1016/j.crad.2017.01.016 |
| [26] |
GORELIK N, REDDY S M V, TURCOTTE R E, et al. Early detection of metastases using whole-body MRI for initial staging and routine follow-up of myxoid liposarcoma[J]. Skeletal Radiol, 2018, 47(3): 369-379. DOI:10.1007/s00256-017-2845-9 |
| [27] |
SCHWAB J H, BOLAND P J, ANTONESCU C, et al. Spinal metastases from myxoid liposarcoma warrant screening with magnetic resonance imaging[J]. Cancer, 2007, 110(8): 1815-1822. DOI:10.1002/cncr.22992 |
| [28] |
KOH W J, GREER B E, ABU-RUSTUM N R, et al. Vulvar Cancer, Version 1.2017, NCCN clinical practice guidelines in oncolog[J]. J Nat Compr Canc Netw, 2017, 15(1): 92-120. DOI:10.6004/jnccn.2017.0008 |
 2021, Vol. 19
2021, Vol. 19


