| ADC值变化率早期预测食管鳞状细胞癌放化疗疗效的价值 |
2. 川北医学院附属医院放射科,四川 南充 637000
食管癌发现时多为中晚期,肿瘤切除难度大,预后差[1],多采用放化疗等新辅助疗法。所以在放化疗早期进行疗效评价,可提示临床及时有效改进治疗方案。DWI可通过ADC值监测食管癌放化疗疗效[2],对消化系统疾病有很好的应用价值[3-5]。本研究初步探讨ADC值变化率(△ADC)在早期预测食管鳞状细胞癌放化疗疗效中的价值,从而更好地指导临床治疗。
1 资料与方法 1.1 一般资料收集川北医学院附属医院2014年4月至2015年2月间经病理穿刺活检证实的食管鳞状细胞癌31例,其中男24例,女7例;年龄52~78岁,平均(63.61±8.22)岁。纳入标准:①无MRI检查禁忌证,治疗前2~3周、放疗11次、放疗32次复查MRI(包括常规序列和DWI,放疗时间点根据预实验结果确定)。②无严重呼吸、心、脑、肾等疾病。卡氏功能状态评分(KPS)≥70分。③MRI检查前未接受放化疗,均为初诊初治。排除标准:①精神异常及体内有金属异物无法行MRI检查者。②心血管介入支架治疗者。③适形或调强放疗中断6次以上或治疗期间改变治疗方式者。④放疗32次时,肿瘤基本消失、无法测量ADC值者。
1.2 治疗方案化疗:31例根据病情采取同期放化疗(3例)或辅助化疗(28例),化疗方案为FLP方案(F:5-氟尿嘧啶,L:亚叶酸钙,P:顺铂或奈达铂)。放疗:31例均采用调强放射治疗,每次原发病灶放射剂量1.8~2.0 Gy,每日照射1次,每周照射5次,总根治剂量55~60 Gy。
1.3 MRI扫描使用GE Discovery MR750 3.0 T超导MRI仪,32通道体部线圈。扫描范围:C7水平到膈下。行横断位、冠状位、矢状位扫描。BH AX-T1WI:TR 3.8 ms,TE 1.7 ms,层厚4.0 mm,层距1.0 mm,FOV 30 cm×30 cm~34 cm×34 cm,NEX 0.69,矩阵260×192。AX-FS T2WI:TR 3 158 ms,TE 85.4 ms,层厚4.0 mm,层距1.0 mm,FOV 36 cm×36 cm,NEX 2,矩阵260×192。DWI采用阵列空间敏感性编码技术在自由呼吸状态下扫描,单次激发平面回波成像序列,方位:轴位和矢状位;TR/TE 7 050 ms/6 080 ms,FOV 38 cm×38 cm~42 cm×42 cm,矩阵100×130,NEX 2,层厚4 mm,层距0.4 mm,b值选取800 s/mm2,应用心电门控及呼吸门控减少运动伪影。△ADC=(不同时间点肿瘤平均ADC值-治疗前肿瘤平均ADC值)/治疗前肿瘤平均ADC值×100%。
1.4 食管癌放疗疗效评价时间及评价标准放化疗结束(放疗32次)后依据WHO 2009年最新发布的《实体肿瘤疗效评价标准(RECIST)修订版(version 1.1)》[6]评价疗效:①完全缓解(CR),肿瘤完全消失;②部分缓解(PR),肿瘤最大径减小至30%;③病变进展(PD),肿瘤最大径增大20%;④病变稳定(SD),肿瘤体积变化介于PR和PD之间。将CR、PR定义为反应组,PD、SD定义为无反应组。
1.5 统计学分析运用SPSS 16.0统计软件进行数据处理,定量资料以x±s表示。2组比较行独立样本t检验;用ROC曲线法分析ADC、△ADC区分反应组和无反应组的诊断效能,确定最佳阈值、特异度、敏感度及曲线下面积;采用非条件Logistic回归分析筛查出影响疗效的独立预测因素。假设检验水准α为0.05。
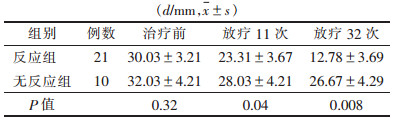
2 结果反应组21例(68%),无反应组10例(32%)。反应组(65.3岁)和无反应组(63.2岁)平均年龄差异无统计学意义(P>0.05)。2组各时间点肿瘤最大径比较见表 1。治疗前肿瘤最大径(轴位T2WI图像),2组差异无统计学意义(P>0.05)。反应组21例中14例肿瘤缩小(图 1),行手术治疗;7例由于远处转移最终采用放疗联合化疗。无反应组9例肿瘤未见缩小,决定采用第2周期放化疗方案。
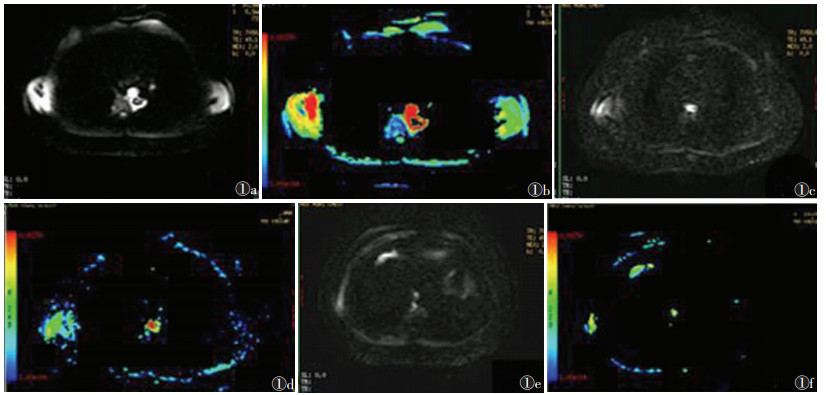 |
| 图 1 男,54岁,食管中段鳞状细胞癌,反应组治疗前后变化图 1a,1b分别为治疗前DWI和ADC图,食管癌DWI呈明显高信号,ADC图以红色区域为主图 1c,1d分别为放疗11次时DWI和ADC图,肿瘤最大径略缩小,ADC图以红色和蓝色为主图 1e,1f分别为放疗32次后DWI和ADC图,治疗结束肿瘤最大径明显缩小,DWI上高信号基本消失,ADC图以浅黄色为主 |
| 表 1 反应组与无反应组各时间点肿瘤最大径比较 |
 |
2.1 治疗前后2组的ADC值、△ADC值及ROC曲线分析结果
反应组治疗前、放疗11次、放疗32次ADC值分别为(1.431±0.046)×10-3、(1.874±0.313)×10-3、(2.009±0.380)×10-3 mm2/s,三者差异无统计学意义(P=0.052);无反应组3个时间点ADC值分别为(1.460±0.015)×10-3、(1.589±0.324)×10-3、(1.770±0.440)×10-3mm2/s,三者差异无统计学意义(P=0.051)。放疗11次时,反应组和无反应组ADC值的差异有统计学意义(P < 0.05)。放疗32次时,反应组和无反应组ADC值的差异有统计学意义(P <0.05)。
放疗11次的△ADC(△ADC11)反应组和无反应组分别为(31.54±15.573)%、(1.919±1.443)%。反应组△ADC11值比无反应组明显升高(P < 0.05)。放疗32次的△ADC值(△ADC32)反应组为(34.91±15.305)%,无反应组为(18.86±9.774)%,两者差异无统计学意义(P>0.05)。
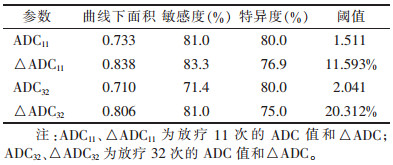
ADC与△ADC的ROC曲线分析见表 2。以△ADC11差异最明显,△ADC11鉴别2组ROC曲线下面积最大为0.838,其诊断效能最大,阈值为11.593%,敏感度为83.3%、特异度为76.9%(P < 0.05)(图 2)。
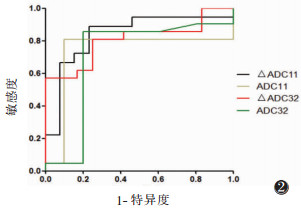 |
| 图 2 食管鳞状细胞癌反应组与无反应组ADC和△ADC的ROC曲线分析结果(ADC11、△ADC11为放疗11次的ADC值和△ADC;ADC32、△ADC32为放疗32次的ADC值和△ADC) |
| 表 2 2 组 ADC 和△ADC 的 ROC 曲线分析结果 |
 |
2.2 食管癌放化疗敏感性相关因素分析(表 3)
| 表 3 食管鳞状细胞癌放化疗相关性敏感分析因素 Logistic 回归分析结果 |
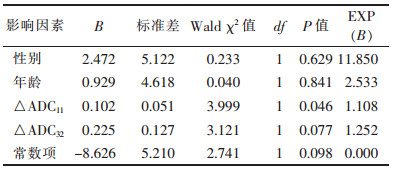 |
非线性Logistic回归分析显示,影响食管癌放化疗敏感性的相关因素为性别、年龄、△ADC11和△ADC32,其中△ADC11是影响食管癌放化疗敏感程度的独立预后因素,其相对风险度为1.108(P < 0.05)。
3 讨论免疫疗法、放化疗或单一的放疗、化疗都是食管癌的新辅助治疗方法。新辅助治疗方法,可用于无法切除的食管癌患者或延长患者生存期,降低肿瘤分期,提高肿瘤切除率[6-12]。早期评价放化疗疗效,有助于临床改进治疗方案,如可帮助对放化疗不敏感的患者,停止治疗改为最佳支持治疗(避免不必要的不良反应),也有利于改善食管癌的总体预后并降低治疗费用,也可掌握转为手术治疗的最佳时机,提高手术治疗例数。
DWI表现是区别正常组织与肿瘤组织的依据[11],两者之间有明显的扩散性差异。田华[13]研究显示,当b值为1 000 s/mm2时,正常食管癌组织ADC值为(2.06±0.34)×10-3mm2/s,食管肿瘤ADC值为(1.38±0.32)×10-3mm2/s。造成差异的主要原因[14]:①恶性肿瘤细胞繁殖旺盛,细胞密度较大,细胞外容积减少;②蛋白质对水分子吸附能力增强;③生物细胞膜结构的改变制约水分子扩散。而肿瘤在放化疗后,内部先发生病理生理学变化,即肿瘤细胞囊变、坏死、凋亡及缺氧改变,细胞密度减小,细胞膜完整性破坏消散,细胞外间隙增加,细胞内外水分子比例发生改变,ADC值升高,而后才出现形态学改变。因此,可在肿瘤形态学变化之前根据治疗前后ADC值变化进行早期疗效评价。当肿瘤细胞致密区域水分子扩散运动受限时,DWI信号升高,ADC值降低。
ADC值早期研究主要应用于中枢神经系统肿瘤的疗效评估及追踪。近几年,随着技术进步,ADC值用于食管癌诊断及临床分期、放疗靶区勾画及疗效评价等已有了初步研究[6-8]。ADC值能否作为早期监测肿瘤放化疗敏感性的指标成为探讨的热点。Harry等[15]对12例行放化疗的宫颈癌研究显示,治疗2周后的ADC值及其△ADC情况与肿瘤最终治疗效果密切相关。刘向一[16]研究显示,鼻咽癌新辅助化疗的第20天适合化疗疗效的早期评价,化疗第3天ADC值升高对早期预测放化疗疗效具有一定意义。也有研究[17]表明,肺癌化疗后第1周期△ADC可作为早期疗效评价的敏感性指标。但DWI用于食管癌疗效评价的研究较少,且选用的ADC指标及研究方法和最终结果都不相同。本研究显示2组△ADC11差异有统计学意义,其鉴别反应组和无反应组的最佳临界值为11.593%,其诊断敏感度、特异度及最大曲线下面积分别为83.3%、76.9%及0.838。治疗后ADC值升高越明显,肿瘤最大直径缩小率越明显,治疗效果越理想,所以△ADC11可监测肿瘤疗效,也可早期检测肿瘤治疗反应,指导临床采取个性化治疗,提早增加低敏感患者的剂量,或行第2个周期的放化疗,而对高敏感性患者适当减少不必要的剂量,可为手术治疗提供机会,从而提高患者生存时间和预后。
患者对放化疗的敏感性受诸多因素影响,如肿瘤的细胞内环境、病理类型、患者全身情况等。本研究通过非线性Logistic回归分析发现△ADC11是影响食管鳞状细胞癌放化疗敏感程度的独立预后因素,△ADC11越大,肿瘤对放化疗的敏感性越高(放疗32次结束后),预后越好,这与部分学者[17]报道一致。宋欣等[18]研究显示,食管鳞状细胞癌重要的预后因素有病变长度、病理类型及年龄,这些因素是5年总生存率的相关指标,食管鳞状细胞癌局部病变长度与患者局部复发率、总生存率及远处转移率明显相关。本研究因样本量偏小、随访时间短等,暂未发现年龄、性别与食管鳞状细胞癌放化疗敏感性有明显关联。本研究不足:①样本量相对较少,未对不同分化程度食管鳞状细胞癌的放化疗效果进行大量研究;②未对食管鳞状细胞癌进行进一步的预后生存分析,仅探讨食管鳞状细胞癌放化疗早期疗效评价。
总之,放疗11次时,△ADC11可作为评价食管鳞状细胞癌早期放化疗敏感性的独立预测因素和最佳指标,提示DWI可作为食管癌放化疗后有效评价方法,能指导临床制订个性化治疗方案。
| [1] |
Malthaner RA, Wong RK, Rumble RB, et al. Neoadjuvant or ad-juvant therapy for resectable esophageal cancer:a systematic rev-iew and meta-analysis[J]. BMC Med, 2004, 2: 35. DOI:10.1186/1741-7015-2-35 |
| [2] |
Nomori H, Mori T, Ikeda K, et al. Diffusion-weighted magnetic resonance imaging can be used in place of positron emission tomography for N staging of non-small cell lung cancer with fe-wer false-positive results[J]. J Thorac Cardiovasc Surg, 2008, 135: 816-822. DOI:10.1016/j.jtcvs.2007.10.035 |
| [3] |
Aoyagi T, Shuto K, Okazumi S, et al. Evaluation of ulcerative co-litis using diffusion-weighted imaging[J]. Hepatogastroenterology, 2010, 57: 468-471. |
| [4] |
Aoyagi T, Shuto K, Okazumi S, et al. Apparent diffusion coeffici-ent values measured by diffusion-weighted imaging predict che-moradiotherapeutic effect for advanced esophageal cancer[J]. Dig Surg, 2011, 28: 252-257. DOI:10.1159/000328770 |
| [5] |
Sakurada A, Takahara T, Kwee TC, et al. Diagnostic performance of diffusion-weighted magnetic resonance imaging in esophageal cancer[J]. Eur Radiol, 2009, 19: 1461-1469. DOI:10.1007/s00330-008-1291-4 |
| [6] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response eval-uation criteria in solid tumours:revised RECIST guideline (vers-ion 1.1)[J]. Eur J Cancer, 2009, 45: 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [7] |
Fiorica F, Di Bona D, Schepis F, et al. Preoperative chemoradio-therapy for oesophageal cancer:a systematic review and meta-analysis[J]. Gut, 2004, 53: 925-930. DOI:10.1136/gut.2003.025080 |
| [8] |
Greer SE, Goodney PP, Sutton JE, et al. Neoadjuvant chemoradi-otherapy for esophageal carcinoma:a meta-analysis[J]. Surgery, 2005, 137: 172-177. DOI:10.1016/j.surg.2004.06.033 |
| [9] |
Ando N, Kato H, Igaki H, et al. A randomized trial comparing postoperative adjuvant chemotherapy with cisplatin and 5-fluoro-uracil versus preoperative chemotherapy for localized advanced squamous cell carcinoma of the thoracic esophagus (JCOG9907)[J]. Ann Surg Oncol, 2012, 19: 68-74. DOI:10.1245/s10434-011-2049-9 |
| [10] |
Sjoquist KM, Burmeister BH, Smithers BM, et al. Survival after neoadjuvant chemotherapy or chemoradiotherapy for resectable oesophageal carcinoma:an updated meta-analysis[J]. Lancet On-col, 2011, 12: 681-692. |
| [11] |
McVeigh PZ, Syed AM, Milosevic M, et al. Diffusion Weighted MRI in cervical cancer[J]. Eur Radiol, 2008, 18: 1058-1064. DOI:10.1007/s00330-007-0843-3 |
| [12] |
张剑, 孙文泉, 刘恒山, 等. 食管癌三维适形放射治疗的临床研究[J]. 中国中西医结合影像学杂志, 2016, 14(6): 732-733. |
| [13] |
田华. 磁共振弥散加权成像在食管癌精确放疗及疗效评价中的应用价值[D]. 石家庄: 河北医科大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-11919-1011157524.htm
|
| [14] |
Kapliaa A, Kudriavtseva AG, Gorchev VF, et al. Na+-K+-ATPase activity in human colorectal carcinoma[J]. Ukr Biokhim Zh, 2006, 78: 142-148. |
| [15] |
Harry VN, Semple SI, Gilbert FJ, et al. Diffusion-weighted mag-netic resonance imaging in the early detection of response to chemoradiation in cervical cancer[J]. Gynecol Oncol, 2008, 111: 213-220. DOI:10.1016/j.ygyno.2008.07.048 |
| [16] |
刘向一. 磁共振扩散加权成像评价鼻咽癌放化疗早期疗效的价值研究[D]. 福州: 福建医科大学, 2014.
|
| [17] |
蒋洁智. 磁共振扩散加权成像在肺癌化疗早期疗效评价中的应用研究[D]. 昆明: 昆明医科大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10678-1013332652.htm
|
| [18] |
宋欣, 宋晖, 李红卫. 食管癌患者单纯放疗与同期放化疗的预后分析[J]. 肿瘤研究与临床, 2013, 25(6): 378-381. |
 2018, Vol. 16
2018, Vol. 16


