| MSCT动态增强扫描联合MPR在胃癌术前临床T分期中的应用 |
2. 北京协和医院放射科,北京 100730
胃癌居全世界恶性肿瘤发病率的第5位,死亡率居第2位[1-2];在我国其发病率仅次于肺癌,5年生存率20%~30%[3]。国际抗癌联盟和美国癌症联合委员会(UICC/AJCC)制定的第8版胃癌TNM分期系统[4],包括病理分期(pTNM分期)、临床分期(cTNM分期)和新辅助治疗后病理分期(ypTNM分期)三部分,该系统为精准的胃癌分期提供了诊断依据和理论指导,对治疗方案的合理选择和预后评估意义重大。本研究利用MSCT对胃癌患者术前行动态增强扫描及MPR,并与病理结果对照,以探讨MSCT动态增强扫描联合MPR在胃癌术前临床T分期(cT)中的应用价值。
1 资料与方法 1.1 一般资料收集2018年2月至2020年2月在青岛市中心医院和北京协和医院行腹部MSCT动态增强扫描的316例胃癌患者的临床资料,均行胃癌根治术并取得pT分期结果,其中男179例,女137例;年龄23~81岁,平均(58.6±10.7)岁。纳入标准:①术前排除其他器官远处转移;②术前未接受过其他治疗;③患者同意并能耐受胃癌根治术;④胃癌根治术于MSCT检查后2周内进行并取得病理结果;⑤MSCT检查前2周内无大出血、胃穿孔或梗阻等;⑥MSCT检查与之前的胃镜穿刺活检需间隔3 d以上。排除标准:①对山莨菪碱和/或碘对比剂过敏、禁忌者;②图像伪影大而影响cT分期判断者;③胃腔充盈不佳,影响cT分期判断者。
采用随机数字表法将316例分为实验组和对照组各158例。实验组行MSCT动态增强扫描及MPR;对照组仅行MSCT动态增强扫描。
1.2 仪器与方法使用Philips Brillance 128排256层螺旋CT机或Siemens Somatom Sensation 64层螺旋CT机。检查前患者需禁食 > 8 h,检查前30~60 min饮水500 mL,之后肌内注射山莨菪碱10~20 mg,检查前15 min再饮水500 mL。扫描范围自膈顶至耻骨联合水平。Philips 128排256层螺旋CT机扫描参数:120 kV,自动毫安技术(200~250 mAs),螺距0.938,准直0.625 mm×128;Siemens 64层螺旋CT机扫描参数:120 kV,200 mAs,螺距1.2,准直0.625 m×64;两设备的其余参数相同:层厚1.0 mm,层距1.0 mm,矩阵512×512。增强扫描对比剂采用欧乃派克或优维显,剂量1.5 mL/kg体质量,以3 mL/s的流率经肘正中静脉注射。采用小剂量测试法:先注入16 mL测试剂量,然后团注药物,行动脉期(峰值增强时间由小剂量测试确定)、门静脉期(动脉期后20 s)和平衡期(门静脉期后60 s)扫描。将原始数据调入后处理工作站行MPR,以病灶为中心分别行短轴位和长轴位MPR,重建层厚2 mm,层距1 mm。
1.3 胃癌cT分期的MSCT标准根据KIM[5]的理论及《胃癌诊疗规范》[6],参照第8版胃癌TNM分期系统[4],总结出胃癌cT分期的MSCT征象标准:cT1a期,胃壁内层黏膜无增厚或轻微增厚,呈线状强化,中层稍低密度带完整;cT1b期,中层稍低密度带内侧50%的区域异常强化;cT2期,中层稍低密度带外侧50%的区域异常强化,但未达胃壁外缘浆膜面;cT3期,异常强化区累及胃壁外缘浆膜面,但浆膜面光滑,且周围脂肪间隙清晰;cT4a期,胃壁浆膜面结节状异常强化和/或胃周脂肪间隙内可见索条状高密度影,但与邻近结构无接触或接触面较小;cT4b期,癌灶与邻近器官的接触面较大,或直接侵犯邻近器官致其形态和/或强化异常。
1.4 图像分析由3位高年资腹部影像科医师采用双盲法分别分析2组图像。采用少数服从多数的原则,得出MSCT的cT分期结果。
1.5 统计学处理采用SPSS 22.0软件进行统计学分析。MSCT的cT分期与术后pT分期结果一致性分析采用Kappa一致性检验,0.75<K≤1为两者一致性较好,0.4<K≤0.75为一致性一般,0<K≤0.4为一致性较差。计数资料用百分比表示,组间比较采用四格表χ2检验,当n≥40、T≥5时,采用Pearson χ2检验;当n≥40、1≤T<5时,采用连续校正χ2检验。以P<0.05为差异有统计学意义。
2 结果 2.1 2组性别差异对比实验组158例中,男91例,女67例;对照组158例中,男88例,女70例;2组性别差异无统计学意义(χ2=0.116,P=0.733)。
2.2 胃癌的组织类型及发生部位316例中,腺癌300例,其中高分化14例、中-高分化29例、中分化74例、中-低分化87例、低分化96例,腺鳞癌6例,印戒细胞癌3例,黏液腺癌7例。胃窦癌198例,贲门癌85例,胃体癌33例。
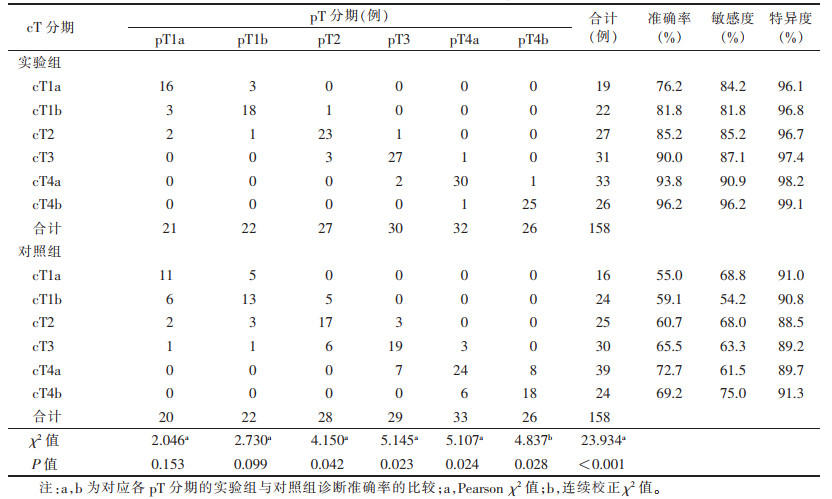
2.3 2组胃癌cT分期的诊断准确率比较实验组pT1a期21例(图 1),pT1b期22例(图 2),pT2期27例(图 3),pT3期30例(图 4),pT4a期32例(图 5),pT4b期26例(图 6);对照组pT1a期20例,pT1b期22例,pT2期28例,pT3期29例,pT4a期33例,pT4b期26例。术前cT分期与术后pT分期统计结果见表 1,实验组cT分期与pT分期的结果一致性良好(K=0.855,P=0.031),对照组cT分期与pT分期的结果一致性一般(K=0.571,P=0.046)。实验组和对照组胃癌cT分期的总体准确率分别是88.0%(139/158)和64.6%(102/158),2组差异有统计学意义(χ2=23.934,P<0.001)。对cT1a期和cT1b期,实验组和对照组准确率比较差异均无统计学意义(均P > 0.05);对cT2、cT3、cT4a、cT4b期,实验组诊断准确率均明显高于对照组,差异均有统计学意义(均P<0.05)。
 |
| 图 1 男,61岁,胃窦中-低分化腺癌(pT1a期)。门脉期病灶短轴位示:线条状强化的病灶外缘细线状更低密度(白箭)连续,术前诊断cT1a期 |
 |
| 图 2 男,73岁,胃窦表浅凹陷型中-低分化腺癌(pT1b期)。门脉期病灶短轴位示:条状强化的病灶外缘细线状更低密度影(白箭)局部中断,术前诊断cT1b期 |
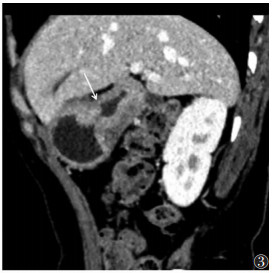 |
| 图 3 女,63岁,胃窦溃疡型中-低分化腺癌(pT2期)。门脉期病灶长轴位示:强化的病灶侵及中层稍低密度带的外侧50%(白箭),术前诊断cT2期 |
 |
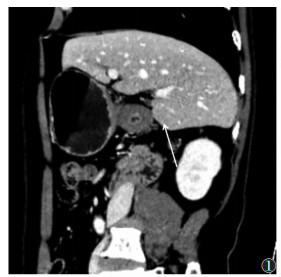
| 图 4 女,72岁,胃小弯溃疡型中-低分化腺癌(pT3期)。门脉期病灶短轴位示:强化区达外缘浆膜面(白箭),术前诊断cT3期 |
 |
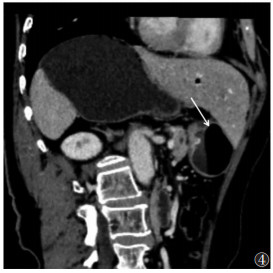
| 图 5 女,70岁,胃小弯溃疡型低分化腺癌(pT4a期)。门脉期病灶长轴位示:胃后壁浆膜侧高强化亮线征(白箭),术前诊断cT4a期 |
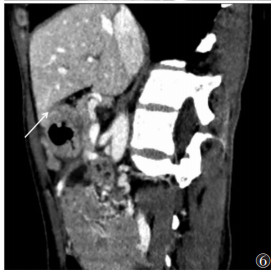 |
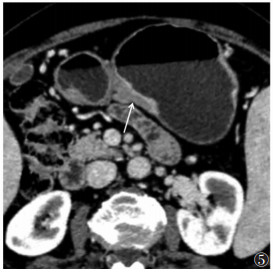
| 图 6 女,53岁,胃窦溃疡型低分化腺癌(pT4b期)。动脉期病灶短轴位示:邻近肝脏后下缘斑片状明显强化(白箭),术前诊断cT4b期 |
| 表 1 2组术前临床分期(cT分期)与病理分期(pT分期)结果对照 |
 |
3 讨论
第8版胃癌TNM分期系统是国际通用的胃癌分期系统,其参考数据来源于美国国家癌症数据库和日本静冈癌症中心的4 091例胃癌患者资料[4],新增的cT分期系统是精准的胃癌治疗方案和病理分期的桥梁。新的cT分期将肿瘤的侵犯深度分为3个等级(cT1~cT2、cT3~cT4a、cT4b)[4],但有学者[7-8]认为,这种分级方法导致术前cT分期诊断准确率降低。一项来自韩国的研究[9]发现,在新版cT分期指导下,MSCT对pT分期的判断能力未显著提高。因此,本研究中胃癌的cT分期仍借鉴pT分期标准。病理学中,正常胃壁可分为5层结构:黏膜层、黏膜下层、固有肌层、浆膜下层和浆膜层。肿瘤细胞可在胃黏膜下层浸润并纤维组织增生,这是癌变的胃壁在MSCT动态增强扫描图像中呈分层表现的病理生理基础[10],因此,如何清晰显示胃壁的5层结构是MSCT对胃癌术前cT分期研究的重点。
在MSCT规范操作[11]的前提下,MPR的应用能够很好地消除部分容积效应的影响,可更准确地观察肿瘤侵犯胃壁的深度,在判断是否侵犯周围脏器及邻近血管时作用更大。CHEN等[12]报道,应用MPR,胃癌cT分期的总体准确率可提高到89%。JOO等[13]报道,MPR可将MSCT对胃癌cT分期的总体准确率提高8%。LEE等[14]报道,联合MPR和仿真内镜技术可鉴别黏膜内癌(cT1a)和黏膜下癌(cT1b、cT2)。本研究应用MPR将胃癌cT分期的总体准确率从64.6%提高至88.0%;大大提高了cT2~cT4b期的诊断准确率,尤其在cT4b期,准确率提高了27.0%;cT分期与pT分期的结果一致性良好(K=0.855,P=0.031)。
胃癌是一种相对乏血供的肿瘤,90%以上为腺癌,多表现为胃壁的局部增厚和异常强化。胃癌cT分期的MSCT征象标准,目前尚未统一。KIM等[5]对胃癌的MSCT征象及其离体病理标本对照研究发现,病理中黏膜下层与固有肌层的厚度大体相当,从而推断CT图像的中层稍低密度带内侧50%是黏膜下层,外侧50%是固有肌层;但本研究中1例pT1a期患者,MPR图像可见癌灶与中层稍低密度带之间有一连续的细线状低密度,对照病理结果,考虑本例的中层稍低密度带是固有肌层,细线状低密度是黏膜下层,且固有肌层的厚度明显大于黏膜下层,这与KIM等[5]报道不符。本研究固有肌层厚度明显大于黏膜下层,但固有肌层未被癌组织侵犯的原因,可能是癌组织沿肌层的纤维束巢状浸润所致,但这种浸润并不破坏肌层的组织结构[15]。
在胃壁的5层结构中,黏膜层血管最丰富,因此,内层黏膜最先明显强化,本研究发现对cT1a期和cT1b期的腺癌在动脉晚期观察最佳,癌灶外缘的低密度线中断可作为判断侵犯黏膜下层的直接征象。中层稍低密度带发现异常强化时,可诊断为cT1b、cT2或cT3期,当异常强化局限在稍低密度带的内侧50%时判断为cT1b期,超过外侧50%且未达浆膜面时判断为cT2期,异常强化到达浆膜面时判断为cT3期。正常胃壁的浆膜层菲薄,主要由上皮细胞构成,间杂少量结缔组织,强化最晚且最不明显,当浆膜侧出现高强化亮线征[16]时,可判断为cT4a期,且该征象判断cT4a期胃癌的准确率、敏感度和特异度分别为77.88%、81.43%和70.59%,门静脉期或平衡期观察此征象最佳。肿瘤周围脂肪间隙内的炎性反应可导致浆膜面毛糙、周围脂肪间隙内条索影,还可因局部组织收缩,导致病灶与邻近结构分界不清,易将cT4a期误判为cT4b期。对于胃癌与邻近器官小面积接触或仅有脂肪间隙消失者,多数实际并无侵犯邻近结构[17],因此唐磊[11]指出该征象应判断为cT4a期。在MRI梯度回波序列上,正常胃壁的浆膜层与胃周脂肪间可见细线状低信号带,此低信号带的中断可作为判断侵犯浆膜的标准[18]。此外,最近的国内研究[19]称,能谱CT检查中,手动勾画肿瘤轮廓法测量病灶的静脉期标准化碘浓度值与术后癌组织微血管密度有高度相关性(r=0.670,P<0.001),能间接反映肿瘤的微血管产生情况,对胃癌cT分期的研究提供了理论依据。
综上所述,在第8版胃癌TNM分期系统指导下,胃癌cT分期的MSCT征象虽有一定的特征,但该标准尚不统一,有待进一步研究;MSCT动态增强扫描联合MPR对胃癌进行cT分期与pT分期有良好的一致性,可提高胃癌术前cT分期的准确率。
| [1] |
WANG S, ZHOU M, JI A, et al. Milk/dairy products consumption and gastric cancer:an update meta-analysis of epidemiological studies[J]. Oncotarget, 2017, 9(6): 7126-7135. |
| [2] |
TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [3] |
TSOI K K, HIRAI H W, CHAN F C. Cancer burden with ageing population in urban regions in China:projection on cancer registry data from World Health Organization[J]. Br Med Bull, 2017, 121(1): 83-94. DOI:10.1093/bmb/ldw050 |
| [4] |
AMIN M B, EDGE S B, GREENE F L, et al. AJCC cancer staging manual[M]. 8th Ed. New York: Springer, 2016: 203-220.
|
| [5] |
KIM Y N, CHOI D, KIM S H, et al. Gastric cancer staging at isotopic MDCT including coronal and sagittal MPR images:endoscopically diagnosed early vs. advanced gastric cance[J]. Abdom Imaging, 2009, 34(1): 26-34. DOI:10.1007/s00261-008-9380-z |
| [6] |
国家卫生健康委员会.胃癌诊疗规范(2018年版)[J/CD].肿瘤综合治疗电子杂志, 2019, 5(1): 55-82.
|
| [7] |
IN H, SOLSKY I, PALIS B, et al. Validation of the 8th edition of the AJCC TNM staging system for gastric cancer using the National Cancer Database[J]. Ann Surg Oncol, 2017, 24(12): 3683-3691. DOI:10.1245/s10434-017-6078-x |
| [8] |
FUKAGAWA T, KATAI H, MIZUSAWA J, et al. A prospective multi-institutional validity study to evaluate the accuracy of clinical diagnosis of pathological stage Ⅲ gastric cancer (JCOG1302A)[J]. Gastric Cancer, 2018, 21(1): 68-73. DOI:10.1007/s10120-017-0701-1 |
| [9] |
JEONG O, JUNG M R, KANG J H, et al. Prognostic performance of preoperative staging:assessed by using multidetector computed tomography-between the new clinical classification and the pathological classification in the eighth American Joint Committee on Cancer classification for gastric carcinoma[J]. Ann Surg Oncol, 2020, 27(2): 545-551. DOI:10.1245/s10434-019-07845-3 |
| [10] |
钟宝元, 刘艳秀, 黄文峰, 等. 64层CT三期动态增强扫描对胃癌术前TNM分期的判断价值[J]. 中华胃肠外科杂志, 2012, 15(7): 706-709. |
| [11] |
唐磊. 国际抗癌联盟及美国癌症联合会胃癌TNM分期系统(第8版)影像相关更新解读[J]. 中华放射学杂志, 2017, 51(8): 636-637. |
| [12] |
CHEN C Y, HSU J S, WU D C, et al. Gastric cancer:preoper-ative local staging with 3D multi-detector row CT--correlation with surgical and histopathologic results[J]. Radiology, 2007, 242(2): 472-482. DOI:10.1148/radiol.2422051557 |
| [13] |
JOO I, LEE J, KIM J H, et al. Prospective comparison of 3T MRI with diffusion-weighted imaging and MDCT for the preoperative TNM staging of gastric cancer[J]. J Magn Reson Imaging, 2015, 41(3): 814-821. DOI:10.1002/jmri.24586 |
| [14] |
LEE I J, LEE J M, KIM S H, et al. Diagnostic performance of 64-channel multidetector CT in the evaluation of gastric cancer:differentiation of mucosal cancer(T1a) from submucosal involve-ment(T1b and T2)[J]. Radiology, 2010, 255(3): 805-814. DOI:10.1148/radiol.10091313 |
| [15] |
曹晖, 刘骅, 陆明辉, 等. 多层螺旋CT在胃癌术前分期中的临床应用[J]. 中华胃肠外科杂志, 2007, 10(4): 346-349. |
| [16] |
张梦梅, 杨泠, 危春容, 等. CT浆膜高强化征鉴别诊断T3期与T4a期胃癌[J]. 中国医学影像技术杂志, 2019, 35(9): 1361-1364. |
| [17] |
唐磊, 李子禹, 付佳, 等. 胃癌侵犯胰腺的CT影像学特征及在原发灶可切除性判断中的意义[J]. 中华消化外科杂志, 2017, 16(3): 304-309. |
| [18] |
贾守强, 王锦玲, 李庆国, 等. 胃癌磁共振成像术前TNM分期的临床应用价值[J]. 中华消化病与影像杂志(电子版), 2013, 3(4): 168-173. |
| [19] |
陈小华, 李佳音, 李莉明, 等. 感兴趣区选择对胃癌能谱CT测量结果可重复性的影响及与微血管密度的关系[J]. 中华放射学杂志, 2018, 52(1): 24-29. |
 2020, Vol. 18
2020, Vol. 18


