| MR高分辨血管壁成像技术在预测缺血性脑卒中中的应用价值 |
2. 暨南大学附属珠海医院/珠海市人民医院神经外科, 广东 珠海 519000
缺血性脑卒中(ischemic stroke,IS)的发生与颅内动脉粥样硬化密切相关,常因易损斑块破裂,诱发局部凝血反应堵塞血管而引起[1-2]。斑块内出血、大的坏死脂质核、薄纤维帽等不稳定因素会增加斑块破裂的风险[3-4],判断斑块性质是临床治疗和优化管理的关键。MR高分辨血管壁成像(high resolution vessel wall imaging,HRVWI)是目前评估管壁结构和斑块特征的一种最有效的无创性方法。多项研究表明,颅内动脉斑块强化可能与IS的发生相关[5-6],尽管T2WI序列对识别斑块成分具有一定价值[7-8],但其信号特征与急性脑梗死发生的相关性仍需深入研究。本研究旨在通过HRVWI技术分析颅内动脉粥样硬化斑块T2WI序列和增强扫描信号特征,探讨其与急性脑梗死发生之间的关系。
1 资料与方法 1.1 一般资料回顾性分析2018年1月至2020年12月我院诊治的IS患者42例,男29例,女13例;年龄26~76岁,平均(51.7±14.5)岁;伴高血压24例,糖尿病11例,高脂血症22例。
纳入标准:①发病后1周内完成HRVWI检查;②至少存在1个以上动脉粥样硬化的高危因素,如高血压、糖尿病、高脂血症、吸烟等。排除标准:①患有非动脉粥样硬化性疾病、烟雾病、动脉炎、动脉夹层等;②存在房颤、深静脉血栓等心源性栓塞者;③MRI图像质量差或扫描序列不完整者。
根据DWI上是否有高信号分为急性脑梗死组(20例)和非急性脑梗死组(22例)。收集2组的一般临床资料:吸烟史(过去6个月以上连续每天至少吸烟1支,且发病前未戒烟)、饮酒史(连续1年以上每个月至少饮酒2次),以及是否患有高血压、糖尿病、高脂血症(本次入院前已确诊)等。
1.2 仪器与方法采用GE 750W 3.0 T超导型MRI扫描仪,24通道头颈联合线圈。所有患者均完成常规颅脑MRI平扫(T1WI、T2WI及DWI)、MRA及HRVWI。HRVWI扫描序列与参数:①T1-CUBE fs序列,TR 600 ms,TE 17 ms,视野200 mm×200 mm,层厚0.6 mm,无间隔,激励次数2,带宽62.5 Hz/PX;②T2WI序列,TR 2 795 ms,TE 123 ms,视野180 mm×180 mm,层厚2 mm,无间隔,激励次数4,带宽25 Hz/PX;③增强扫描对比剂选用Gd-DTPA,剂量0.1 mmol/kg体质量,延迟4~5 min行相同参数的3D T1-CUBE增强扫描。
1.3 图像分析由2名放射科高年资医师采用盲法对斑块信号特征行独立阅片分析,并对颈内动脉、大脑中动脉M1段及椎基底动脉进行评判,意见有分歧时经协商达成一致。在MRA图像上先确定动脉狭窄部位,再结合多体位HRVWI检查确定斑块位置。平扫斑块信号以同层面胸锁乳突肌或脑灰质为参考标准,T2WI序列上斑块信号分2个等级:高信号和等低信号。增强扫描强化程度以正常血管壁及垂体柄信号为参照分3个等级:①无强化,即强化程度低于或等于正常血管壁;②轻度强化,即强化程度低于垂体柄并高于无强化组;③明显强化,即强化程度大于或等于垂体柄[9-10]。
1.4 统计学方法采用SPSS 23.0软件进行统计学分析。计量资料以x±s表示,行独立样本t检验,2组间强化程度比较行两独立样本非参数检验;计数资料以例(%)表示,采用χ2检验。急性脑梗死的独立危险因素分析采用二元Logistic回归分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 2组临床基线资料比较(表 1)| 表 1 2组临床基线资料比较 |
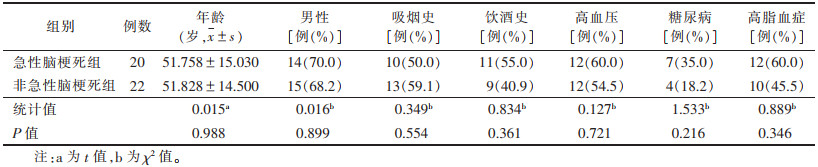 |
42例中,脑动脉粥样硬化最常见的危险因素是高血压,其次高脂血症和糖尿病。2组基本临床特征比较差异均无统计学意义(均P > 0.05)。
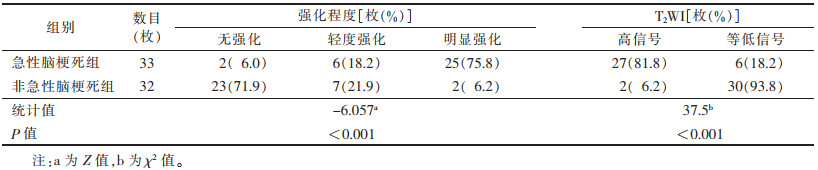
2.2 斑块特征42例共检出65枚斑块。急性脑梗死组20例,共33枚斑块(前循环21枚,后循环12枚),梗死灶位于放射冠或基底节区9例(图 1),颞叶或颞顶叶3例,脑干4例,小脑半球4例。非急性脑梗死组22例(图 2),共32枚斑块(前循环27枚,后循环5枚)。2组斑块位置差异无统计学意义(χ2=3.618,P=0.057)。急性脑梗死组的斑块T2WI信号和强化程度均显著高于非急性期脑梗死组,差异均有统计学意义(均P < 0.05);且急性脑梗死组的颅内动脉粥样硬化斑块多呈明显强化,而非急性脑梗死组多无明显强化(表 2)。二元Logistic回归分析显示,斑块T2WI高信号、明显强化是急性期脑梗死的独立危险因素(OR=16.41,P=0.004;OR=30.67,P=0.003)。
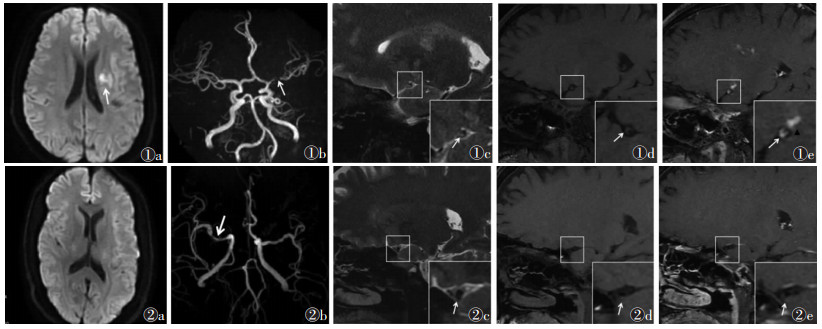 |
| 图 1 男,34岁,因“右侧肢体无力”入院 图 1a DWI序列显示左侧放射冠区斑片状高信号(白箭) 图 1b MRA示左侧大脑中动脉M1段局限性狭窄(白箭) 图 1c MR高分辨血管壁成像,选取管腔狭窄层面横轴位可见偏心性增厚斑块内部T2WI高信号(白箭) 图 1d T1WI序列上斑块呈等信号(白箭) 图 1e 高分辨血管壁成像增强扫描斑块明显强化(白箭),对应供血区域腔隙性脑梗死呈斑点状明显强化(黑三角) 图 2 男,54岁,因“头晕、恶性呕吐,肢体无力”入院 图 2a DWI序列未见高信号 图 2b MRA示右侧大脑中动脉M1段局限性狭窄(白箭) 图 2c 高分辨血管壁成像显示偏心性增厚斑块内部T2WI呈低信号(白箭) 图 2d T1WI序列上斑块呈等信号(白箭) 图 2e 高分辨血管壁成像增强扫描显示斑块无强化(白箭) |
| 表 2 2组斑块强化程度及T2WI信号特征比较 |
 |
3 讨论
IS发病率高、易致残或致死,且发病有逐渐年轻化的趋势,是我国致残和死亡的主要原因[11]。据统计,我国IS患者中颅内动脉粥样硬化性疾病的发生率约46.6%[12],及早识别斑块的特征、定性高危斑块对临床诊治具有重要意义。近年来,HRVWI技术在定性和定量评估斑块成分方面显示出巨大潜力。但斑块成分复杂多样,易损斑块的病理组织学类型较多[13],加之不同序列的斑块信号各异,因此,准确识别颅内斑块的易损性、并有效预测急性脑梗死的发生仍存在挑战。
本研究显示,急性脑梗死组T2WI序列高信号斑块所占比例(81.8%)明显高于非急性期脑梗死组(6.2%),且斑块T2WI高信号是急性脑梗死的独立危险因素(OR=16.41,P=0.004),表明评估斑块的T2WI信号特征可较好地预测急性脑梗死的发生,斑块T2WI呈高信号时易发生急性脑梗死。研究显示,脑动脉粥样硬化斑块的T2WI信号特征与斑块成分有关,T2WI呈高或混杂信号更多见于急性脑梗死患者[14-15]。较为新鲜或近期内发生的斑块内出血T2WI常呈高信号,推测与斑块内新生血管或管壁外膜滋养血管破裂、局部出血或诱发血栓形成时,在一定时间窗范围内呈现出细胞外高铁血红蛋白状态有关[15-16];同时,破裂的斑块中具有更丰富的巨噬细胞来扩展坏死核心;上述因素均会增加斑块的不稳定性或加速易损斑块的进展,导致IS发生的风险升高。另外,已有病理证实位于斑块脂质核表面、邻近管腔的带状纤维帽在T2WI上亦呈高信号[17],薄纤维帽或破裂的纤维帽是易损斑块的一种特征,其状态对维持斑块的稳定性具有重要作用,但对以钙化为主型易损斑块、陈旧性血栓性斑块等,T2WI则以低信号为主,这可能会出现假阴性结果,因此,此类患者还需紧密结合其他序列进行观察。
IS斑块强化特征是动脉粥样硬化性病变发生发展的重要反映。本研究中非急性脑梗死患者斑块多无明显强化,而急性脑梗死患者以明显强化为主,后者的斑块强化程度明显高于前者,提示动脉粥样硬化斑块的强化程度与斑块稳定性呈负向关联性可能。本研究结果显示,斑块明显强化是急性期脑梗死的独立危险因素(OR=30.67,P=0.003);可能的原因有:①急性脑梗死患者的斑块内新生血管增加;②局部炎症反应较明显;③内皮细胞的通透性增加,使对比剂外渗聚集增加[18-19]。本研究与Lu等[20]研究结果相似,均认为强化程度与卒中事件具有相关性。因此,高分辨血管壁增强扫描的明显强化是不稳定斑块的影像学特征之一。
本研究的局限性:样本量较小,有待增加;由于脑动脉管壁病变较小,对强化程度的评估未进行定量分析;未对斑块负荷等指标进行评估,需在今后深入研究。
综上所述,MR HRVWI T2WI序列联合增强扫描可很好地显示颅内动脉粥样硬化斑块的信号特征,是有效预测急性脑梗死发生的重要影像学指标。
| [1] |
NAGHAVI M, LIBBY P, FALK E, et al. From vulnerable plaque to vulnerable patient: a call for new definitions and risk assessment strategies: Part Ⅰ[J]. Circulation, 2003, 108(14): 1664-1672. DOI:10.1161/01.CIR.0000087480.94275.97 |
| [2] |
赵鑫, 夏章勇, 王晓婷, 等. 高分辨率磁共振评价颅内动脉粥样硬化性疾病的研究进展[J]. 中华老年心脑血管病杂志, 2017, 19(11): 1220-1223. DOI:10.3969/j.issn.1009-0126.2017.11.027 |
| [3] |
CAI J, HATSUKAMI T S, FERGUSON M S, et al. In vivo quantitative measurement of intact fibrous cap and lipid-rich necrotic core size in atherosclerotic carotid plaque: comparison of high-resolution, contrast-enhanced magnetic resonance imaging and histology[J]. Circulation, 2005, 112(22): 3437-3444. DOI:10.1161/CIRCULATIONAHA.104.528174 |
| [4] |
BENTZON J F, OTSUKA F, VIRMANI R, et al. Mechanisms of plaque formation and rupture[J]. Circ Res, 2014, 114(12): 1852-1866. DOI:10.1161/CIRCRESAHA.114.302721 |
| [5] |
WANG E L, Shao S, Li S, et al. A high-resolution MRI study of the relationship between plaque enhancement and ischemic stroke events in patients with intracranial atherosclerotic stenosis[J]. Front Neurol, 2019, 9(8): 1154. |
| [6] |
GUPTA A, BARADARAN H, Al-DASUQI K, et al. Gadolinium enhancement in intracranial atherosclerotic plaque and ischemic stroke: a systematic review and meta-analysis[J]. J Am Heart Assoc, 2016, 5(8): 3816. |
| [7] |
LEE H N, RYU C W, YUN S J. Vessel-wall magnetic resonance imaging of intracranial atherosclerotic plaque and ischemic stroke: a systematic review and meta-analysis[J]. Front Neurol, 2018, 9(3): 1032. |
| [8] |
SERFATY J M, CHAABANE L, TABIB A, et al. Atherosclerotic plaques: classification and characterization with T2-weighted high-spatial-resolution MR imaging——an in vitro study[J]. Radiology, 2001, 219(2): 403-410. DOI:10.1148/radiology.219.2.r01ma15403 |
| [9] |
MANDELL D M, MOSSA-BASHA M, QIAO Y, et al. Intracranial vessel wall MRI: principles and expert consensus recommendations of the American Society of Neuroradiology[J]. AJNR Am J Neuroradiol, 2017, 38(2): 218-229. DOI:10.3174/ajnr.A4893 |
| [10] |
QIAO Y, ZEILER S R, MIRBAGHERI S, et al. Intracranial plaque enhancement in patients with cerebrovascular events on high-spatial-resolution MR images[J]. Radiology, 2014, 271(2): 534-542. DOI:10.1148/radiol.13122812 |
| [11] |
李栋学, 王荣品. 缺血性脑卒中关键问题与影像学方法选择[J]. 中国中西医结合影像学杂志, 2020, 18(5): 431-435. DOI:10.3969/j.issn.1672-0512.2020.05.001 |
| [12] |
WANG Y, ZHAO X, LIU L, et al. Prevalence and outcomes of ymptomatic intracranial large artery stenoses and occlusions in China: the Chinese Intracranial Atherosclerosis (CICAS) Study[J]. Stroke, 2014, 45(3): 663-669. DOI:10.1161/STROKEAHA.113.003508 |
| [13] |
FALK E, SHAH P K, FUSTER V. Coronary plaque disruption[J]. Circulation, 1995, 92(3): 657-671. DOI:10.1161/01.CIR.92.3.657 |
| [14] |
张丹凤, 陈慧铀, 张卫东, 等. 高分辨率磁共振大脑中动脉粥样硬化斑块的分布及信号特点与脑梗死的关系[J]. 磁共振成像, 2017, 8(1): 4-7. |
| [15] |
YU Y N, LIU M W, VILLABLANCA J P, et al. Middle cerebral artery plaque hyperintensity on T2-weighted vessel wall imaging is associated with ischemic stroke[J]. AJNR Am J Neuroradiol, 2019, 40(11): 1886-1892. |
| [16] |
荆彦平, 张俊, 高峥嵘, 等. 不同期别脑出血MRI诊断及信号变化特点[J]. 脑与神经疾病杂志, 2016, 24(6): 376-381. |
| [17] |
MAJIDI S, SEIN J, WATANABE M, et al. Intracranial-derived atherosclerosis assessment: an in vitro comparison between virtual histology by intravascular ultrasonography, 7 T MRI, and histo-pathologic findings[J]. AJNR Am J Neuroradiol, 2013, 34(12): 2259-2264. DOI:10.3174/ajnr.A3631 |
| [18] |
CHEN X Y, WONG K S, LAM W W, et al. Middle cerebral artery atherosclerosis: histological comparison between plaques associated with and not associated with infarct in a postmortem study[J]. Cerebrovasc Dis, 2008, 25(1-2): 74-80. DOI:10.1159/000111525 |
| [19] |
ABE A, SEKINE T, SAKAMOTO Y, et al. Contrast-enhanced high-resolution MRI for evaluating time course changes in middle cerebral artery plaques[J]. J Nippon Med Sch, 2018, 85(1): 28-33. DOI:10.1272/jnms.2018_85-4 |
| [20] |
LU S S, GE S, SU C Q, et al. Plaque distribution and characteristics in low-grade middle cerebral artery stenosis and its clinical relevance: a 3-dimensional high-resolution magnetic resonance imaging study[J]. J Stroke Cerebrovasc Dis, 2018, 27(8): 2243-2249. DOI:10.1016/j.jstrokecerebrovasdis.2018.04.010 |
 2021, Vol. 19
2021, Vol. 19


