| 耳甲穴迷走神经持续刺激对无先兆偏头痛患者大脑比率低频振幅的影响 |
2. 广州中医药大学第二临床医学院,广东 广州 510405
无先兆偏头痛(migraine without aura,MWoA)为最常见的偏头痛亚型,是一种复发性神经系统疾病,具有反复发作、疼痛程度重且持续时间长的特点,严重影响患者的工作和生活,并造成极大的经济负担[1]。耳穴疗法是对耳廓上特定区域进行刺激,通过患者自身调节功能防治疾病,临床治疗偏头痛具有良好的疗效。而耳廓上内脏相应部位的反应点均在迷走神经耳支的分布区内,耳穴疗法的治疗机制与迷走神经关系密切。本研究应用大脑低频振荡幅度(amplitude of lowfrequency fluctuation,ALFF)分析耳穴迷走神经刺激状态下MWoA患者脑区局部神经元的活动变化,以评估耳穴迷走神经刺激对MWoA患者脑功能的影响。
1 资料与方法 1.1 研究对象采用随机自身交叉对照,将招募的MWoA患者(27例)分为A组(15例)与B组(12例),A组先接受耳穴迷走神经持续刺激,1周后接受非迷走神经持续刺激;B组先接受非迷走神经持续刺激,1周后接受耳穴迷走神经持续刺激。所有患者均知情同意,本研究经广州中医药大学第二附属医院伦理委员会批准。
MWoA的诊断标准符合国际头痛分类标准(ICHD-II):①头痛(未经治疗)发作持续4~72 h;②至少有以下特征中的2项,单侧性、搏动性、中重度疼痛、日常活动加重;③至少有以下1项伴随症状,恶心和(或)呕吐、畏光和畏声;④不能归因于其他。符合①~③,至少发作5次。
纳入标准:①符合MWoA的诊断标准;②就诊前3个月头痛发作≥6次,1次≤每月发作次数≤6次;③年龄18~45岁;④右利手;⑤近3个月未服用精神类药物及血管活性药物,近1个月未接受电针治疗或其他预防性治疗,无长期服用镇痛药物习惯;⑥无MRI检查禁忌证;⑦签署知情同意书。
排除标准:①其他疾病引起的头痛或特殊类型偏头痛;②试验前48 h内、试验过程中偏头痛发作者;③妊娠或哺乳期妇女;④严重头部畸形或颅内病变;⑤其他慢性疼痛疾病;⑥焦虑自评量表或抑郁自评量表标准分≥50分者。
1.2 刺激方案① 耳穴迷走神经刺激点:左耳耳甲内(富含迷走神经传入纤维)胰胆、肺两穴(图 1)。②非迷走神经刺激点:左耳耳舟部(无迷走神经传入纤维)腕、肩两穴(图 1)。刺激参数:恒压,连续波,频率1 Hz,波宽0.2 ms,强度为痛阈下电流,持续8 min。
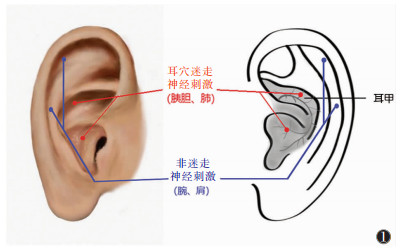 |
| 图 1 无先兆偏头痛患者耳穴迷走神经刺激与非迷走神经刺激刺激位置 |
1.3 数据采集
患者休息30 min后进入扫描室,闭眼仰卧、固定头部,使用耳塞降低噪音,扫描期间平静呼吸、保持清醒。采用Siemens Verio 3.0 T MRI扫描仪,标准正交头颅线圈。依次行T1WI脑结构像扫描、刺激前静息态fMRI扫描、持续刺激8 min fMRI扫描及刺激后静息态fMRI扫描。T1WI结构像扫描参数:TR 1 900 ms,TE 2.27 ms,FOV 256 mm×256 mm,翻转角9°,矩阵256×256,层厚1.0 mm,共176层。fMRI扫描参数:TR 2 000 ms,TE 30 ms,FOV 224 mm×224 mm,翻转角90°,矩阵64×64,层厚3.5 mm,共31层。
1.4 数据处理采用静息态fMRI处理软件DPABI 3.0进行批处理,首先去除功能图像前10个时间点数据,进行时间及空间对齐、头动校正、配准到T1WI结构像,分割、空间标准化,若受试者的头动在X、Y、Z轴的平动超过2.5 mm或旋转角度超过2.5°,则将其剔除,后对数据进行去线性漂移,对0.01~0.08 Hz下信号的功率谱进行开方,得到ALFF值,再将此范围内的ALFF值相加,与0.01~0.25 Hz的全频段振幅总值相除,得到比率低频振幅(fALFF)值。用高斯核等于4 mm×4 mm×4 mm半高全宽进行平滑,每个体素的fALFF值除以全脑信号幅值的均值,对全脑体素做标准化,消除个体间全脑fALFF总体水平的差异。
1.5 统计学分析采用SPM 12软件,行配对t检验,将头动值作为协变量,使用FWE校正,体素水平P < 0.01、簇水平P < 0.05为差异有统计学意义。
2 结果 2.1 临床结果27例纳入分析,其中男2例,女25例;年龄(29.85±8.09)岁;病程(9.22±7.26)年;发作次数(1.22±0.51)次;视觉模拟评分(Visual analogue score,VAS)(43.00±17.04)分。
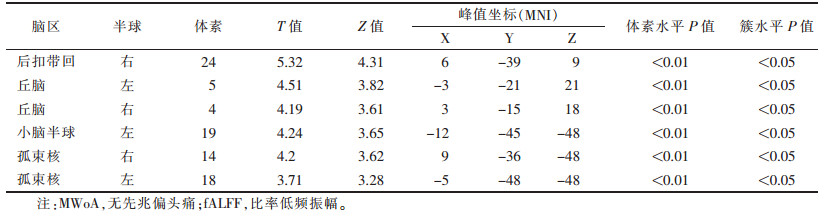
2.2 fMRI结果与非迷走神经刺激相比,耳穴迷走神经刺激时MWoA患者双侧孤束核、右侧后扣带回、左侧小脑及双侧丘脑的fALFF值显著升高(均P < 0.05)(表 1,图 2)。
| 表 1 MWoA患者耳穴迷走神经刺激与非迷走神经刺激组间fALFF值差异脑区 |
 |
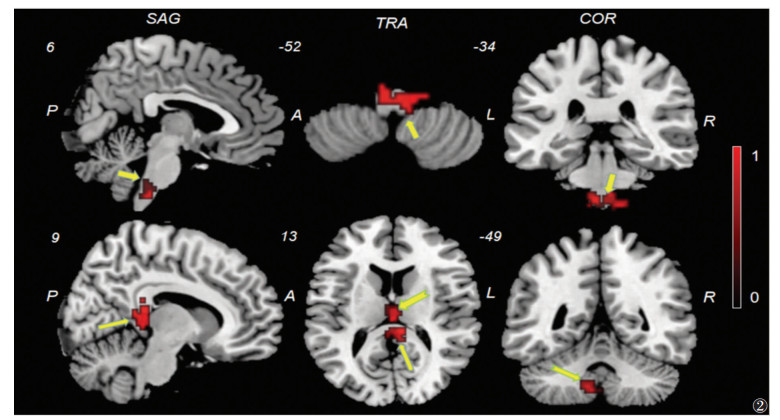 |
| 图 2 MWoA患者耳穴迷走神经刺激与非迷走神经刺激组间比率低频振幅(fALFF)值差异脑区,耳穴迷走神经刺激组双侧孤束核、双侧后扣带回、左侧小脑及双侧丘脑的fALFF值显著升高(SAG:矢状位,TRA:冠状位,COR:横轴位) |
3 讨论
偏头痛是一种难治性疾病,西医治疗包括急性治疗和预防治疗药物,存在疗效不佳及不良反应大等问题,而针灸对偏头痛具有显著的治疗效果[2]。中医认为内风是偏头痛的致病主因,痰浊是发病的主要病机,治疗当以镇肝息风、化痰通络为法。耳甲胆穴属于少阳胆经,与内风相关;肺为“储痰之器”,化痰先清肺。故胆穴和肺穴历来是中医耳穴治疗MWoA常用的穴位,但作用机制尚不明确。解剖学研究证实耳甲区具有丰富的迷走神经分支,最近临床研究[3]显示刺激耳部迷走神经对MWoA有明显疗效。而针灸耳部所取胆穴和肺穴均分布在耳甲区,因此,分析耳迷走神经刺激对脑的影响,有助于揭示中医耳针治疗偏头痛的机制。
迷走神经属于副交感神经,参与调整人体的心率、呼吸及重要器官的功能。迷走神经中枢核团包括孤束核、疑核、三叉神经脊束核及迷走神经背侧运动核,其中孤束核整合来自迷走神经颈部分支和耳廓分支的传入信息,投射到臂旁核、蓝斑、导水管周围灰质、下丘脑、杏仁核、丘脑、岛叶、前扣带皮层、前额叶皮层及初级躯体感觉皮层等脑区[4],其中内侧前额叶皮层是默认网络(default mode network,DMN)的重要节点,导水管周围灰质、下丘脑、杏仁核、丘脑、岛叶、前扣带皮层、前额叶皮层及初级躯体感觉皮层则属于疼痛矩阵,故迷走神经通路与疼痛相关网络联系密切。进一步研究发现,经皮耳刺激迷走神经可激活迷走神经通路,对疼痛调节相关脑区产生影响。Garcia等[5]研究发现,迷走神经刺激能激活偏头痛患者的孤束核,增加左侧孤束核与左侧脑岛、左前扣带皮层的功能连接,并与头痛改善相关。表明迷走神经活性与疼痛密切相关。
本研究显示,迷走神经持续刺激期间右侧后扣带回的fALFF值较非迷走神经刺激显著升高(P < 0.05)。后扣带回是DMN重要节点,DMN是人在静息状态时,由脑内代谢明显增加并高度相关的一些脑区组成,主要包括内侧前额皮层、后扣带回、楔前叶、颞下皮层及两侧顶下小叶皮质。DMN与疼痛的认知、感觉和情感成分有关[6],是已知与偏头痛相关的网络之一。既往功能影像学研究[7]表明,偏头痛患者存在DMN内脑区神经元活动及网络内外脑区间功能连接的异常,Zhang等[8]发现,与健康对照组相比,MWoA患者双侧后扣带皮层及楔前叶的局部一致性显著增加,同时,左后扣带皮层与楔前叶的功能连接增加。重要的是,DMN可通过针灸、神经调节技术、冥想、睡觉和休息觉醒等方式进行调制;Zou等[9]研究发现,针灸治疗后,偏头痛患者DMN中左上前额回和左楔前叶降低的功能连接恢复到健康对照水平,且功能连接强度与VAS分数的降低相关。因此,迷走神经刺激对DMN的调节有助于减轻疼痛。
迷走神经中枢所投射的大部分脑区与疼痛矩阵重合[10]。学者们[11-12]认为偏头痛患者存在疼痛矩阵内外脑区功能的异常。如代谢学研究[12]表明偏头痛患者存在小脑及丘脑神经元功能障碍。同时,fMRI研究[6, 13]亦发现头痛患者发作期间右小脑、左额叶与DMN的连通性减少。Zhao等[14]发现针灸治疗后,偏头痛患者双侧丘脑、小脑、前扣带回、岛叶、辅助运动区和脑干的局部一致性升高,双侧额中回及左侧海马的局部一致性降低。本研究在刺激耳甲迷走神经后,左侧小脑、双侧丘脑的fALFF值较非迷走神经刺激显著升高(均P < 0.05),表明耳穴迷走神经刺激对疼痛矩阵有明显调节作用,推测耳甲迷走神经刺激通过对脑疼痛网络影响,发挥镇痛作用。
综上所述,耳甲穴迷走神经持续刺激可对DMN和疼痛矩阵产生影响,这为揭示针刺耳穴治疗偏头痛机制提供了理论依据。
| [1] |
GBD 2016 Neurology Collaborators. Global, regional, and national burden of neurological disorders, 1990-2016:a systematic analysis for the Global Burden of Disease Study 2016[J]. Lancet Neurol, 2019, 18: 459-480. DOI:10.1016/S1474-4422(18)30499-X |
| [2] |
Liu L, Zhao LP, Zhang CS, et al. Acupuncture as prophylaxis for chronic migraine:a protocol for a single-blinded, double-dummy randomised controlled trial[J]. BMJ Open, 2018, 8: e20653. |
| [3] |
Tassorelli C, Grazzi L, de Tommaso M, et al. Noninvasive vagus nerve stimulation as acute therapy for migraine:The randomized PRESTO study[J]. Neurology, 2018, 91: e364-e373. DOI:10.1212/WNL.0000000000005857 |
| [4] |
Napadow V, Edwards RR, Cahalan CM, et al. Evoked pain analgesia in chronic pelvic pain patients using respiratorygated auricular vagal afferent nerve stimulation[J]. Pain Med, 2012, 13: 777-789. DOI:10.1111/j.1526-4637.2012.01385.x |
| [5] |
Garcia RG, Lin R L, Lee J, et al. Modulation of brainstem activity and connectivity by respiratory-gated auricular vagal afferent nerve stimulation in migraine patients[J]. Pain, 2017, 158: 1461-1472. DOI:10.1097/j.pain.0000000000000930 |
| [6] |
Amin FM, Hougaard A, Magon S, et al. Change in brain network connectivity during PACAP38-induced migraine attacks:A resting-state functional MRI study[J]. Neurology, 2016, 86: 180-187. DOI:10.1212/WNL.0000000000002261 |
| [7] |
Kuner R, Flor H. Structural plasticity and reorganisation in chronic pain[J]. Nat Rev Neurosci, 2017, 18: 113. DOI:10.1038/nrn.2017.5 |
| [8] |
Zhang J, SU J, Wang M, et al. Increased default mode network connectivity and increased regional homogeneity in migraineurs without aura[J]. J Headache Pain, 2016, 17: 98. DOI:10.1186/s10194-016-0692-z |
| [9] |
Zou Y, Tang W, Li X, et al. Acupuncture reversible effects on altered default mode network of chronic migraine accompanied with clinical symptom relief[J]. Neural Plast, 2019, 5047463. |
| [10] |
Ellingson BM, Hesterman C, Johnston M, et al. Advanced imaging in the evaluation of migraine headaches[J]. Neuroimaging Clin N Am, 2019, 29: 301-324. DOI:10.1016/j.nic.2019.01.009 |
| [11] |
Zielman R, Teeuwisse WM, Bakels F, et al. Biochemical changes in the brain of hemiplegic migraine patients measured with 7 tesla 1H-MRS[J]. Cephalalgia, 2014, 34: 959-967. DOI:10.1177/0333102414527016 |
| [12] |
Zhao L, Liu J, Dong X, et al. Alterations in regional homogeneity assessed by fMRI in patients with migraine without aura stratified by disease duration[J]. J Headache Pain, 2013, 14: 85. DOI:10.1186/1129-2377-14-85 |
| [13] |
Yang FC, Chou KH, Fuh J L, et al. Altered hypothalamic functional connectivity in cluster headache:a longitudinal resting-state functional MRI study[J]. J Neurol Neurosurg Psychiatry, 2015, 86: 437-445. DOI:10.1136/jnnp-2014-308122 |
| [14] |
Zhao L, Liu J, Zhang F, et al. Effects of long-term acupuncture treatment on resting-state brain activity in migraine patients:a randomized controlled trial on active acupoints and inactive acupoints[J]. PLoS One, 2014, 9: e99538. DOI:10.1371/journal.pone.0099538 |
 2019, Vol. 17
2019, Vol. 17


