| 骨巨细胞瘤合并动脉瘤样骨囊肿的影像学表现分析 |
2. 河南省洛阳正骨医院 河南省骨科医院影像中心,河南 洛阳 471002
骨巨细胞瘤(giant cell tumor of bone,GCT)是一种良性骨肿瘤,约占所有骨肿瘤的5%,约14%的GCT合并动脉瘤样骨囊肿(aneurysmal bone cyst,ABC)[1]。GCT合并ABC常被误诊,现回顾性分析河南省洛阳正骨医院2015年1月至2018年1月经手术、病理证实的14例GCT合并ABC的临床表现及影像学特点,以提高对该病的认识。
1 资料与方法 1.1 一般资料14例中,男10例,女4例;年龄17~45岁,平均(29.62±8.79)岁,其中复发1例。主要临床表现是无明显诱因的患肢疼痛、肿胀和功能活动受限。
1.2 仪器与方法14例均行X线检查,11例行CT检查,12例行MRI检查,2例行全身骨显像检查。①X线检查采用Philips DR摄片机行正侧位摄影。②CT检查采用Siemens 64层CT扫描仪,矩阵512×512,层厚、层距均为5 mm,并行冠状面、矢状面MPR。③MRI检查采用Philips 3.0 T MRI扫描仪,8通道体部线圈,行矢状面、冠状面及横轴面SE T1WI、T2WI及STIR序列检查;经高压注射器静脉团注对比剂Gd-DTPA,剂量0.2 mmol/kg体质量,行冠状面、矢状面和横轴面T2WI增强扫描。④全身骨显像采用Siemens Symbia双探头。
1.3 图像分析由2名高年资影像中心医师共同阅片,重点观察瘤体的部位、大小、范围、边界、骨质破坏类型、内部密度或信号强度(以周围骨质和软组织密度或信号强度作为参照)、强化方式、放射性核素摄取特点,并采用双盲法将影像学诊断与病理结果进行对照分析。
2 结果 2.1 病变部位14例中,病灶位于股骨6例(图 1),胫骨3例,尺骨3例,腓骨1例,桡骨1例(图 2)。病灶直径25.34~73.87 mm,平均(48.05±13.28)mm。
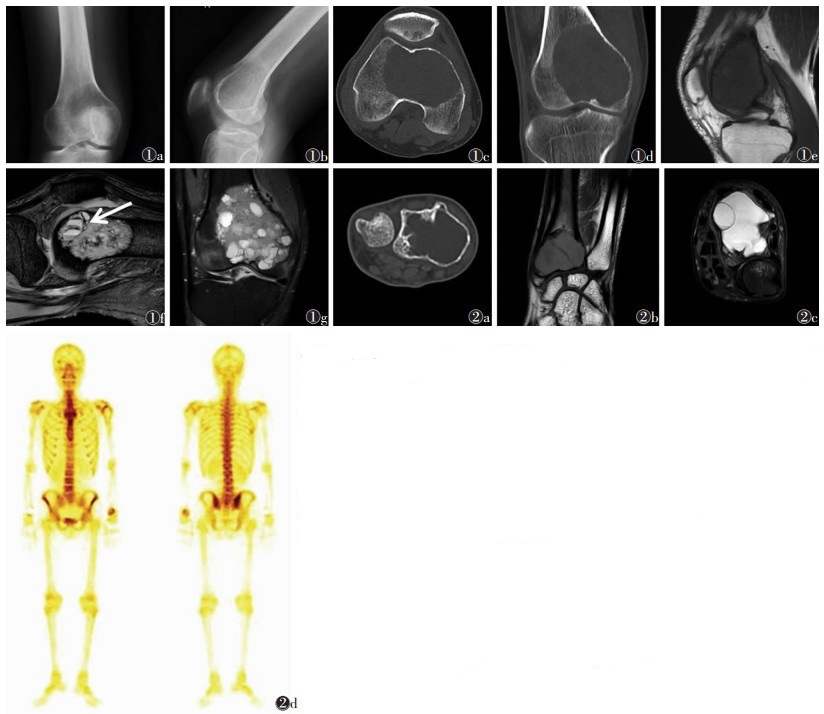 |
| 图 1 男,33岁,下肢疼痛肿胀15 d余,病理诊断(右股骨远端)骨巨细胞瘤合并动脉瘤样骨囊肿 图 1a~1d 分别为右膝关节正侧位X线平片和CT平扫轴位、冠状位图像,表现为右股骨远端溶骨性骨质破坏,内髁皮质不连续,并见筛孔样改变,病灶内部密度不均匀,周围软组织稍肿胀 图 1e 平扫T1WI示右股骨远端类圆形病灶,囊内低信号、不均匀图 1f平扫T2WI呈高信号,病灶内呈多囊改变,并可见多发液-液平面(箭头),周围骨质水肿 图 1g PDWI呈不均匀高信号 图 2 男,30岁,左腕部无明显诱因疼痛,病理诊断(左桡骨远端)骨巨细胞瘤合并动脉瘤样骨囊肿,肿瘤侵袭骨外横纹肌组织 图 2a CT平扫示左桡骨远端膨胀性骨质破坏,内可见条形骨性分隔影 图 2b 平扫T1WI呈等低信号,边界尚清,不均匀,内有线样分隔影 图 2c 平扫T2WI压脂呈高信号,病灶内可见囊腔,周围骨质水肿 图 2d 全身骨扫描:左侧桡骨远端显示大片状异常放射性核素浓聚,浓聚显影不均匀 |
2.2 X线表现
14例均可见骨皮质破坏,并呈膨胀性和溶骨性改变,其中10例为偏心型骨质破坏,4例为中心性骨质破坏;9例骨皮质连续性中断,3例累及关节面。
2.3 CT表现11例病变区见膨胀性骨质破坏,边缘不规则,骨壳不连续,其中边缘有硬化带3例,皮质筛孔样改变9例,周围有软组织肿块4例。
2.4 MRI表现MRI检查12例,病变内部信号不均匀,T1WI上肿瘤呈等或低信号,T2WI呈以高信号为主的等高混杂信号,增强扫描病变大部分区域明显强化。其中可见大小不等的囊性分隔,多发液-液平面者8例,周围骨质水肿7例,周围软组织肿胀4例。
2.5 全身骨显像2例病变位于桡骨远端和胫骨远端的患者行全身骨显像检查,主要表现为病变部位片状放射性核素明显浓聚,浓聚显影不均匀。
3 讨论GCT是一种常见的原发性骨肿瘤,通常发生在长骨骨端,50%~65%的病变位于股骨远端和胫骨近端[2],不常见部位包括脊柱和扁平骨,如肋骨、颅骨、髌骨、胸骨和锁骨。GCT好发于20~50岁,未成年人少见,男性稍多见[3],本组共14例,男10例,符合文献[3]报道。ABC于1942年首次被Jaffe等[4]报道,Louis[5]将ABC描述为反应性病变,而不是真正的肿瘤,并指出骨中的血管干扰使骨内压力增加,导致骨的变形和扩张。约50%的ABC为“继发性”,即与其他病变相关,最常见的是GCT、软骨母细胞瘤、纤维性发育不良和骨肉瘤,其中约14%的GCT合并ABC[6]。大多数GCT的基质含有大量的薄壁血管通道,常伴局部出血,并被认为与继发性ABC形成有关。
ABC的早期症状常是间歇性疼痛,病变周围软组织肿胀,可伴活动受限,也有患者发生病理性骨折[7]。其病因尚不明确,发病机制与血流动力学因素、外伤、其他骨病诱发和遗传因素有关[8]。本病镜下表现为扩张血窦和纤维间隔,其内为不凝固血液,窦内常伴含铁血黄素及破骨细胞、多核巨细胞、网状纤维组织和骨性组织。ABC的临床症状主要是患病部位疼痛、肿胀,体力活动后症状加重,休息后减轻。
结合本组的影像学资料及相关文献[9-13],GCT合并ABC的影像学诊断应从这几个方面着重分析:①部位,多数位于粗大长管状骨骨端,本组14例分别位于股骨、胫骨、尺骨、腓骨和桡骨。②骨质破坏类型,病变常呈偏心型生长,并向四周膨胀,这是因骨骼中的血管排列紊乱导致骨内压力增加,从而导致骨骼的变形、扩张。本组病灶生长类型以偏心型居多(10例)。③病灶边界骨质情况,对于病灶边界骨质的显示情况,CT优于MRI,本组11例CT主要表现为病灶周围骨质呈膨胀性破坏,呈皂泡样改观,病灶边缘硬化明显,部分病灶对骨皮质吸收,导致皮质缺损、不连续,其中骨皮质可看到筛孔状改变者9例;部分骨皮质MRI表现为弧形(可中断)低信号环,这些病例中骨内病变和骨外软组织肿块MRI信号特征相似。④病灶内情况,对病灶内组织的显示MRI更优于CT,MRI主要表现为大小不等的线状低信号分隔影,内部分隔T1WI呈低信号;液-液平面T1WI呈上层高信号,下层低信号;增强扫描肿瘤呈环形强化,囊壁及房间隔明显强化。本组病灶内可见粗细长短不一、排列不规则的纤维骨脊。这种不同程度的纤维骨脊与本病的发展程度有关,ABC在病理上有4个发展阶段:初始、活跃、稳定和愈合。在稳定阶段,由于骨壳和内隔成熟,特征皂泡样改变出现;骨壳和房间隔的渐进性骨化通常发生在愈合阶段。⑤全身骨显像,敏感度高,结合CT对骨肿瘤和其他病变鉴别价值高,本病表现为片状不均匀核素浓聚,与对侧对比,易反映出局部骨质代谢异常。另外,本病还有病变周围软组织肿胀和可伴病理性骨折的特征。目前研究中,本病骨外软组织肿块的确切发病机制尚不清楚,通常认为是病灶穿透皮质导致的软组织肿块。本组均未发生病理性骨折,但也有文献[14]报道本病伴病理性骨折,笔者认为是处于进展期的活跃性病灶对骨皮质压迫和(或)吸收导致骨皮质变薄,如有外力作用时极有可能发生病理性骨折。
GCT合并ABC应与以下疾病进行鉴别诊断:①单纯GCT,其横纵径常相近,甚至横径稍大,且病变常不侵犯骨骺板;GCT合并ABC多为偏心型生长,且更易穿破骨皮质,侵及关节面。另外,单纯GCT多表现为实性,偶有囊变区也是在实性成分内且少出现液-液平面,而GCT合并ABC的病灶多以囊性为主[14]。②原发性ABC,其病灶中的囊性成分一般表现为分房形式,且极少数病例突破骨皮质,而GCT合并ABC病灶中的囊腔多表现为散发形式。GCT合并ABC的术前诊断对手术方案的制订和预后评估非常重要,若该病以原发为主,继发成分较少,则对手术方式影响不大;如病变以继发为主,则该病含有多发含血囊腔,术中可能会大量出血,报道[15]指出在行胸椎GCT合并ABC手术时,术中患者出血量大,这与脊柱GCT血供丰富有关,因此应做好针对术中可能大面积出血的准备。本病的最新治疗措施主要是骨移植、完全或不完全切除、动脉栓塞、病灶内治疗如类固醇和降钙素,以及放射治疗[16]。
总之,当病灶出现GCT征象,且MRI上可见多房、多囊性改变并液-液平面时,不应单纯诊断为GCT,应进一步怀疑GCT合并ABC。另外,X线、CT和MRI联合应用对本病的检出率更高。
| [1] |
Park HJ, Kwon SY, Cho SG, et al. Giant cell tumor with secondary aneurysmal bone cyst shows heterogeneous metabolic pattern on 18F-FDG PET/CT:A case report[J]. Nucl Med Mol Imaging, 2016, 50: 348-352. DOI:10.1007/s13139-016-0423-z |
| [2] |
Murphey MD, Nomikos GC, Flemming DJ, et al. From the archives of AFIP. Imaging of giant cell tumor and giant cell reparative granuloma of bone:radiologic-pathologic correlation[J]. Radiographics, 2001, 21: 1283-1309. DOI:10.1148/radiographics.21.5.g01se251283 |
| [3] |
夏林, 吴杰, 敬宗林. 青少年尺骨骨巨细胞瘤合并动脉瘤样骨囊肿1例[J]. 医学影像学杂志, 2017, 27(9): 1768. |
| [4] |
Jaffe HL, Lichtenstein L. Solitary unicameral bone cyst:with emphasis on the roentgen picture, the patholog ic appearance and the pathogenesis[J]. Arch Surg, 1942, 44: 1004-1025. DOI:10.1001/archsurg.1942.01210240043003 |
| [5] |
Louis L MD. Aneurysmal bone cyst. A pathological entity commonly mistaken for giant-cell tumor and occasionally for hemangioma and osteogenic sarcoma[J]. Cancer, 1950, 3: 279-289. DOI:10.1002/(ISSN)1097-0142 |
| [6] |
Sciot R, Dorfman H, Brys P, et al. Cytogenetic-morphologic correlations in aneurysmal bone cyst, giant cell tumor of bone and combined lesions. A report from the CHAMP study group[J]. Mod Pathol, 2000, 13: 1206-1210. DOI:10.1038/Modpathol.3880224 |
| [7] |
顾玉彪, 许伟, 宋玲娟, 等. 肱骨骨巨细胞瘤合并动脉瘤样骨囊肿并病理性骨折1例[J]. 中国中医骨伤科杂志, 2014, 22(10): 6566. |
| [8] |
蔡玖明, 唐怀金. 动脉瘤样骨囊肿的影像学表现及分析[J]. 广东医学院学报, 2014, 32(4): 481-483. DOI:10.3969/j.issn.1005-4057.2014.04.024 |
| [9] |
于海龙, 孟庆瑞, 徐晓昉. 继发性动脉瘤样骨囊肿的影像学诊[J]. 中国实用医药, 2011, 6(10): 60-61. DOI:10.3969/j.issn.1673-7555.2011.10.038 |
| [10] |
陈利军, 陈文静, 杜建平. 不规则骨原发性动脉瘤样骨囊肿的影像评价[J]. 中国CT和MRI杂志, 2015, 13(1): 95-98. DOI:10.3969/j.issn.1672-5131.2015.01.30 |
| [11] |
邓敏, 李文彬, 李梅, 等. 原发性与继发性动脉瘤样骨囊肿的MRI表现及MRI诊断价值[J]. 中国临床医学影像杂志, 2008, 19(2): 117-120. DOI:10.3969/j.issn.1008-1062.2008.02.011 |
| [12] |
陈容凤, 徐嬿, 安杰, 等. 骨巨细胞瘤继发动脉瘤样骨囊肿的影像诊断[J]. 实用医学影像杂志, 2017, 18(4): 311-314. |
| [13] |
Hong WS, Sung MS, Kim JH, et al. Giant cell tumor with secondary aneurysmal bone cyst:a unique presentation with an ossified extraosseous soft tissue mass[J]. Skeletal Radiol, 2013, 42: 1605-1610. DOI:10.1007/s00256-013-1645-0 |
| [14] |
葛微, 王亚捷, 张扬, 等. 小儿骨巨细胞瘤并发动脉瘤样骨囊肿伴病理性骨折1例[J]. 中国临床医学影像杂志, 2014, 25(10): 759-760. |
| [15] |
谢炜星, 晋大祥, 丁金勇, 等. 胸椎骨巨细胞瘤并动脉瘤样骨囊肿1例报道[J]. 中国脊柱脊髓杂志, 2013, 23(6): 572-574. DOI:10.3969/j.issn.1004-406X.2013.06.18 |
| [16] |
Alias H, Doris Lau SC, Loh CK, et al. Giant cell tumor of the ribs and aneurysmal bone cyst presenting with hemothorax in a child[J]. J Pediatr Hematol Oncol, 2017, 39: e463-e463. DOI:10.1097/MPH.0000000000000960 |
 2019, Vol. 17
2019, Vol. 17


