| 3D ASL灌注成像与MRI对比增强扫描对脑肿瘤的术前诊断价值 |
脑肿瘤是常见的中枢神经系统疾病,近年发病率呈上升趋势,严重影响患者的生活质量,甚至威胁其生命[1]。术前准确判断肿瘤的良恶性及分级,已成为指导制订其临床治疗方案和判断预后评估的关键。常规CT、MRI平扫或增强扫描对反映肿瘤微脉管系统血管的生成等功能信息方面尚有很多不足[2]。动脉自旋标记成像(arterial spin labeling imaging,ASL)技术的出现及应用有望从形态学及功能学角度为脑肿瘤的诊断及分级提供更准确的评估[3]。收集北京航空总医院2015年1月至2016年6月收治的53例经病理证实的脑肿瘤患者,将3D ASL联合MRI对比增强扫描应用于诊断中,探讨其临床诊断价值。
1 资料与方法 1.1 一般资料53例中,男33例,女20例;年龄35~67岁,平均(52.7±12.3)岁。病理诊断结果:低级别胶质瘤15例,高级别胶质瘤17例,脑膜瘤12例,转移瘤9例。低级别胶质瘤15例,包括Ⅱ级星形细胞瘤8例,Ⅱ级少突胶质细胞瘤3例,Ⅱ级混合型星形细胞瘤4例;高级别胶质瘤17例,包括Ⅲ级间变星形细胞瘤5例,Ⅲ级间变少突胶质细胞瘤2例,Ⅲ级间变混合型星形细胞瘤4例和Ⅳ级胶质母细胞瘤6例。
纳入标准:①能够配合完成常规MRI平扫、对比增强扫描及3D ASL灌注成像;②检查前未行任何治疗措施和手术;③均经手术病理证实;④均签署知情同意书。
排除标准:①对比剂过敏不能行增强扫描;②有非钛金属的脊柱内固定物、人工关节、假牙等;③有心脏起搏器、除颤器、人造心脏瓣膜、动脉夹、脑动脉瘤夹等。
1.2 仪器与方法采用3.0 T高场MRI仪(Discovery MR 750)和8通道相控阵头部线圈(GE Medical System)。
常规MRI增强扫描:采用MRI专用高压注射器,经肘前正中静脉,注射顺磁性对比剂Gd-DTPA(德国拜耳先灵),剂量0.2 mmol/kg体质量,流率3.0 mL/s,后立即注射15 mL生理盐水,使对比剂充分进入体内。扫描参数:TR 190 ms,TE 22 ms,层厚6 mm,层距1 mm,FOV 240 mm×240 mm,NEX 2,矩阵320×256。3D ASL灌注成像:采用准连续式标记,基于FSE信号读取方式。扫描参数:TR 4 632 ms,TE 10.5 ms,Spiral采集采用8个螺旋臂,每个臂采集512个点,标记后延迟时间1 525 ms。采集层厚4 mm,层数72层,NEX 3,采集时间4 min 24 s。
1.3 图像后处理扫描完成后通过GE ADW 4.6工作站Functool软件生成ASL脑血流量(cerebral blood flow,CBF)伪彩图。ROI大小约50 mm2,以T2WI和CE-T1WI为参照,在瘤体实性的最大血流灌注部分、对侧半球、对侧灰质、对侧白质设定4个ROI,每处测量3次,取均值。将肿瘤的最大血流量值(TBFmax),分别除以对侧半球、对侧白质、对侧灰质的脑血流量值,获得相对脑血流量(rCBF)。
近瘤周区rCBF:瘤周区为常规MRI瘤体周围不强化、T2WI呈高信号的区域[4]。因越邻近实体组织越易受到肿瘤组织的污染,血管增殖越明显,本研究依据增强T1WI-CBF融合图像,利用热点法选取距离肿瘤强化边缘1 cm处放置瘤周区ROI,即近瘤周区,用上述方法获得近瘤周区rCBF。
1.4 统计学方法采用SPSS 18.0统计软件进行数据分析。计量资料以x±s表示。组间均数比较采用单因素方差分析,两两比较方差齐采用LSD法,方差不齐采用Dennett’s T3法。率的比较采用χ2检验。偏态分布以中位数和四分位数间距表示,两两比较采用独立样本的秩和检验,多组间采用Kruskal-Wallis检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 MRI对比增强扫描与3DASL灌注成像联合应用对脑肿瘤的诊断结果见表 1。
| 表 1 2种影像检查方法与病理诊断结果 |
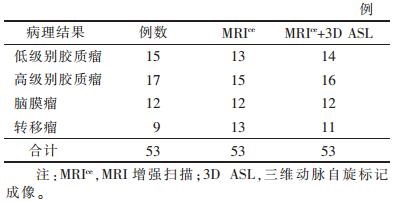 |
MRI增强扫描诊断符合率为90.6%(48/53),MRI增强扫描+3D ASL诊断符合率为96.2%(51/53),两者差异无统计学意义(χ2=1.361,P>0.05)。
2.2 胶质瘤3DASL灌注表现与对比增强扫描表现32例脑胶质瘤均获得满意的MRI常规序列图像和3D ASL-CBF灌注图;15例低级别胶质瘤强化不明显或轻度强化,T1WI增强扫描可见病灶边缘强化(图 1a),17例高级别胶质瘤呈中度或明显不均匀强化(图 2a)。3D ASL-CBF灌注图显示,低级别胶质瘤呈低血流量灌注(图 1b,病灶蓝黑色成分较多),高级别胶质瘤呈较高血流量灌注(图 2b,病灶红色成分较多)。对比增强扫描图像与ASL发现在部分肿瘤中两者高信号区存在差异,9例脑转移瘤肿瘤强化区外周均无ASL高灌注信号,而7例高级别胶质瘤、15例低级别胶质瘤、3例脑膜瘤在肿瘤强化区域的外周存在ASL高信号。
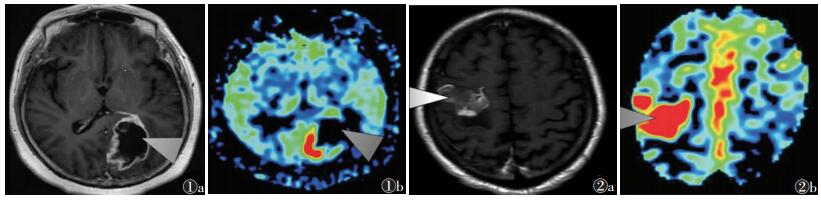 |
| 图 1 男,62岁,星形细胞瘤(WHOⅡ级) 图 1a T1WI增强扫描可见病灶边缘强化(箭头) 图 1b 3D ASL-CBF血流灌注图,显示病灶不均匀的血流分布,与强化区域并不一致,病灶呈相对低灌注(箭头) 图 2 女,68岁,胶质瘤(WHO Ⅳ级) 图 2a T1WI增强扫描可见病灶明显强化(箭头),周围不规则水肿影 图 2b ASL-CBF血流灌注图,与强化区域较一致,呈相对较高灌注(箭头) |
2.3 胶质瘤、脑膜瘤、转移瘤之间rCBF值比较(表 2)
| 表 2 胶质瘤、脑膜瘤、转移瘤的rCBF值比较(x±s) |
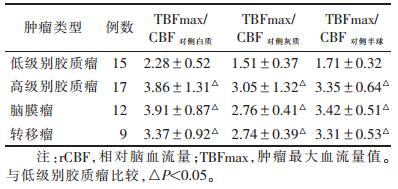 |
低级别胶质瘤与高级别胶质瘤、脑膜瘤、转移瘤rCBF值比较,差异均有统计学意义(均P < 0.05);余各组比较,差异均无统计学意义(均P>0.05)。
2.4 高级别胶质瘤与脑转移瘤近瘤周区ASL-rCBF值比较高级别胶质瘤17例,近瘤周区rCBF为1.13±0.21;转移瘤9例,近瘤周区rCBF为0.71±0.16,两者比较,差异有统计学意义(t=5.231,P < 0.05)。
3 讨论脑肿瘤约占全身肿瘤的1.9%,而其他恶性肿瘤最终有20%~30%转移至颅内[4],其致残率、致死率、复发率均很高,严重影响患者的生命及生活质量。鉴别肿瘤的良恶性及内部微循环灌注状况,对其分级及评价疗效有重要临床价值。常规MRI增强扫描仅能显示血-脑脊液屏障的损害程度,难以准确反映肿瘤内部微血管丰富程度及肿瘤强化程度[5-6]。PWI可通过显示脑肿瘤的内部异常增殖血管及微血管情况,预测脑肿瘤病理组织的变化[7],可分为动态磁敏感对比增强(dynamic magnetic susceptibility contrast enhancement,DSC)及ASL。但DSC需使用外源性示踪剂,对比剂的不良反应限制其应用[8]。而ASL利用自身血液中氢质子作为内源性对比剂,不受血-脑脊液屏障的影响,在判断肿瘤良恶性及级别方面更具优势,与MRI常规序列的联合使用对脑肿瘤的级别诊断有重要价值[9]。
温洋等[10-11]报道,低级别胶质瘤组肿瘤实性区域各灌注指标均低于其他各组,余各组比较差异无统计学意义。本研究测定胶质瘤、脑膜瘤、转移瘤的rCBF值,与以上文献报道一致,提示胶质瘤级别与rCBF值有相关性,通过测定rCBF相对值可对不同级别胶质瘤提供诊断信息。其机制为胶质瘤的早期,不具备肿瘤血管的生长条件,当肿瘤瘤体生长至一定程度,即迅速出现新生的毛细血管,肿瘤丰富的血供使其呈指数型快速生长,因此在低级别胶质瘤中ASL呈低灌注,但在高级别胶质瘤及脑膜瘤、转移瘤之间的rCBF值无明显差别[12]。
本研究显示,高级别胶质瘤近瘤周区rCBF值较转移瘤升高,说明通过测定近瘤周区的rCBF值,可为高级别胶质瘤与转移瘤的鉴别诊断提供依据,提示两者在近瘤周区存在不同的病理学基础。瘤周区,即瘤周水肿发生机制与肿瘤大小、部位、血管密度及血管内皮生长因子的表达等有关[13]。高级别胶质瘤表现为侵袭性生长,瘤周区除水肿外,还存在明显的瘤细胞浸润;转移瘤表现为膨胀性生长,无明显的瘤细胞浸润及血管异常增生[14]。研究[15]发现,高级别胶质瘤的高灌注区域明显大于常规MRI强化范围,而转移瘤高灌注区域与常规MRI强化区域基本相同。本研究中9例脑转移瘤肿瘤增强扫描区外周均无ASL高灌注信号,而脑膜瘤、高级别及低级别胶质瘤的高灌注区域在常规MRI强化及3D ASL中存在差异。MRI增强扫描与MRI增强扫描+3D ASL的诊断符合率差异无统计学意义(P>0.05)。
综上所述,3D ASL对颅脑肿瘤的肿瘤良恶性及分级诊断具有重要的临床价值,特别是通过近瘤周区rCBF值的比较,可对高级别胶质瘤、转移瘤作出鉴别诊断,且ASL为无创检查,较常规对比增强扫描更加安全,可作为颅脑肿瘤术前评估的常用诊断方法。但本研究转移瘤例数较少,需在后续研究中扩大样本量。
| [1] |
Di Costanzo A, Scarabino T, Trojsi F, et al. Multiparametric 3T MR approach to the assessment of cerebral gliomas:tumor extent and malignancy[J]. NeuroradioIogy, 2006, 48: 622-631. DOI:10.1007/s00234-006-0102-3 |
| [2] |
Scott JN, Brasher PM, Sevick RJ, et al. How often are nonenhancing supratentorial gliomas malignant A opulation study[J]. Neurology, 2002, 59: 947-949. DOI:10.1212/WNL.59.6.947 |
| [3] |
车英玉, 杨子涛, 程敬亮. 3D ASL与DSC灌注技术在脑肿瘤的对比研究[J]. 临床放射学杂志, 2014, 33(5): 770-774. |
| [4] |
Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J]. Int J Cancer, 2010, 127: 2893-2917. DOI:10.1002/ijc.v127:12 |
| [5] |
刘颖, 袁慧书, 曾祥柱, 等. 三维动脉自旋标记技术评价阿尔茨海默病患者脑血流灌注[J]. 中国医学影像技术, 2014, 30(5): 693697. |
| [6] |
Direksunthorn T, Chawalparit O, Sangruchi T, et al. Diagnostic performance of perfusion MRI in differentiating low-grade and high-grade gliomas:advanced MRI in glioma, A Siriraj project[J]. J Med Assoc Thai, 2013, 96: 1183-1190. |
| [7] |
Petersen ET, Lim T, Golay X. Model-free arterial spin labeling quantification approach for perfusion MRI[J]. Magn Reson Med, 2010, 55: 219-232. |
| [8] |
Buxton RB. Quantifying CBF with arterial spin labeling[J]. J Mage Reson Imaging, 2005, 22: 723-726. DOI:10.1002/(ISSN)1522-2586 |
| [9] |
李勇, 乔飞, 孔祥泉, 等. 3D-ASL全脑灌注成像在脑肿瘤术前诊断与分级中的应用价值[J]. 临床放射学杂志, 2015, 34(6): 871875. |
| [10] |
温洋, 戴建平, 高培毅, 等. ASL在胶质瘤分级中的初步应用[J]. 中国医学影像技术, 2005, 21(9): 1371-1375. DOI:10.3321/j.issn:1003-3289.2005.09.017 |
| [11] |
Wolf RL, Wang J, Wang S, et al. Grading of CNS neoplasms us ing continuous aterial spin labeled perfusion MR imaging at 3 Tesla[J]. J Magn Reson Imaging, 2005, 22: 475-482. DOI:10.1002/(ISSN)1522-2586 |
| [12] |
Wimkler F, Kienast Y, Fuhrmann M, et al. Imaging glioma cell invasion in vivo reveals mechanisms of dissemination and peri tumoral angiogenesis[J]. Glia, 2009, 57: 1306-1315. DOI:10.1002/glia.v57:12 |
| [13] |
王萍, 翟昭华, 唐光才, 等. 扩散加权成像鉴别诊断恶性胶质瘤与单发脑转移瘤的b值优化[J]. 中国医学影像学杂志, 2014, 22(7): 487-490. DOI:10.3969/j.issn.1005-5185.2014.07.002 |
| [14] |
Grossman EJ, Zhang K, An J, et al. Measurement of deep gray matter perfusion using a segmented true FISP ASL method at 3T[J]. J Magn Reson Imaging, 2009, 29: 1425-1431. DOI:10.1002/jmri.v29:6 |
| [15] |
Bebawy JF. Perioperative steroids for peritumoral intracranial ed ema:a review of mechanisms, efficacy, and side effects[J]. J Ne urosurg Anesthesiol, 2012, 24: 173-177. DOI:10.1097/ANA.0b013e3182578bb5 |
 2018, Vol. 16
2018, Vol. 16


