| 首发精神分裂症偏执型患者的MRS研究 |
精神分裂症(schizophrenia,SP)是由一组症状群组成、病程迁延的慢性精神疾病,临床表现复杂多样,可涉及思维、情感、意志行为及认知功能等方面,其中偏执型以幻觉、妄想为主要临床表现,是SP中最常见的一种类型[1]。近年来,诸多学者利用磁共振质子波谱成像(proton magnetic resonance spectroscopy,1H-MRS)对SP的病理生理机制进行研究,结果显示SP患者的前额叶、海马、扣带回及基底节区存在代谢指标异常。本研究利用1H-MRS对首发SP偏执型患者进行比较,以期获得更多病因学证据,现报道如下。
1 资料与方法 1.1 研究对象选取2013年3月至2014年12月我院收治的22例首发SP偏执型患者(患者组),其中男15例,女7例;年龄19~44岁,平均(29.89±9.8)岁;病程(4±3)个月;受教育时间7~17年,平均(9.1±5.5)年;均为右利手。所有患者均以临床晤谈的形式明确诊断,采用阳性症状量表(scale for assessment of positive symptoms,SAPS)或阴性症状量表(scale for assessment of negative symptoms,SANS)判断患者病情。纳入标准:①符合《国际疾病分类(第10版)》(ICD-10)和《美国精神疾病诊断和统计手册(第4版)》(DSM-Ⅳ)中偏执型SP的诊断标准;②首次发病,病程 < 1年,检查前未使用任何抗精神病药物及影响脑内胆碱递质的药物;③SAPS评分> 50分。排除标准:①有严重躯体、神经系统、内分泌疾病或先天神经系统发育畸形病史;②有酒精、精神药物滥用史;③存在精神发育迟滞或其他可能影响脑功能的疾病;④常规MRI检查脑实质无明显器质性病变。对照组:选择年龄(20~45岁)、性别(男15例,女7例)与患者组相匹配的健康志愿者22例,均未患任何精神疾病,利手及受教育时间2组相似。本研究经我院伦理委员会批准,研究对象均签署知情同意书。
1.2 扫描方法及后处理采用Siemens Magnetom stero 3.0 T MRI扫描仪,8通道头颅相控阵线圈,精确摆位使受试者头颅两侧对称且中线居中,并固定海绵垫、塞耳塞减少运动及噪音的影响。首先行常规MRI扫描,明确有无器质性病变,扫描序列为T1WI、T2WI及FLAIR,后行高分辨T1WI扫描,定位后行1H-MRS扫描。1H-MRS采用多体素扫描,TR 1 700 ms,TE 135 ms,采集次数3次,扫描时间6 min 53 s。将扫描数据导入后处理工作站(Siemens Syngo Multi Modality Workplace-VE40B)进行分析,选取的ROI为双侧额叶白质、双侧海马头部及双侧扣带前回。在3个方位(矢状、冠状及横断位)的定位图像上,ROI海马尽量选取海马头部的白质区,扣带前回选取胼胝体膝部前下方的脑回。所有ROI均按照个体差异选取双侧相等的体积,约1 mm3,尽量避开颅骨、脂肪、气腔及脑脊液等部位,获得肌酸(creatine,Cr)、胆碱(choline,Cho)及N-乙酰门冬氨酸(N-Acetyl aspartic acid,NAA),以Cr为参照物,得出NAA/Cr、Cho/Cr比值。所有扫描均由1位放射科医师操作,在同一时间进行测量分析。
1.3 统计学方法运用SPSS 16.0软件进行统计分析,将患者组左右对应ROI的NAA/Cr、Cho/Cr值进行组内配对t检验;患者组与对照组对应ROI的NAA/Cr、Cho/Cr值行组间配对t检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 患者组组内比较(表 1)| 表 1 2组不同ROI的各代谢指标比较(×10-6,x±s) |
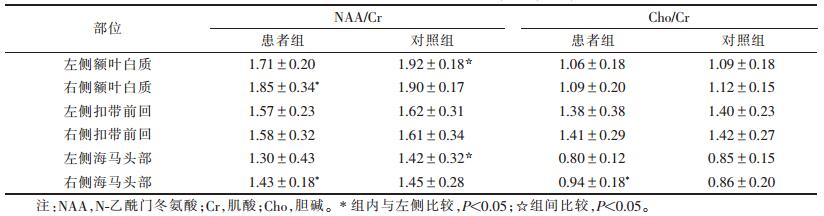 |
左侧额叶白质NAA/Cr低于右侧,左侧海马头部Cho/Cr、NAA/Cr低于右侧(均P < 0.05);双侧额叶白质Cho/Cr及双侧扣带前回NAA/Cr、Cho/Cr差异均无统计学意义(均P>0.05)。
2.2 组间比较(表 1)患者组左侧额叶白质及左侧海马头部NAA/Cr均低于对照组(均P < 0.05)。右侧额叶白质、右侧海马头部及双侧扣带前回NAA/Cr与对照组差异均无统计学意义(均P>0.05)。双侧额叶白质、双侧海马头部及双侧扣带前回的Cho/Cr与对照组差异均无统计学意义(均P>0.05)。
2.3 对照组组内比较对照组双侧额叶白质、双侧扣带前回及双侧海马头部NAA/Cr、Cho/Cr值差异均无统计学意义(均P < 0.05)。
3 讨论随着现代神经影像和分子技术的发展,特别是fMRI的发展,医学界对SP患者脑结构与功能异常研究日益深入,目前普遍认为,在SP症状出现前其脑内可能已经出现代谢方面的异常[2]。fMRI技术中的1H-MRS是迄今唯一能无创检测活体组织中不同代谢产物浓度、反映其病理及生理变化特点的定量分析方法,应用最广泛。1H-MRS可检测NAA、Cho及Cr等脑内代谢产物,NAA被认为是神经元的标志物,其含量反映了神经元的数量及功能情况,NAA减少被认为与神经元死亡、细胞体能量缺陷及轴索损伤有关。CHO主要为脂质,多为细胞膜的构成物质或磷脂代谢产物,其升高被认为与神经元星形细胞增多(如神经退行性改变、创伤或其他脑损害的反应性胶质增生)有关。Cr为能量代谢产物,人脑组织在不同情况下,Cr的量保持相对恒定,因此常被用来作为参照物,反映其他代谢产物量的变化[3]。
SP的fMRI研究重点多集中在额叶、海马、扣带回或丘脑等部位,这些部位均为人脑功能区域。若发生病理性损害,认知功能缺陷或缺损性的阴性症状被认为与额叶有关[4],情感和记忆症状与海马区有关[5]。但大多对SP的研究结果并不完全相同,这可能与研究对象的病程、症状、治疗与否及疗程、样本量有关。鉴于以上原因,本研究选取首次发病未治疗的SP偏执型患者作为研究对象,年龄18~45岁,消除了年龄、药物及慢性病程对脑内代谢物的影响,使研究结果相对客观。
本研究显示,患者组组内左侧额叶白质及左侧海马头部NAA/Cr明显小于右侧,考虑可能由于额颞叶发育异常或变性,导致额颞叶神经元完整性或功能异常[6]。研究[7]表明,NAA浓度的降低与神经元或轴突的缺失有明显相关性。Steen等[8]的Mata分析指出,SP患者脑内NAA减少的部位范围较广泛,其中以中颞叶(海马部分)和额叶NAA减少为著,与本研究一致。同时本研究还发现,首发SP患者左侧额叶白质及左侧海马头部NAA/Cr明显小与对照组,患者组双侧ROI内Cho/Cr与对照组无明显差异。甘景梨等[9]发现,患者组左侧前额叶和左侧丘脑NAA/Cr值低于对照组,与本研究结果相似。部分研究结果亦支持SP患者前额叶的NAA浓度明显低于正常人[10-11]。但何宗岭等[12]研究未发现SP患者脑代谢物与健康人有差异。
本研究表明,首发偏执型症状为主型SP患者在一定程度上存在脑生物学功能对照偏侧化特征。吴大兴等[13]对伴执行功能障碍的SP患者给予双重工作记忆作业,fMRI示激活脑区增加,以右侧额叶为著,提示左侧额叶功能弱化,认为SP患者大脑存在偏侧化差异。有观点[14]认为脑的偏侧化差异可能是导致SP发病的重要因素,由于左侧额叶及海马发育晚于右侧,优势半球功能出现异常,可能使大脑两半球在认知、情感、行为等精神活动的联系或协调方面出现障碍,从而导致疾病发生。
SP病因学的神经发育假说认为,SP可能是由基因决定的因素之间相互作用的结果[15]。海马异常是此假说的重点,神经结构、功能影像和尸检等多种研究结果也高度支持此观点。动物实验研究[16]证实有易感基因背景动物早期海马损伤后,可产生类似SP反应[16]。亦有研究[14]发现,SP患者双侧海马,特别是左侧海马体积明显缩小。脑病理的研究[17]显示,SP患者海马区存在膜代谢异常。此假说认为SP患者额叶功能障碍是由于海马损伤导致的海马-前额叶连接紊乱所致[18]。
综上所述,首发SP偏执型患者脑发育存在病理性改变,表现为脑生物学功能的偏侧化特征,这与既往研究部分相似,一定程度上揭示了SP的病理生理机制,但仍未明确首发SP偏执型的病因,仍需大样本研究进一步证实。
| [1] |
Andreasen NC. Positive vs Negative schizophrenia:Acritical evaluation[J]. Schizophr Bull, 1985, 11: 380-389. DOI:10.1093/schbul/11.3.380 |
| [2] |
Sung MT, Ko SF, Niu CK, et al. Perirenal tailgut cyst(cystic hamartoma)[J]. J Pediatr Surg, 2003, 38: 1404-1406. DOI:10.1016/S0022-3468(03)00408-1 |
| [3] |
Brooks WM, Frideman SD, Stidley CA. Reproducibility of 1H-MRS in vivo[J]. Magn Reson Med, 2015, 41: 193-197. |
| [4] |
Bunney WE, Bunney BG. Evidence for a compromised dorsolateral prefrontal cortical parallel circuit in schizophrenia[D]. Brain Res Rev, 2000, 31: 138-146. https://www.sciencedirect.com/science/article/pii/S0165017399000314
|
| [5] |
Himler M, Hurcombe SD, Griffin A, et al. Medial temporal lobe function and structure in mild cognitive impairment[J]. Annals of Neurology, 2010, 56: 27-35. |
| [6] |
Sanches RF, Crippa JA, Hallak JE, et al. Proton magnetic resonance spectroscopy of the frontal lobe in schizophrenics a critical review of the methodology[J]. Rev Hosp Clin Fac Med Sao Paulo, 2004, 59: 145-152. DOI:10.1590/S0041-87812004000300010 |
| [7] |
Bertolino A, Frye M, Callicott JH, et al. Neuronal pathology in the hippocampal area of patients with bipolar disorder:a study with proton magnetic resonance spectroscopic imaging[J]. Biol Psychiatry, 2003, 53: 906-913. DOI:10.1016/S0006-3223(02)01911-X |
| [8] |
Steen RG, Hamer RM, Lieberman JA. Measurement of brain metabolites by 1H magnetic resonance spectroscopy in patients with schizophrenia:a systematic review and meta-analysis[J]. Neuropsychopharmacology, 2005, 30: 1949-1962. DOI:10.1038/sj.npp.1300850 |
| [9] |
甘景梨, 段惠峰, 杨家明, 等. 精神分裂症患者脑部质子波谱特点及其与临床症状的关系[J]. 中国神经精神疾病杂志, 2009, 35(6): 359-362. DOI:10.3969/j.issn.1002-0152.2009.06.014 |
| [10] |
Tanaka Y, Obata T, Sassa T, et al. Quantitative magnetic reson ance spectroscopy of schizophrenia:relationship between decrea sed N-acetylaspartate and frontal lobe dysfunction[J]. Psychiat ry Clin Neurosci, 2006, 60: 365-372. DOI:10.1111/pcn.2006.60.issue-3 |
| [11] |
Bustillo JR, Rowland LM, Jung R, et al. Proton magnetic reson ance spectroscopy during initial treatment with antipsychotic me dication in schizophrenia[J]. Neurosychopharmacology, 2008, 33: 2456-2466. DOI:10.1038/sj.npp.1301631 |
| [12] |
何宗岭, 邓伟, 李名立, 等. 首发精神分裂症患者额叶白质及海马中脑代谢物的变化[J]. 四川大学学报(医学版), 2011, 42(3): 433-455. |
| [13] |
吴大兴, 谭长连, 颜莉蓉, 等. 精神分裂症执行功能障碍患者工作记忆fMRI研究[J]. 中国医科大学学报, 2007, 36(6): 737-740. DOI:10.3969/j.issn.0258-4646.2007.06.045 |
| [14] |
Flyckt L, Venizelos N, Edman G, et al. Aberrant tyrosine trans port across the cell membrane in patients with schizophrenia[J]. Arch Gen Psychiatry, 2001, 58: 953-958. DOI:10.1001/archpsyc.58.10.953 |
| [15] |
Lieberman JA, Perkins D, Belger A, et al. The early stages of schizophrenia:speculations on pathogenesis, pathophysiology, and therapeutic approaches[J]. Biol Psychiatry, 2001, 50: 884-897. DOI:10.1016/S0006-3223(01)01303-8 |
| [16] |
Wood GK, Lipska BK, Weinberger DR. Behavioral changes in rats with early ventral hippocampal damage vary with age at damage[J]. Brain Res Dev Brain Res, 1997, 101: 17-25. DOI:10.1016/S0165-3806(97)00050-3 |
| [17] |
Deicken RF, Zhou L, Schuff N, et al. Proton magnetic resonance spectroscopy of the anterior cingulated region in shcizophren ia[J]. Schizophr Res, 1997, 27: 65-71. DOI:10.1016/S0920-9964(97)00082-0 |
| [18] |
贾艳滨, 王颖, 凌雪英, 等. 首发精神分裂症阳性型患者功能型磁共振波谱和扩散张量成像的偏侧性研究[J]. 南方医科大学学报, 2012, 32(3): 374-378. |
 2018, Vol. 16
2018, Vol. 16


