| ACR TI-RADS与ATA指南分级评估甲状腺结节的对比研究 |
近年来,随着健康体检增多及影像学技术的发展应用,甲状腺结节的检出率逐年上升[1]。高频超声检查因无创、简便、快捷、准确等优点[2],被广泛应用于甲状腺结节检查。甲状腺结节超声图像复杂多变,良恶性结节特征重叠,为提高诊断的准确性与一致性,临床上尝试用各种方法规范检查,其中包括美国放射学会(American College of Radiology,ACR)甲状腺影像报告与数据系统(Thyroid Imaging-Reporting and Data System,TI-RADS)分级与美国甲状腺协会(American Thyroid Association,ATA)指南分级等。本研究探讨对比上述2种方法对甲状腺结节恶性风险评估的价值。
1 资料与方法 1.1 一般资料选取2016年1月至2017年12月在我院行甲状腺超声检查并经手术病理或细针穿刺抽吸活组织病理检查(fine needle aspiration biopsy,FNAB)确诊的148例(173个)甲状腺结节纳入研究。其中男34例(39个),女114例(134个);年龄22~79岁,平均(48.1±12.4)岁;良性144个(男33个,女111个),其中伴腺瘤样增生112个、腺瘤21个、桥本甲状腺炎8个、甲状腺正常滤泡上皮细胞3个,恶性29个(男6个,女23个),包括25个甲状腺乳头状癌、3个滤泡癌、1个髓样癌。
1.2 仪器与方法采用Philips IU22及Siemens S1000彩色多普勒超声诊断仪,探头L12-5,频率5~12 MHz。患者取仰卧位,平静呼吸,充分暴露颈部,常规扫查甲状腺及双侧颈部淋巴结,观察结节大小及相关超声特征(结构、纵横比、边缘、回声、钙化,评估与被膜及气管的关系以判断是否侵出被膜)。调出PACS中存储的超声资料,由具有5年以上超声诊断经验的医师采用双盲法,分别根据2017版ACR TI-RADS分级与2015版ATA指南分级诊断标准对结节进行评估。
1.3 分级标准 1.3.1 2017版ACR TI-RADS分级[3]超声恶性风险分级:TR1=0分,良性;TR2=1~2分,不怀疑恶性;TR3=3分,低度可疑恶性;4≤TR4≤6分,中度可疑恶性;TR5>7分,高度可疑恶性。
评分标准如下:①甲状腺结节的成分。囊性、海绵状为0分,囊实混合性1分,实性或几乎完全实性2分。②回声。无回声、高或等回声均为0分,低回声2分,极低回声3分。③形状。纵横比 < 1为0分,纵横比≥1为3分。④边缘。光滑及不清均为0分,分叶状或不规则2分,向甲状腺外扩张或紧贴包膜3分。⑤强回声。无强回声或伴大彗尾征为0分,大片钙化1分,边缘或环状钙化2分,点状高回声3分。其中强回声部分为叠加分数,最后将结节所有分数相加之后,得出总分。
1.3.2 2015版ATA指南分级[4]超声恶性风险分级包括高度可疑恶性、中度可疑恶性、低度可疑恶性、极低度可疑恶性和良性结节(以下简称高危、中危、低危、极低危及良性)。良性(恶性风险 < 1%):主要为囊性结节。极低危(恶性风险 < 3%):①“海绵样”结节;②囊实性结节实性部分不偏心,无微钙化、边缘不规则、纵横比>1及被膜外侵犯。低危(恶性风险5%~10%):等或高回声、实性或囊实性结节的实性部分偏心,无微钙化、边缘不规则、纵横比>1及腺体外侵犯。中危(恶性风险10%~20%):实性低回声结节,边缘光滑、规则,无微钙化、纵横比>1及腺体外侵犯。高危(恶性风险>70%):实性低回声或囊实性结节中的实性成分为低回声的结节,同时具有以下一项或多项超声特征:①不规则边缘(小分叶、毛刺、浸润性);②微钙化;③纵横比>1;④边缘钙化中断,低回声突出钙化外;⑤甲状腺被膜外侵犯。
分别以ACR TI-RADS分级≥TR3、≥TR4及≥TR5,ATA指南分级≥低危、≥中危及≥高危作为诊断临界点,计算诊断良恶性结节的敏感度、特异度、阳性预测值、阴性预测值及准确性。
1.4 统计学分析采用SPSS 19.0软件进行统计学分析。年龄以x±s表示。良性组与恶性组年龄比较行t检验;ACR TI-RADS分级及ATA指南分级的差异比较行χ2检验。以病理结果为金标准,计算各分级的恶性百分比,建立ROC曲线,计算ACR TI-RADS与ATA指南分级诊断的曲线下面积,取得最合适的诊断临界点。并计算诊断指标的敏感度、特异度、阳性预测值、阴性预测值、准确性及Youden指数。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料比较148例甲状腺结节中,良性组平均年龄与恶性组比较[(48.13±12.6)岁vs.(47.13± 11.0)岁],差异无统计学意义(t=0.397,P>0.05)。男女甲状腺结节的恶性百分比比较[15.4%(6/39)vs. 17.2%(23/134)],差异无统计学意义(χ2=0.069,P>0.05)。
良恶性结节大小区间分布比较,差异有统计学意义(P < 0.01),其中恶性甲状腺结节长径1.1~2.0 cm最多[51.7%(15/29)],2.1~3.0 cm最少[10.3%(3/29)];良性甲状腺结节长径>3.0 cm最多[40.3%(58/144)]。
2.2 ACR TI-RADS分级与ATA指南分级恶性百分比(表 1)| 表 1 173个甲状腺结节的ACR TI-RADS分级与ATA指南分级恶性百分比 |
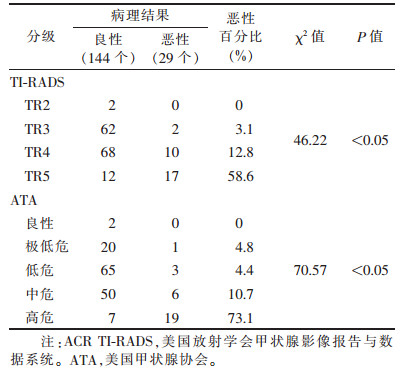 |
2种方法各自分级之间恶性百分比比较,差异均有统计学意义(χ2=46.22、70.57,均P < 0.05)。
2.3 ACR TI-RADS分级与ATA指南分级诊断效率比较(表 2)| 表 2 ACR TI-RADS与ATA指南不同分级对恶性甲状腺结节的诊断效率比较 |
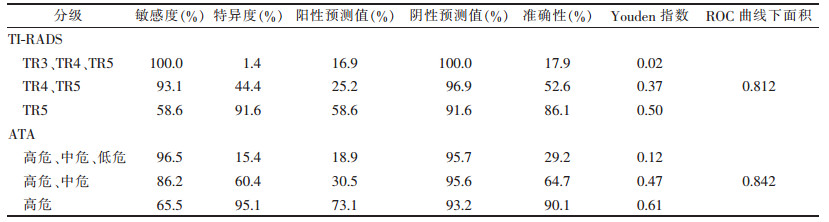 |
ACR TI-RADS分级与ATA指南分级ROC曲线下面积分别为0.812[95%置信区间(0.724,0.900)]及0.842[95%置信区间(0.750,0.934)],两者诊断良恶性结节效率几乎相等(图 1)。ACR TI-RADS以≥TR3为界点诊断恶性时,敏感度及阴性预测值非常高(100.0%),但同时其特异度(1.4%)及Youden指数(0.02)很低;ACR TI-RADS分级以≥TR5为界点时,ATA指南以≥高危为界点诊断恶性时,两者的敏感度、特异度、阳性预测值、阴性预测值均较接近,Youden指数也分别达到最高,但ACR TI- RADS分级TR5的恶性百分比(58.6%)较ATA指南高危分级的恶性百分比(73.1%)低。
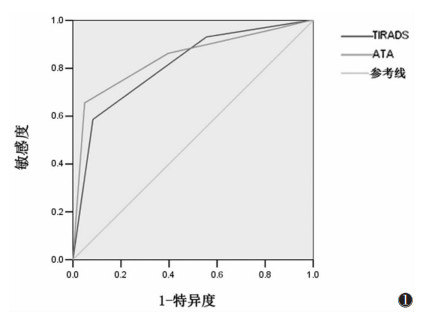 |
| 图 1 ACR TI-RADS与ATA指南分级评价甲状腺结节的ROC曲线,曲线下面积分别为0.812(95%置信区间0.724,0.900)及0.842(95%置信区间0.750,0.934),两者诊断良恶性结节效率几乎相等(ACR TI-RADS,美国放射学会甲状腺影像报告与数据系统。ATA,美国甲状腺协会) |
3 讨论
随着高频超声的发展及广泛应用,越来越多的甲状腺结节被发现。然而由于良恶性结节的声像图表现复杂多变、特征重叠,且同种病理类型的不同亚型,声像图也可能存在不同[5];不同超声医师对同一图像的解读也存在差异,导致超声在鉴别甲状腺良恶性结节方面存在不足[6],因此,很多学者提出各种方法以提高超声诊断的准确性和可重复性。2009年Horvath等[7]首次提出TI-RADS分级,随后有多位学者根据临床实际提出了各种改良TI-RADS分级标准。2017年ACR发布新版ACR TI-RADS分级标准,其着重评估结节的成分、回声、形状、边缘及局灶性强回声情况,并对各种特征标明具体分值,采用积分法进行危险分层[8]。本研究采用2017版本的ACR TI-RADS分级标准。ATA指南因其与临床结合紧密,也得到了越来越广泛的应用[9],本研究采用的是2015年版本。
本研究以手术病理或FNAB结果进行对照。我院为基层医院,绝大多数患者为首诊,且我院现仅开展甲状腺良性结节消融术,对于这部分患者,术前需常规行多次FNAB确诊为良性结节,导致样本中良性甲状腺结节比例较高[83.2%(144/173)],其长径>3.0 cm最多[40.3%(58/144)],恶性结节长径1.1~2.0 cm最多[51.7%(15/29)]。这是由于各个临床甲状腺疾病诊治指南中,包括ATA、美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)、欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)、美国临床内分泌医师学会(American Association of Clinical Endocrinologists,AACE)/意大利临床内分泌协会(Associazione Medici Endocrinologi,AME)/欧洲甲状腺协会(European Thyroid Association,ETA)、中华医学会内分泌学分会等,均将长径1.0 cm作为穿刺界值;临床工作中较少对长径 < 1.0的甲状腺结节行FNAB,从而导致诊断恶性结节中长径1.1~2.0 cm的比例升高。
在本研究中,ACR TI-RADS分级TR2、TR3、TR4及TR5结节恶性百分比分别为0、3.1%(2/64)、12.8%(10/78)、58.6%(17/29)。ATA分级的良性、极低危、低危、中危、高危恶性百分比分别为0、4.8%(1/21)、4.4%(3/68)、10.7%(6/56)及73.1%(19/26)。2种方法各自分级之间恶性百分比比较,差异均有统计学意义(χ2=46.22、70.57,均P < 0.05),说明2种方法均为临床提供了可行的甲状腺结节恶性风险分级。ACR TI-RADS分级与ATA指南分级ROC曲线下面积分别为0.812(95%置信区间0.724,0.900)及0.842(95%置信区间0.750,0.934),两者诊断良恶性结节效率几乎相等。ACR TI-RADS以≥TR3为界点诊断恶性时,敏感度及阴性预测值非常高(100.0%),但同时其特异度(1.4%)及Youden指数(0.02)很低,这表示以≥TR3为界点诊断恶性时,恶性结节不易漏诊,但其特异度太低。ACR TI-RADS分级以≥TR5为界点时,ATA指南以≥高危为界点诊断恶性时,两者的敏感度、特异度、阳性预测值、阴性预测值均较接近,Youden指数也分别达到最高,但ACR TI-RADS分级TR5的恶性百分比(58.6%)较ATA指南高危分级的恶性百分比(73.1%)低,这表示较多的良性结节会被归入恶性结节,从而导致更多的FNAB。
ATA指南分级与临床结合紧密,无需像ACR TI-RADS分类系统一样对可疑征象进行计数[10-11];其缺点是将有不同重要性的可疑超声特征划分到同一分级中,以及未将实性这一独立危险因素作为独立分级依据[7, 12]。ACR TI-RADS分级对结节的成分、回声、形状、边缘及局灶性强回声情况详细定义并赋予具体分值,简便易行[13-14]。赵新保等[15]研究发现在不同经验的超声医师诊断一致性方面,ACR TI-RADS的一致性明显高于ATA指南,可重复性高,更适合在基层医院推广应用。而对于滤泡癌,因其恶性超声特征不典型,在临床工作中这2种方法的诊断效率均不高。
本研究也存在一定不足,例数相对较少,后续希望进行更大样本量的研究。
综上所述,ACR TI-RADS分级与ATA指南分级2种方法均为临床提供了可行的甲状腺结节恶性风险分级,对甲状腺结节的恶性风险评估诊断价值均较高。ACR TI-RADS分级简单易用,可重复性高,更适合在基层医院推广应用。
| [1] |
Singaporewalla RM, Hwee J, Lang TU, et al. Clinico-pathological correlation of thyroid nodule ultrasound and cytology using the TIRADS and Bethesda classifications[J]. World J Surg, 2017, 41: 1807-1811. DOI:10.1007/s00268-017-3919-5 |
| [2] |
Hong MJ, Na DG, Baek JH, et al. Cytology-ultrasonography riskstratification scoring system based on fine-needle aspiration cytology and the korean-thyroid imaging reporting and data system[J]. Thyroid, 2017, 27: 953-959. DOI:10.1089/thy.2016.0603 |
| [3] |
Tessler FN, Middleton WD, Grant EG, et al. Re:ACR Thyroid Imaging, Reporting and Data System (TI-RADS):white paper of the ACR TI-RADS Committee[J]. J Am Coll Radiol, 2018, 15: 381382. |
| [4] |
Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer:the american thyroid association guidelines task force on thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2016, 26: 1-133. DOI:10.1089/thy.2015.0020 |
| [5] |
张峰, 姚建. 甲状腺结节的影像学研究进展[J]. 中国中西医结合影像学杂志, 2017, 15(3): 366-369. DOI:10.3969/j.issn.1672-0512.2017.03.039 |
| [6] |
梁晓雯. 图像分类技术在超声诊断甲状腺结节中的应用进展[J]. 中国医学影像技术, 2018, 34(10): 1578-1581. |
| [7] |
Horvath E, Majlis S, Rossi R, et al. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management[J]. J Clin Endocrinol Metab, 2009, 94: 1748-1751. DOI:10.1210/jc.2008-1724 |
| [8] |
Wang Y, Lei KR, He YP, et al. Malignancy risk stratification of thyroid nodules:comparisons of four ultrasound Thyroid Imaging Reporting and Data Systems in surgically resected nodules[J]. Sci Rep, 2017, 7: 11560. DOI:10.1038/s41598-017-11863-0 |
| [9] |
唐守信, 张家君. 甲状腺影像报告和数据系统临床应用进展[J]. 医学影像学杂志, 2017, 27(8): 1573-1575. |
| [10] |
徐雯, 李文波, 朱庆莉, 等.美国甲状腺协会指南甲状腺结节超声分类系统的临床应用价值[J/CD].中华医学超声杂志(电子版), 2017, 14(7): 526-531.
|
| [11] |
Park JY, Lee HJ, Jang HW, et al. A proposal for a thyroid im aging reporting and data system for ultrasound features of thy roid carcinoma[J]. Thyroid, 2009, 19: 1257-1264. DOI:10.1089/thy.2008.0021 |
| [12] |
Kwak JY, Han KH, Yoon JH, et al. Thyroid imaging reporting and data system for US features of nodules:a step in establish ing better stratification of cancer risk[J]. Radiology, 2011, 260: 892-899. DOI:10.1148/radiol.11110206 |
| [13] |
陈正雷, 张煜华. 超声对甲状腺结节性质的评价[J]. 中国中西医结合影像学杂志, 2017, 15(4): 500-503. DOI:10.3969/j.issn.1672-0512.2017.04.039 |
| [14] |
张贺香, 胡萍香, 胡业深, 等. TI-RADS分类量化评分在鉴别甲状腺结节良恶性中的应用[J]. 中国中西医结合影像学杂志, 2017, 15(3): 300-301, 304. DOI:10.3969/j.issn.1672-0512.2017.03.013 |
| [15] |
赵新保, 罗艺, 李世梅, 等. ACR TI-RADS与ATA分类法评估甲状腺结节诊断价值的比较[J]. 实用医学杂志, 2018, 34(18): 3118-3129. DOI:10.3969/j.issn.1006-5725.2018.18.032 |
 2019, Vol. 17
2019, Vol. 17


