| 肝脏快速容积采集动态增强扫描对前列腺癌的诊断价值及与血管生成对照分析 |
1b. 海交通大学附属第六人民医院南院 奉贤区中心医院病理科,上海 201499;
1c. 海交通大学附属第六人民医院南院 奉贤区中心医院泌尿科,上海 201499;
2. 复旦大学医学院附属肿瘤医院放射科,上海 200032
前列腺癌是危害老年男性健康的常见肿瘤,发病率居男性恶性肿瘤第2位[1]。近年来MRI动态增强扫描在前列腺癌诊断中的价值日益受到重视,也有不少国内外学者进行了大量研究[2-5],但因MRI机器型号及场强不同,扫描技术方法各不相同。其中肝脏快速容积采集技术(liver acceleration volume acquisition,LAVA)是一项全新影像技术,近几年才应用于前列腺疾病研究,其原理主要基于连续快速动态扫描,其动态增强扫描较一般常规扫描血流灌注速度更快,空间分辨力更高,压脂更均匀、参数更多,能反映肿瘤血流最大峰值、血流量、TIC等,更全面、准确表达前列腺病变异常血供情况。因此,LAVA动态增强扫描为准确检测前列腺肿瘤和量化肿瘤微血管生成提供了有力的技术支持。现对LAVA技术在诊断前列腺癌中的应用价值,以及前列腺病变的LAVA动态增强扫描特征与微血管密度及血管内皮生长因子的相关性作初步分析。
1 资料与方法 1.1 一般资料选取2013年6月至2016年12月在上海市奉贤区中心医院行LAVA动态增强扫描并经组织病理学证实的前列腺癌(A组)及前列腺增生(B组)患者各40例,年龄48~86岁,平均65岁。
1.2 仪器与方法采用GE Signa Excite 1.5 T超导型MRI仪,8通道腹部相阵控线圈。扫描序列及参数:常规横轴面T1WI采用快速自旋回波序列,TR 420 ms,TE 7.7 ms;横轴面T2WI采用FRFSE序列,TR 3 600 ms,TE 131 ms;冠状面采用FRFSE加脂肪抑制序列,TR 3 600 ms,TE 132 ms。增强扫描采用LAVA三维成像序列,于增强扫描前扫描1次蒙片,后经左肘前静脉快速注入Gd-DTPA,流率2 mL/s,剂量0.2 mL/kg体质量。注射对比剂10 s后开始扫描,扫描范围为前列腺及精囊腺。TR 2.9 ms,TE 1.8 ms,层厚2 mm,FOV 340 mm×340 mm,矩阵256×256,1期12~14 s,连续行15期扫描。
1.3 影像及数据分析运用GE ADW 4.4工作站分析及记录数据,对ROI的选择:结合MRI图像并对照病理结果确定病变范围,选取病变中心区域进行测量,通过工作站后处理自动生成TIC。将TIC分为3型[6]:Ⅰ型为缓慢强化型(早期强化后稳定或缓慢强化);Ⅱ型为平台型(早期强化后出现平台期);Ⅲ型为速升下降型(早期强化后随即下降)。并设定3个参数描述TIC的重要特征:①峰值时间(Tmax):增强扫描开始至信号强度达最大值的时间。②最大信号强度(SImax%):SImax%=(SImax-SIpre)/SIpre×100%。③强化率(R):R=(SImax-SIpre)/Tmax。其中SImax为强化峰值的信号强度,SIpre为注射对比剂前的信号强度。
1.4 免疫组化测定及观察分析2组病变组织病理标本均行HE染色,以及免疫组化血管内皮生长因子(VEGF)与微血管密度(MVD)测定。免疫组化染色采用上海长岛生物技术公司提供的即用型免疫组化广谱试剂盒。
免疫组化结果观察:①MVD计数,以棕黄色染色的内皮细胞或内皮细胞簇作为单个可计数的微血管,CD34染色高倍镜下(×400)每张切片计数3个“热点”,每个热点打印后人工计数,取平均值作为MVD,表示为微血管数/视野。②VEGF表达,以细胞浆呈棕黄色或棕褐色着色为VEGF阳性细胞。CD34染色高倍镜下每张切片计数3个“热点”阳性和阴性细胞数,将其分为4级:<10%阳性细胞为阴性(-),10%~<25%(+),25%~50%(++),>50%(+++)。
1.5 统计学处理采用SPSS 11.0统计软件,计量资料行独立样本t检验,计数资料行χ2检验,以P<0.05为差异有统计学意义。
2 结果 2.1 MRI表现A组38例病灶位于外周带,2例位于中央腺内,T2WI呈斑片状、结节状低信号,边界不清,5例突破包膜,7例精囊腺受累、膀胱精囊角消失。B组1例病灶位于外周带,T2WI呈低信号结节影,边界清晰;39例位于中央腺体,中央腺体体积增大,T2WI呈高低混杂信号结节,外周带受压变薄,6例外周带显示不清。LAVA增强扫描,A组23例表现为外周带病灶早期明显不均匀强化,延迟后低强化,9例结节呈持续强化;B组39例呈中央腺体结节明显不均匀强化,37例结节早期明显强化,延迟后持续强化。8例前列腺癌见盆腔淋巴结转移灶,3例见骨盆及股骨转移。
2.2 2组病变TIC类型及动态增强扫描参数A组TIC Ⅰ型8例(20.0%),Ⅱ型9例(22.5%),Ⅲ型23例(57.5%)。B组TIC Ⅰ型28例(70.0%),Ⅱ型9例(22.5%),Ⅲ型3例(7.5%);2组曲线类型分布差异有统计学意义(χ2=8.81,P<0.05)。其中B组曲线类型多呈Ⅰ型(图 1),2组均可呈Ⅱ型曲线(图 2),A组曲线类型多呈Ⅲ型(图 3)。
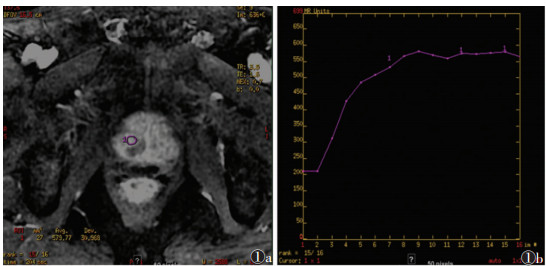 |
| 图 1 男,65岁,前列腺增生。肝脏快速容积采集技术(LAVA)增强扫描示中央腺体增生结节早期强化后缓慢强化(图 1a),TIC呈Ⅰ型(缓慢强化型)(图 1b) |
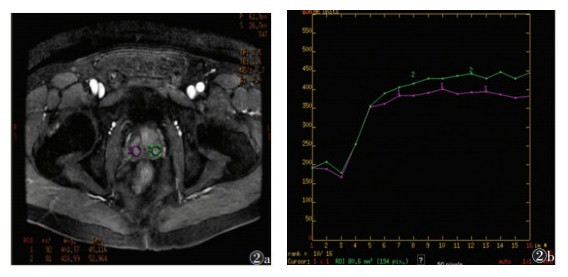 |
| 图 2 男,63岁,前列腺增生。LAVA增强扫描示中央腺体增生结节早期强化后出现平台期(图 2a),TIC呈Ⅱ型(平台型)(图 2b) |
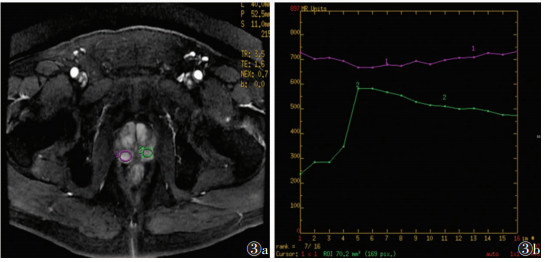 |
| 图 3 男,60岁,前列腺癌,LAVA增强扫描示左外周带结节早期强化后随即下降(图 3a),TIC呈Ⅲ型(速升下降型)(图 3b) |
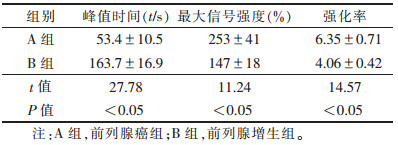
2组TIC参数对比分析见表 1。A组峰值时间早于B组,强化程度和强化率均高于B组(均P<0.05)。
| 表 1 2组TIC参数对照(x±s) |
 |
2.3 2组免疫组化对照(表 2)
| 表 2 2组免疫组化结果对照 |
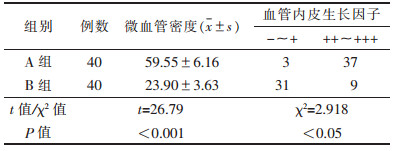 |
A组MVD值及VEGF表达明显高于B组(均P<0.05)。
3 讨论 3.1 LAVA动态增强扫描的意义目前关于MRI诊断前列腺疾病的研究较多,其中快速动态增强扫描在前列腺疾病诊断方面的价值越来越受到认可。MRI平扫常难以鉴别前列腺增生、炎症及纤维化等病变[7-8]。LAVA技术是一种快速三维容积T1WI脂肪抑制成像方法,较常规MRI增强扫描速度更快、空间分辨力及SNR更高,能从三维空间同时反映肿瘤血流最大峰值、血流量、TIC等,有利于病灶的发现和定性,以及提供更多血管解剖和动态信息。
本研究表明,TIC Ⅰ型多见于前列腺增生,Ⅱ型前列腺癌及前列腺增生均可见,Ⅲ型以前列腺癌为主。前列腺癌动态增强的强化参数与前列腺增生不同,前列腺癌的峰值时间早、最大信号强度大、强化率高,说明前列腺癌与前列腺增生动态增强扫描时强化特征不同,有利于前列腺癌的诊断及鉴别诊断。
3.2 前列腺病变的强化特征与病变组织血管生成情况研究[9]表明,肿瘤的新血管生成对实体瘤的形成及生长起着关键性作用。Folkman[10]于1971年首次提出肿瘤的生长依赖于血管形成的学说,认为当肿瘤大小超过2 mm3时,其进一步生长依赖新生血管的形成。本研究中前列腺癌MVD及VEGF表达高于前列腺增生,这与不同前列腺病变的强化特征具有相关性。研究[11]发现早期强化程度主要依靠病变组织的血管密度和对比剂进入细胞外间隙的多少,倪新初等[12-13]认为前列腺癌的微血管丰富,微血管系统的通透性高,新生的毛细血管具有不连续的基底膜,对比剂进入肿瘤组织快且多,这能解释前列腺癌的强化参数不同于前列腺增生,虽然前列腺增生血供也增加,但其血管构成与正常组织类似,未能影响血管的灌注及通透性。本研究中,前列腺癌TIC多呈Ⅲ型曲线,同时MVD和VEGF测定水平高,与文献[14-15]报道一致。
综上所述,通过LAVA动态增强扫描对前列腺病变的TIC类型和相关灌注参数进行分析,有助于前列腺癌的诊断及鉴别诊断。
| [1] |
Jemal A, Bray F, Center MM, et al. Global cancer statistic[J]. CA Cancer J Clin, 2011, 61: 69-90. DOI:10.3322/caac.v61:2 |
| [2] |
朱丹, 彭涛, 肖建明. MRI动态增强扫描对前列腺癌的诊断价值[J]. 中国中西医结合影像学杂志, 2013, 11(6): 611-613. |
| [3] |
何为, 刘毅, 刘剑羽, 等. 3.0 T MR动态增强扫描定量分析诊断前列腺癌的价值[J]. 中华放射学杂志, 2014, 48(3): 215-218. |
| [4] |
王世威, 喻迎星, 潘智勇, 等. 3.0 T定量动态对比增强MRI对中央区前列腺癌的应用价值研究[J]. 医学影像学杂志, 2014, 24(5): 824-827. |
| [5] |
Bigler SA, Deering RE, Brawer MK. Comparison of microscopic vascularity in benign and malignant prostate tissue[J]. Hum Pathol, 1993, 24: 220-226. DOI:10.1016/0046-8177(93)90304-Y |
| [6] |
Engelbrecht MR, Huisman HJ, Laheij RJ, et al. Discrimination of prostate cancer from normal peripheral zone and central gland tissue by using dynamic contrast-enhanced MR imaging[J]. Radilogy, 2003, 229: 248-254. |
| [7] |
Padhani AR, Gapinski CJ, Macvicar DA, et al. Dynamic contrast enhanced MRI of prostate cancer:correlation with morphology and tumor stage, histological grade and PSA[J]. Clin Radiol, 2000, 55: 99-109. DOI:10.1053/crad.1999.0327 |
| [8] |
Miao HD, Fukatsu H, Ishigaki T. Prostate cancer detection with 3-T MRI:comparison of diffusion-weighted and T2-weighted imaging[J]. Eur J Radiol, 2007, 61: 297-302. DOI:10.1016/j.ejrad.2006.10.002 |
| [9] |
Yoshizako T, Wada A, Hayashi T, et al. Usefulness of diffusion-weighted imaging and dynamic contrast-enhanced magnetic resonance imaging in the diagnosis of prostate transition-zone cancer[J]. Acta Radiol, 2008, 49: 1207-1213. DOI:10.1080/02841850802508959 |
| [10] |
Folkman J. Tumor angiogenesis:therapeutic implicatiom[J]. N End J Med, 1971, 285: 1182-1186. DOI:10.1056/NEJM197111182852108 |
| [11] |
Liu PF, Debatin JF, Caduff RF, et al. Improved diagnostic accuracy in dynamic contrast enhanced MRI of the breast by combined quantitative and qualitative analysis[J]. Br J Radiol, 1998, 71: 501. DOI:10.1259/bjr.71.845.9691895 |
| [12] |
倪新初, 沈钧康, 陆之安, 等. 前列腺癌与良性前列腺增生症的动态增强与血管生成的相关性研究[J]. 中华放射学杂志, 2005, 39(1): 54-59. |
| [13] |
倪新初, 沈钧康, 陆之安, 等. 前列腺癌的MR动态增强特征与微血管密度和前列腺特异性抗原的相关性的初步研究[J]. 临床放射学杂志, 2005, 24(1): 885-888. |
| [14] |
Stefanou D, Batistatou A, Kamina S, et al. Expression of vascular endothelial growth factor (VEGF) and association with microvessel density in benign prostatic hyperplasia and prostate cancer[J]. In Vivo, 2004, 18: 155-160. |
| [15] |
Ren J, Huan Y, Wang H, et al. Dynamic contrast-enhanced MRI of benign prostatic hyperplasia and prostatic carcinoma:correlation with angiogenesis[J]. Clin Radiol, 2008, 63: 153-159. DOI:10.1016/j.crad.2007.07.023 |
 2018, Vol. 16
2018, Vol. 16

