| 6例儿童粒细胞肉瘤的CT及MRI表现 |
粒细胞肉瘤(granulocytic sarcoma,GS)是一种或多种原始粒细胞骨髓腔外的增殖性病变,可孤立存在或继发于急性髓细胞性白血病(acute myelogenous leukemia,AML)或慢性粒细胞白血病(chronic myelocytic leukemia,CML)急性发作期及治疗缓解期,可累及1个或多个部位,好发于皮肤、淋巴结、生殖器、胃肠道、骨髓及中枢神经系统。成人AML中GS的发病率为2%~5%,儿童发病率远高于成人,可达2.5%~8%[1-5]。因GS较罕见,且影像学表现缺乏明显特异性,故诊断率较低。本研究旨在总结我院既往确诊GS患者的影像学表现,提高诊断水平。
1 资料与方法 1.1 一般资料收集2018年1月至2021年5月我院收治的经病理及免疫组织化学诊断的GS患儿6例,其中男3例,女3例;年龄4.0~8.5岁,中位年龄6.1岁。
1.2 仪器与方法6例中,3例行MRI检查,2例行CT检查,1例行CT与MRI检查。患儿检查前禁食3~4 h,年龄较小不能配合者给予口服水合氯醛(剂量0.5 mL/kg体质量)镇静,取仰卧位。MRI检查采用Siemens Skyra 3.0 T超导型MRI扫描仪,根据病变部位采用不同线圈。常规平扫采用FSE序列行横轴位和冠状位T1WI,TR/TE 400~600 ms/10 ms;T2WI TR/TE 3 000~5 000 ms/80 ms;层厚3~5 mm,层距1.0~1.5 mm,视野30 cm×40 cm。根据检查部位行脂肪抑制T1WI或T2WI序列扫描;增强扫描采用脂肪抑制T1WI行横轴、矢状和冠状位扫描,经肘静脉注射对比剂Gd-DTPA,剂量0.2 mmol/kg体质量。
CT检查采用Philips 64排CT机。患儿取仰卧位,头先进,根据不同部位采用不同的管电压和管电流(头、体、腹部管电压分别125、120、140 kV,管电流分别125、260、350 mA),层距5 mm,层厚5 mm;增强扫描使用碘海醇对比剂,剂量0.2 mL/kg体质量,给予少量生理盐水冲管。
1.3 图像分析由2名医师共同阅片,主要分析病灶密度/信号是否均匀、强化方式、内部特征(出血、坏死、钙化)、大小、边界(清晰、模糊)、形态(规整、不规整)、与周围结构关系(与血管关系、是否伴远处转移),以及邻近骨质改变等。
2 结果6例中,既往确诊AML 4例(图 1),CML 1例,孤立性GS 1例(6个月后发展为AML)。4例为孤立性病灶,1例为2处病灶,1例病灶位于肠系膜周围,呈多发性并部分融合,而难以确定病灶数量。
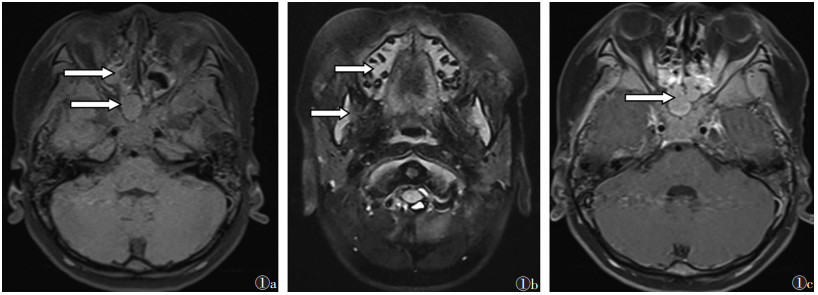 |
| 图 1 编号2患者,男,4岁7个月,急性髓细胞性白血病(AML) 图 1a 脂肪抑制T1WI序列示副鼻窦腔(箭头)、左颞部脑外间隙(箭头)团块状均匀等及等高信号 图 1b 脂肪抑制T2WI序列示下颌骨信号增高 图 1c 增强扫描病灶呈均匀显著强化S |
6例GS患儿的影像学表现与免疫组化检查结果见表 1。6例病灶在体部及四肢均表现为软组织密度影,CT值30~55 HU,1例病灶中心出现坏死区,余病灶性质较均匀,但范围较大,直径2.6~18.3 cm,呈结节状或团块状改变,境界清晰或模糊,邻近骨质可伴溶骨性改变。MRI对比同层肌肉或皮质均呈等、等高信号;增强扫描呈不均匀明显强化。
| 表 1 6例GS患儿的影像学表现与免疫组化检查结果 |
 |
6例瘤细胞呈圆形、卵圆或形态不规则,包浆少,核分裂可见,弥漫性分布。骨髓活检均见幼稚细胞弥漫增生。
3 讨论GS男女发病率无显著差异[6],本组6例,男女比例1∶1。根据发病部位不同,GS影像表现有一定同质性及异质性,在MRI及CT以均匀实性改变多见(83.3%),以等、等高密度/信号为主,钙化及出血发生率较低[7],邻近骨质可发生溶骨性改变。本组患者根据影像特点可归纳为中枢性与外周性GS。中枢性GS多具有通过硬脑膜直接延伸特点,肿瘤基底部常附着于硬膜,增强扫描示硬脑膜显著强化[8],并能观察到脑膜病变显著大于脑实质病变,且颅内因GS细胞排列较密集,弥散受限明显。GS属于脑外肿瘤,不含神经元,MRS可表现为高Cho峰,NAA峰和Cr峰则检测不到[9],这些可与脑内肿瘤鉴别。本组颅内GS边缘欠规整,占位效应显著,增强扫描强化明显,位置略靠近中线,继发性脑积水显著,均符合恶性肿瘤影像特点[10],需与脑膜瘤进行鉴别,脑膜瘤影像特征与颅内GS较相似,但脑膜瘤在儿童中发病率较低,且多伴钙化,DWI呈等或稍高信号,ADC信号无明显减低[11]。当中枢性GS部分病灶出现等密度/信号改变时,可很快伴随坏死及出血性改变,此时应警惕与颅内出血鉴别[12]。
本组1例腹部肠系膜发病者病理及免疫组织化学确诊为孤立性GS,后期随访6个月,患儿继发为AML,这与Neiman等[13]研究中15例孤立性GS,平均随访15个月,其中13例发展为AML相符。本组该例患儿病灶集中发生于肠系膜周围,病灶体积较大,且部分融合,可见分叶,平均长径约4.3 cm,邻近肠管部分受压并管腔狭窄。这在儿童中应与神经源性肿瘤鉴别,神经源性肿瘤好发于后腹膜,且多伴沙砾状钙化,肿块体积较大时,常伴坏死,出血少见[14]。本组1例发病于颌面部,需与横纹肌肉瘤鉴别,后者虽好发生于头颈部但集中发生于鼻腔及筛窦,病灶体积较大时伴坏死或囊变,偶见钙化,罕见出血,多伴邻近骨质虫蚀状破坏,且实体肿瘤范围显著大于骨皮质破坏范围,增强扫描后强化表现各异,呈均匀或不均匀强化[15]。此外,GS与体部淋巴瘤及中枢原发性淋巴瘤影像学鉴别诊断仍较困难,可结合临床病史进行鉴别。白血病随病情进展可伴随骨髓T1WI信号减低[16],本组5例白血病患儿中椎体T1WI信号弥漫性减低4例,而1例孤立性GS患儿腰骶椎髓腔均未发现异常,但6个月后发展为AML时脊柱椎体T1WI信号已弥漫性减低。
综上所述,尽管GS无明确影像特点,但当发现1个或多个较均匀实性占位性病变,可随机分布在全身各部位,可伴出血或坏死等,体积一般较大,邻近骨质伴溶骨性改变时,应考虑GS的可能;最终结果仍须结合临床、病理及免疫组织化学。若患儿有白血病等基础病时,则应首先考虑GS。
| [1] |
ZHOU X, LI C. Long-term survival in an acute promyelocytic leukemia patient with recurrent granulocytic sarcomas: a case report[J]. Medicine (Baltimore), 2021, 100(14): 25257. DOI:10.1097/MD.0000000000025257 |
| [2] |
SAMBORSKA M, DERWICH K, SKALSKA-SADOWSKA J, et al. Myeloid sarcoma in children-diagnostic and therapeutic difficul-ties[J]. Contemp Oncol (Pozn), 2016, 20(6): 444-448. |
| [3] |
HU G, LU A, WU J, et al. Characteristics and prognosis of pedi-atric myeloid sarcoma in the cytogenetic context of t (8;21)[J]. Pediatr Hematol Oncol, 2021, 38(1): 14-24. DOI:10.1080/08880018.2020.1803462 |
| [4] |
SHAN M, LU Y, YANG M, et al. Characteristics and transplant outcome of myeloid sarcoma: a single-institute study[J]. Int J Hematol, 2021, 113(5): 682-692. DOI:10.1007/s12185-021-03081-2 |
| [5] |
XU L H, WANG Y, CHEN Z Y, et al. Myeloid sarcoma is asso-ciated with poor clinical outcome in pediatric patients with acute myeloid leukemia[J]. J Cancer Res Clin Oncol, 2020, 146(4): 1011-1020. DOI:10.1007/s00432-020-03128-7 |
| [6] |
OOI G C, CHIM C S, KHONG P L, et al. Radiologic manifesta-tions of granulocytic sarcoma in adult leukemia[J]. AJR Am J Roentgenol, 2001, 176(6): 1427-1431. DOI:10.2214/ajr.176.6.1761427 |
| [7] |
刘海燕, 印洪林, 杜军, 等. 粒细胞肉瘤38例临床病理分析[J]. 中华病理学杂志, 2010, 39(3): 172-176. DOI:10.3760/cma.j.issn.0529-5807.2010.03.006 |
| [8] |
韩涛, 周俊林. 脑膜瘤分级分型影像学研究进展[J]. 磁共振成像, 2021, 12(7): 94-97. |
| [9] |
BUJOLD K E, DANDEKAR S, BARBOUR M. Successful treatment of relapsed pediatric acute myeloid leukemia presenting as central nervous system myeloid sarcoma: a single-institution case series[J]. J Pediatr Hematol Oncol, 2020, 42(4): 319-321. DOI:10.1097/MPH.0000000000001383 |
| [10] |
KOBAYASHI K, ANDO K, NAKASHIMA H, et al. Characteristics of cases with and without calcification in spinal meningiomas[J]. J Clin Neurosci, 2021, 89: 20-25. DOI:10.1016/j.jocn.2021.04.019 |
| [11] |
RAMOS SOCARRAS AE, VALLES GAMBOA M E, RODRIGUEZ NUEZ R, et al. Gastrointestinal stroma tumor[J]. Rev Gastroenterol Peru, 2014, 34(3): 237-241. |
| [12] |
A.J. BARKOVICH, K.R. MOORE, E. GRANT, et al. More Diag-nostic Imaging Pediatric Neuroradiology[M]. 3rd ed. Salt Lake City, Utah, Amirsys-Elsevier, 2007: 551-553.
|
| [13] |
NEIMAN R S, BARCOS M, BERARD C, et al. Granulocytic sarcoma: a clinicopathologic study of 61 biopsied cases[J]. Cancer, 1981, 48(6): 1426-1437. DOI:10.1002/1097-0142(19810915)48:6<1426::AID-CNCR2820480626>3.0.CO;2-G |
| [14] |
ZHI T, ZHANG W L, ZHANG Y, et al. Prevalence, clinical features and prognosis of malignant solid tumors in infants: a 14-year study[J]. Bosn J Basic Med Sci, 2021, 21(5): 598-606. |
| [15] |
胡亚美, 江载芳, 申昆玲, 等. 诸福棠实用儿科学[M]. 8版. 北京: 人民卫生出版社, 2014: 839-868.
|
| [16] |
SHAN M, LU Y, YANG M, et al. Characteristics and transplant outcome of myeloid sarcoma: a single-institute study[J]. Int J Hematol, 2021, 113(5): 682-692. DOI:10.1007/s12185-021-03081-2 |
 2022, Vol. 20
2022, Vol. 20


