| 基于对比增强能谱X线摄影影像组学模型预测三阴性乳腺癌的价值 |
2. 山东省烟台毓璜顶医院影像科,山东 烟台 264000
乳腺癌是女性最常见的恶性肿瘤[1]。由于三阴性乳腺癌缺乏用于治疗的雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)及表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)基因的表达,治疗困难,预后较差[2]。因此,早期明确诊断三阴性乳腺癌并及时进行针对性治疗尤为重要。
乳腺对比增强能谱X线摄影(contrast-enhanced spectral mammography,CESM)已成为诊断乳腺疾病的主要检查方法之一[3],然而肉眼观察对判断其分子分型价值有限。影像组学是一种运用计算机算法从医学影像图像中高通量地提取数字化特征的方法[4],具有一定的临床应用价值[5-6]。基于CESM的影像组学预测三阴性乳腺癌的价值已有文献报道[7-8],但缺少测试集且对模型的评价方法过于单一。因此,笔者将研究对象分为测试集及训练集,并运用更完善的模型评估方法,进一步探讨基于CESM重建图的影像组学模型预测三阴性乳腺癌的价值。
1 资料与方法 1.1 一般资料回顾性分析2017年7月至2020年6月在烟台毓璜顶医院行乳腺CESM检查的女性乳腺癌患者787例。本研究经烟台毓璜顶医院医学伦理委员会同意。其中检查时间为2017年7月至2019年10月的605例患者为训练集,检查时间为2019年11月至2020年6月的182例患者为测试集。训练集中非三阴性乳腺癌502例,三阴性乳腺癌103例;测试集中非三阴性乳腺癌153例,三阴性乳腺癌29例。为解决训练集患者分类不平衡问题,从训练集非三阴性乳腺癌患者中随机删除399例,三阴性乳腺癌患者与非三阴性乳腺癌患者各103例。
1.2 纳入及排除标准① 纳入标准:行CESM检查,且病理证实为乳腺癌;其分子分型经免疫组化检查证实。②排除标准:CESM检查前有乳腺手术、化疗、放疗、激素、靶向治疗史;患有其他恶性肿瘤;图像质量不理想;多灶性乳腺癌;非肿块型乳腺癌;临床资料不完整者。
1.3 仪器与方法采用GE Senographe DS全数字化乳腺机。对比剂为碘海醇(碘含量350 mg/mL),剂量1.3 mL/kg体质量,注射流率3.0 mL/s。注射2 min后开始采集图像,按常规乳腺摄影时的压迫方法,选取头尾位及内外斜位进行投照,在5 min内完成4个视图的采集,即头尾位与内外斜位的低能图、重建图。首先采集正常侧乳腺的图像,然后采集病变侧乳腺的图像。由2名低年资医师(医师1、2,均有4年CESM诊断经验)使用Radcloud软件(http://radcloud.cn)分别在头尾位、内外斜位重建图中手动勾画肿瘤的边界,勾画ROI(图 1);再由1名高年资医师(医师3,具有10年乳腺影像诊断经验)进行审核。
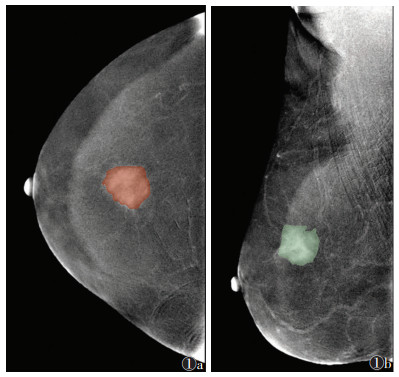 |
| 图 1 女,62岁,ROI勾画示意图 图 1a 头尾位勾画示意图 图 1b 内外斜位勾画示意图 |
1.4 影像组学特征的提取及一致性
运用Radcloud软件提取影像组学特征,包括一阶统计学特征、形状特征及纹理特征。勾画ROI时,随机选择150例患者,由2名医师同时勾画,根据ROI内的影像组学特征评估2名医师每个特征的一致性;2周后由医师1再次勾画,评估ROI内每个影像组学特征不同时间的一致性,保留具有较高一致性的影像组学特征进一步分析。余238例图像的ROI由医师1勾画完成。
1.5 选择影像组学特征与建立模型对训练集影像组学特征行单变量分析,保留在三阴性乳腺癌患者与非三阴性乳腺癌患者中差异有统计学意义的特征。后运用最小绝对值收敛和选择算子(least absolute shrinkage and selection operator,LASSO)算法对影像组学特征进一步筛选,结合十折交叉验证选择LASSO中超参数λ的最佳取值。筛选剩余影像组学特征建立用于预测三阴性乳腺癌的逻辑回归模型。
1.6 模型评价运用模型计算每例患者为三阴性乳腺癌的概率,训练集的约登指数作为截断值,概率大于该截断值则预测为三阴性乳腺癌。运用ROC曲线(准确率及平衡准确率)对模型的预测性能进行评估,其中平衡准确率为特异度与敏感度的平均值。运用自举法计算AUC的95%置信区间(95%CI)。运用决策曲线对模型在测试集中不同诊断阈值的净收益进行评估。净收益为以该阈值为诊断阈值时,对患者进行治疗后综合考虑未获益患者比例与获益患者比例后获得的获益,以帮助临床医师进行临床决策。
1.7 统计学分析运用R(3.6版本)进行统计分析。患者年龄以x±s表示,分别统计训练集、测试集中不同分子分型、乳腺影像报告和数据系统(prostate imaging reporting and data system,PI-RADS)分类及组织学分级的患者例数。运用组内相关系数(intraclass correlation coefficient,ICC)评价特征的一致性,不同医师与不同时间的ICC均大于0.8则相应影像组学特征具有较高的一致性。当计量资料满足正态性及方差齐性时,运用单变量方差分析,否则运用Mann-Whitney U检验。以P<0.05为差异有统计学意义。
2 结果 2.1 一般资料训练集206例,年龄(55.18±10.25)岁,其中Luminal A型、Luminal B型、Her-2过表达型及三阴性乳腺癌分别为41、39、23、103例,PI-RADS分类Ⅲ、Ⅳ、Ⅴ类患者分别为41、145、20例,组织学分级为Ⅰ、Ⅱ、Ⅲ级患者分别47、82、72例。测试集182例,年龄(54.36±10.05)岁,其中Luminal A型、Luminal B型、Her-2过表达型及三阴性乳腺癌分别为59、64、30、29例,PI-RADS分类Ⅲ~Ⅴ类分别为33、131、18例,组织学分级Ⅰ~Ⅲ级分别为44、77、61例。
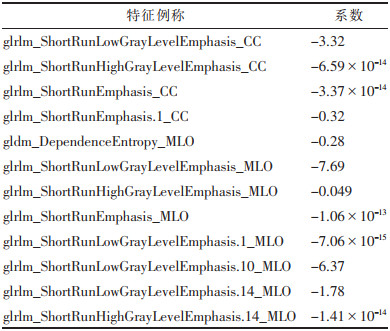
2.2 特征筛选在1 409个特征中1 056个特征具有较高的一致性,最终12个影像组学特征纳入模型,其中4个提取自头尾位重建图像,8个提取自内外斜位重建图像。12个影像组学特征均为纹理特征。模型例称及其相应系数见表 1。
| 表 1 模型中包含的特征及参数 |
 |
2.3 模型评价
模型在训练集及测试集中的AUC分别为0.87[95%CI(0.82,0.92)]、0.86[95%CI(0.80,0.92)],截断值为0.54,准确率分别为0.81、0.77,敏感度分别为0.79、0.76,特异度分别为0.83、0.77,平衡准确率分别为0.81、0.76(图 2a)。在对测试集进行的决策曲线分析中,阈值概率<0.68时,其净收益大于“均为阳性”与“均为阴性”模型(图 2b)。
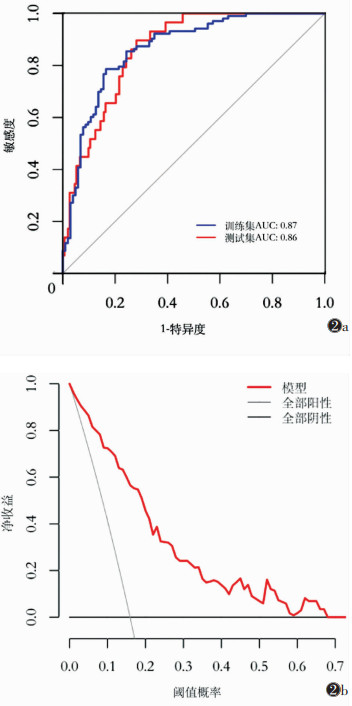 |
| 图 2 模型的评价 图 2a 模型在训练集与测试集中的ROC曲线 图 2b 模型在测试集中的决策曲线 |
3 讨论
三阴性乳腺癌由于其独特的生物学特性,早期明确诊断对提高疗效、改善患者预后具有重要意义。本研究基于CESM检查头尾位与内外斜位重建图的影像组学特征建立逻辑回归模型预测三阴性乳腺癌,在训练集与测试集中均有良好表现,在决策曲线分析中表现出了较高的净收益。
目前已有相关研究探究了基于CESM的影像组学对预测三阴性乳腺癌的价值。La等[7]提取了CESM图像内的影像组学特征并建立模型区分三阴性乳腺癌与非三阴性乳腺癌,AUC为0.76。但该研究仅52例患者,缺少测试集,结果缺乏可靠性。此外,模型的评价指标仅包含AUC。Marino等[8]评估了基于100例患者CESM图像的影像组学模型对预测乳腺癌分子分型的价值;虽然模型在预测三阴性乳腺癌时准确率高达100%,但依旧缺少测试集,结果缺乏可靠性,需进一步验证;对模型的评估仅用到了准确率,评价指标过于单一,未对模型全面评估。本研究共纳入388例患者,其中测试集182例,且运用ROC曲线对模型进行评估,均取得良好表现;其中AUC高于La Forgia等[7]的研究,训练集准确率低于Marino等[8]的研究,这可能是由于其模型存在过拟合,而本研究为解决过拟合问题,在运用LASSO筛选特征的过程中运用了十折交叉验证。
在机器学习的分类模型训练过程中,因变量分类不平衡是常见的问题之一。在既往研究中,通常运用系统性过采样(synthetic minority oversampling,SMOTE)算法解决分类不平衡问题[9-12]。该算法虽解决了分类不平衡问题,但易导致部分训练集数据并非患者真实数据,对模型准确率造成一定影响。本研究非三阴性乳腺癌患者多于三阴性乳腺癌患者,分类不平衡问题明显,后运用随机欠采样方法删除部分训练集中的非三阴性乳腺癌患者,使训练集中三阴性乳腺癌患者与非三阴性乳腺癌患者的数量达到平衡,测试集中保持原始样本量,既解决了训练集分类不平衡问题,又客观地反映了模型在真实三阴性乳腺癌与非三阴性乳腺癌患者比例下的表现。
MRI检查是目前乳腺癌最重要的诊断方法之一[13-14]。Wang等[15]研究了基于动态增强扫描MRI检查(dynamic contrast enhanced-magnetic resonance imaging,DCE-MRI)的影像组学模型预测三阴性乳腺癌的价值,AUC达0.78。Leithner等[16]建立了基于DCE-MRI和ADC图的影像组学特征模型预测乳腺癌分子分型的模型,在预测三阴性乳腺癌中AUC达0.86。本研究中模型在测试集中的AUC为0.86,表明基于CESM重建图像的影像组学模型预测三阴性乳腺癌的表现不差于DCE-MRI。
本研究存在一定的局限性:①为回顾性研究,且样本来自单中心,应运用前瞻性多中心研究进一步探究;②手动勾画ROI,效率低下,不利于大样本研究,且存在一定主观性,对结果的可重复性造成了一定影响;③模型仅应用了影像组学特征,未加入临床预测因子,应加入临床预测因子对模型进一步优化;④应用的机器学习方法单一,应加入深度学习进一步探究;⑤影像组学特征仅提取于重建图像,应结合低能图像影像组学特征对模型进一步优化。
综上所述,基于CESM重建图像的影像组学模型对预测三阴性乳腺癌具有一定的价值。在未来的研究中应进一步加大样本量并结合深度学习进行多中心研究,提高模型的预测效能。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
HARBECK N, PENAULT-LLORCA F, CORTES J, et al. Breast cancer[J]. Nat Rev Dis Primers, 2019, 5(1): 66. DOI:10.1038/s41572-019-0111-2 |
| [3] |
RUDNICKI W, HEINZE S, NIEMIEC J, et al. Correlation between quantitative assessment of contrast enhancement in contrast-enhanced spectral mammography (CESM) and histopathology-preliminary results[J]. Eur Radiol, 2019, 29(11): 6220-6226. DOI:10.1007/s00330-019-06232-6 |
| [4] |
LAMBIN P, LEIJENAAR R T H, DEIST T M, et al. Radiomics: the bridge between medical imaging and personalized medicine[J]. Nat Rev Clin Oncol, 2017, 14(12): 749-762. DOI:10.1038/nrclinonc.2017.141 |
| [5] |
ZHANG H, LI X, ZHANG Y, et al. Diagnostic nomogram based on intralesional and perilesional radiomics features and clinical factors of clinically significant prostate cancer[J]. J Magn Reson Imaging, 2021, 53(5): 1550-1558. DOI:10.1002/jmri.27486 |
| [6] |
MAO N, YIN P, LI Q, et al. Radiomics nomogram of contrast-enhanced spectral mammography for prediction of axillary lymph node metastasis in breast cancer: a multicenter study[J]. Eur Radiol, 2020, 30(12): 6732-6739. DOI:10.1007/s00330-020-07016-z |
| [7] |
LA FORGIA D, FANIZZI A, CAMPOBASSO F, et al. Radiomic analysis in contrast-enhanced spectral mammography for predicting breast cancer histological outcome[J]. Diagnostics (Basel), 2020, 10(9): 708. DOI:10.3390/diagnostics10090708 |
| [8] |
MARINO M A, PINKER K, LEITHNER D, et al. Contrast-enhanced mammography and radiomics analysis for noninvasive breast cancer characterization: initial results[J]. Mol Imaging Biol, 2020, 22(3): 780-787. DOI:10.1007/s11307-019-01423-5 |
| [9] |
MA W, ZHAO Y, JI Y, et al. Breast cancer molecular subtype prediction by mammographic radiomic features[J]. Acad Radiol, 2019, 26(2): 196-201. DOI:10.1016/j.acra.2018.01.023 |
| [10] |
MIN X, LI M, DONG D, et al. Multi-parametric MRI-based radiomics signature for discriminating between clinically significant and insignificant prostate cancer: cross-validation of a machine learning method[J]. Eur J Radiol, 2019, 115: 16-21. DOI:10.1016/j.ejrad.2019.03.010 |
| [11] |
OSMAN S O S, LEIJENAAR R T H, COLE A J, et al. Computed tomography-based radiomics for risk stratification in prostate cancer[J]. Int J Radiat Oncol Biol Phys, 2019, 105(2): 448-456. DOI:10.1016/j.ijrobp.2019.06.2504 |
| [12] |
CHEN T, LI M, GU Y, et al. Prostate cancer differentiation and aggressiveness: assessment with a radiomic-based model vs. PIRADS v2[J]. J Magn Reson Imaging, 2019, 49(3): 875-884. DOI:10.1002/jmri.26243 |
| [13] |
COMSTOCK C E, GATSONIS C, NEWSTEAD G M, et al. Comparison of abbreviated breast MRI vs digital breast tomosynthesis for breast cancer detection among women with dense breasts undergoing screening[J]. JAMA, 2020, 323(8): 746-756. DOI:10.1001/jama.2020.0572 |
| [14] |
MANN R M, KUHL C K, MOY L. Contrast-enhanced MRI for breast cancer screening[J]. J Magn Reson Imaging, 2019, 50(2): 377-390. DOI:10.1002/jmri.26654 |
| [15] |
WANG J, KATO F, OYAMA-MANABE N, et al. Identifying triple-negative breast cancer using background parenchymal enhancement heterogeneity on dynamic contrast-enhanced MRI: a pilot radiomics study[J]. PLoS One, 2015, 10(11): 143308. |
| [16] |
LEITHNER D, MAYERHOEFER M E, MARTINEZ D F, et al. Non-invasive assessment of breast cancer molecular subtypes with multiparametric magnetic resonance imaging radiomics[J]. J Clin Med, 2020, 9(6): 1853. DOI:10.3390/jcm9061853 |
 2021, Vol. 19
2021, Vol. 19


